Кардиоактивность раков Cherax quadricarinatus (Von Martens 1868) в различных физиологических состояниях
Автор: Сладкова Светлана Владимировна, Холодкевич Сергей Викторович, Сафронова Дарья Вячеславовна, Борисов Ростислав Русланович
Журнал: Принципы экологии @ecopri
Рубрика: Аналитический обзор
Статья в выпуске: 3 (24) т.6, 2017 года.
Бесплатный доступ
Исследовали суточный кардиоритм раков Cherax quadricarinatus, содержавшихся в лабораторных условиях в режиме освещенности 12С:12Т. В течение нескольких месяцев неинвазивно регистрировали ЧСС в режиме реального времени, используя оригинальный волоконно-оптический метод. Установлено, что после некоторого периода акклимации у раков устанавливается ярко выраженный суточный ритм, который изменяется на предлиночной стадии линочного цикла и пропадает совсем за 3-5 дней, непосредственно предшествующих линьке. Показано, что обнаруженные в указанных экспериментальных условиях изменения хронотропных характеристик кардиоактивности, в том числе и кардиоритма, могут служить надежными критериями для оценки функционального состояния раков, которые используются в качестве тест-организмов для оценки экологического состояния поверхностных вод.
Раки cherax quadricarinatus, кардиоактивность, циркадный ритм, линька
Короткий адрес: https://sciup.org/147112870
IDR: 147112870 | УДК: 574.24,
Текст научной статьи Кардиоактивность раков Cherax quadricarinatus (Von Martens 1868) в различных физиологических состояниях
^ПРИНЦИПЫ ЭКОЛОГИИ
http://ecopri/ru
E-mail: http://ecopri/ru
Муха Черная львинка ( Hermetia illucens, или Черный солдатик – Black Soldier Fly) – это крупная американская муха из семейства львинок (Stratiomyidae), естественный ареал распространения которой считается Северная и Южная Америка (Rozkošný, 1983). Насекомое относится к числу немногих видов беспозвоночных, способных круглогодично развиваться в чистой культуре в замкнутом пространстве искусственных условий, что позволяет использовать вид в биотехнологических целях (Ушакова, Некрасов, 2015). В наши дни биотехнология, как перспективное направление науки, связанное с разведением живых организмов в производственных целях, имеет огромное экологическое и биологическое значение. Объектами исследования могут служить многочисленные представители групп живых организмов – микроорганизмы (вирусы, бактерии, проти-сты, дрожжи и др.), растения, животные, а также насекомые, к числу которых относится изучаемый представитель – муха Черная львинка.
Цель – провести анализ существующих исследований и рассмотреть опыт по адаптации и перспективы разведения мухи Черная львинка в приарктическом регионе на территории Архангельской области.
Аналитический обзор
Насекомые составляют ≈80 % глобального разнообразия видов, а также это самый обильный по численности и по биомассе класс сухопутных животных, которых отличает высокая плодовитость и способность к массовому размножению. В последнее десятилетие во всем мире наблюдается повышенный интерес к насекомым как источнику высокоусвояемого кормового белка, жира с уникальными свойствами, антиоксидантов, иммуномодуляторов, сырья для получения новых лекарственных средств (Kroeckel et al., 2012; Stamer et al., 2014; Józefiak et al., 2016). Немаловажным фактором является возможность некоторых видов содержаться в культуре в искусственных условиях. Это позволяет использовать их в качестве новых промышленных продуцентов, получать физиологобиохимические и генетические характеристики конкретной культуры, контролиро-
Рецензент: Н. А. Галибина
Рецензент : В. А. Илюха
Подписана к печати: 07 ноября 2017 года
вать процессы биоконверсии субстратов, на которых развиваются насекомые, а также оценивать качественные и количественные показатели продуктов переработки биомассы насекомых для последующего применения в кормах, ветеринарии, фармакологии. Кормовой белок, полученный путем переработки насекомых, представляет собой муку (шрот) из взрослых особей или их личинок. Его можно использовать в качестве компонента корма в рационе свиней, крупного рогатого скота, домашней птицы и рыбы (Tran, Gnaedinger, Mélin, 2015).
Разработка основ технологии разведения личинок мухи Черная львинка (Hermetia illucens), обеспечивающей получение высокоэффективного белково-липидного компонента кормовых рационов, – актуальная тема, значение которой существенно повысилось в настоящее время в связи с необходимостью импортозамещения компонентов кормов для сельскохозяйственных животных и рыб. Муха получила большую популярность в последнее десятилетие за счет внедрения в качестве кормового объекта для рептилий, птиц и других животных (Kroeckel et al., 2012; Stamer et al., 2014; Józefiak et al., 2016). Прежде всего это связано с высокой питательностью личинок, выращенных на органических отходах, которые содержат протеины (≈40 %) и жиры (≈40 %). В составе жирных кислот 50 % приходится на лауриновую кислоту, а также кальций, фосфор и железо (Ушакова, Некрасов, 2015). Личинки содержат полезные органические соединения, которые имеют коммерческую и промышленную ценность. К числу таких элементов относится: 42.1 % – сырой протеин; 34.8 % – липиды; 7.0 % – сырая клетчатка; 7.9 % – влага; 1.4 % – свободный экстракт азота; 14.6 % – зола; 5.0 % – кальций; 1.5 % – фосфор (Alvarez, 2012). Биомасса личинок используется для получения белкового продукта для кормопроизводства. Личинки применяются в системах аквакультуры, поскольку отрасль сталкивается с потенциальным дефицитом кормового белка. В связи с высоким содержанием данных элементов личинки мухи могут использоваться в качестве корма для форели. Они обладают низким содержанием Омега-3 и Омега-6 жирных кислот, но, в зависимости от типа питания, содержание данных компонентов в личинках увеличивается (St-Hilliare, 2007).
Схожая ситуация в области животноводства. Географическая изоляция производства рыбы и упадок мировых рыбных запасов могут способствовать дефициту рыбной муки, которая является основным источником белка в питании животных. Добавление личинок мухи Черная львинка в корм крупному рогатому скоту и птице обеспечит альтернативный источник белка в животноводческой промышленности, создаст профиль питания животных и удовлетворит особые пищевые потребности (Papadoyianis, 2007).
Процесс уничтожения твердых отходов претерпел значительные изменения со времен возникновения практики открытого сжигания. Современные методы уничтожения включают в себя уменьшение их количества, повторное использование, переработку и компостирование. Использование мух Черная львинка для уничтожения отходов не новый процесс (Alvarez, 2012). Этот вид используют для стабилизации проблемных отходов, включая навоз свиней и птицы. Личинки способны переваривать органические порции твердых биологических составляющих, осадки сточных вод и отходы от обработки рыбы и мяса, фрукты, овощи, отходы из ресторанов и кухонные отходы (Sheppard et al., 2002). Максимальная скорость биоконверсии не менее 0.9 кг/день/м2, удельная производительность не менее 25 мг субстра-та/личинка/сутки при плотности посадки 5 особей на см2 (Бастраков, Загорский, 2014).
Способ уничтожения отходов с применением личинок мухи не похож на любой другой метод утилизации. С его использованием органические остатки не подвергаются обязательному механическому измельчению. Личинки черной львинки сами измельчают их на практически одинаковые, маленькие частицы в процессе поедания и переваривания. После того, как личинки извлекут из массы органических отходов все питательные вещества, объем отходов уменьшится на 70-80 %. Да и сами отходы после уничтожения отходами уже не являются – они представляют собой высокоценное и экологически чистое, полное удобрение для растений (зоогумус) (Серебрянский, 2015) .
Оба процесса (биоконверсия отходов и использование личинок в качестве корма) обусловлены наличием двойной пользы и полностью дополняют друг друга – личинки утилизируют навоз и органические отходы и сами становятся хорошим кормом для жи вотных. Однако, по мнению западных исследователей, биомассу личинок следует обрабатывать высушиванием и проверять на наличие или отсутствие кишечных патогенов (Lalander et al., 2013), а накапливание тяжелых металлов (кадмий) потенциально ограничивает использование личинок в производстве корма для животных при кормлении их некоторыми отходами (Diener, Zurbrügg, Tockner, 2015). Повышение температуры при биоконверсии (до 45 0С) и сушка (t = 105120 оС) обеспечивают снижение количества бактерий (Циммер, 2013). Согласно исследованиям, при развитии личинок значительное число патогенов (Escherіchіa colі O157:H7 (STEC O157) и Salmonella enterica в курином помете) подавляется (Erickson et al., 2004), что объясняет наличие антимикробных протеинов у насекомых (Hattori, 1995).
Черная львинка ( Hermetia illucens ) в основном распространена в субтропическом климате. По внешнему виду и по поведению схожа с осой, однако в отличие от осы у нее только одна пара крыльев, нет жала и темный одноцветный окрас тела. В течение своего жизненного цикла муха проходит пять стадий: яйцо, личинка, предкуколка, куколка и взрослая особь (Paola, Anabel, Santo, 2013).
Личинки Hermetia illucens (в длину могут достигать до 27 мм) тусклые, белого цвета с золотисто-желтыми волосками (Diclaro, 2010). Они имеют небольшую выступающую желтовато-коричневую голову с ротовым аппаратом. На боковой стороне головы расположены светло-желтые глазные протуберанцы, в то время как усики расположены очень низко и антеролатерально (Rozkošný, 1983).
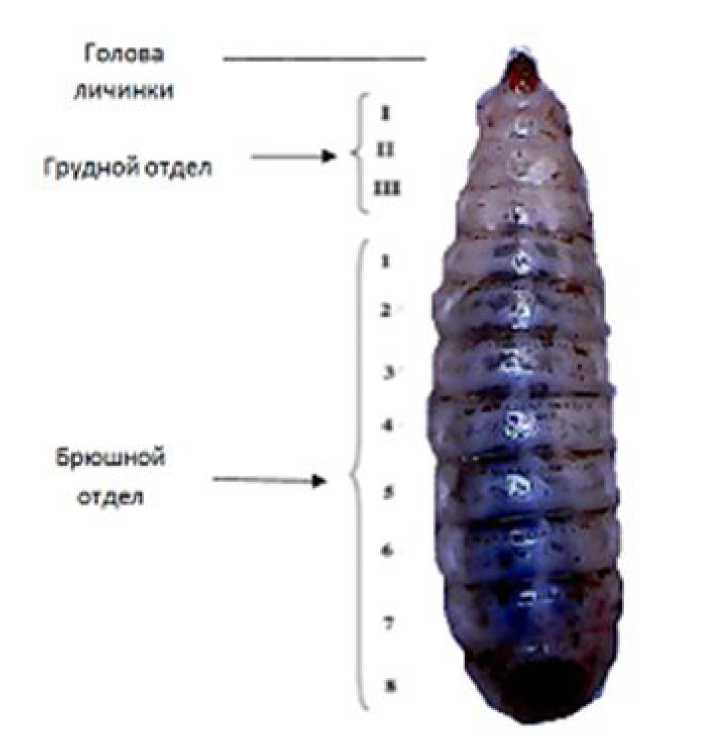
Головная капсула, в отличие от тела, узкая и маленькая и может быть втянута в грудной отдел. Грудь состоит из трех сегментов (рис. 1). Спинные сегменты густоволосистые с несколькими рядами мелких волосков, которые хорошо развиты в передних сегментах II и III. Брюшной отдел состоит из 8 сегментов, образованных пластинками грубо прямоугольной формы, которые покрыты многочисленными мелкими щетинками. Сегменты с 1 до 7 характеризуются наличием дыхальца с обеих сторон. Восьмой брюшной сегмент – последний, округлой формы (Fernanda, Klaus, Richard, 2015).
Подробное описание стадий развития мухи приведены в табл. 1. Согласно исследованиям (Fernanda, Klaus, Richard, 2015), первая стадия личинки длится около 15 дней. По цвету личинки бело-желтые, могут до-
Голова
Личинки
Грудной отдел
BpfOLJNOH отдел
Рис. 1. Анатомическое строение личинки мухи Чёрная львинка (Fernanda, Klaus, Richard, 2015)
Fig. 1. The anatomical structure of the larva Black flies lvink (Fernanda, Klaus, Richard, 2015)
стигать размера до 5.0 мм ± 0.5 мм. Во второй стадии продолжительностью 1 дней они увеличиваются в размерах до 12 мм. Третья возрастная стадия (предкуколки) продолжительностью 8 дней достигает размера 19 мм. За данный период личинки изменяют свой цвет до темно-коричневого и по структуре становятся более жесткими. Процесс окукливания длится около 10 дней, после завершения которого взрослая муха выходит из куколки с единственной целью спаривания и откладки яиц.
Взрослые особи Hermetia illucens, в длину от 15 до 20 мм, имеют слабовыраженный, лижущий ротовой аппарат, предназначенный только для питья, следовательно, насекомое не кусается и не жалит. По цвету мухи черные с дымчато- черными крыльями, очень плотными по структуре и все покрыты мембранами (рис. 2) (Paola et al., 2013). Голова взрослых мух короткая и широкая, глаза широко разведены, независимо от пола насекомого. Усики в два раза длиннее головы (соотношение представлено на рис. 3), представляют собой удлиненные жгутики и имеют длинный концевой сегмент (Sheppard et al., 2002).
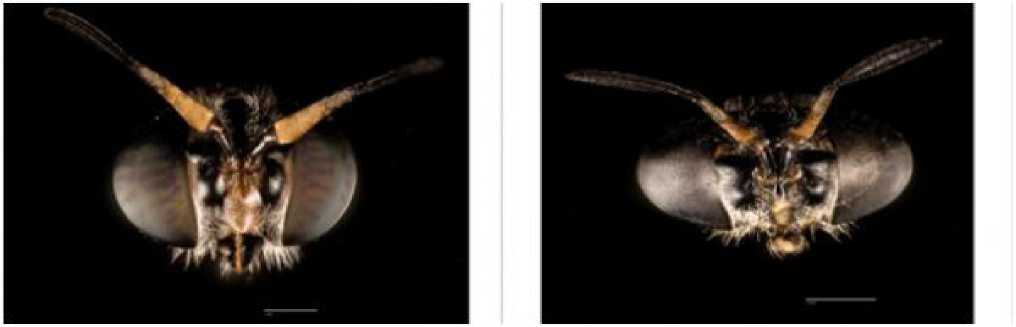
Для Hermetia illucens характерно наличие черт полового диморфизма: размер тела и наличие волосков на лбу и голове (Rozkošný, 1983). Явных половых отличий у вида не наблюдается, хотя самки, как правило, по размеру больше самцов. Однако необходимо отметить, что размер мух зависит от количества пищи, употребленной личинкой, таким образом, самцы и самки могут быть схожи по биометрическим показателям. Они отличаются большим числом белесых волосков на голове, в основном сосредоточенных в нижней части «лица» (рис. 4a-b). Самцы отличаются более разреженными волосками и их меньшим количеством.
Естественное распространение вида Hermetia illucens характерно для субтропических широт ( от 40° с. ш. до 40° ю. ш.) (McCallan, 1974), но в Западной Европе, где климат более мягкий, муха распространяется до 49055 с. ш. (Rohacek, Hora, 2013). Это страны c преобладающим теплым климатом, где вид разводят в вольерах, расположенных
Таблица 1. Стадии развития мухи Черная львинка (Hermetia illucens)
|
Размер Стадия (мм) |
Цвет Изображение |
|
Яйцо 0.8–1 |
Белый/желтый |

|
Личинка 5–12 |
Белый/ желтый/ светлокоричневый |

|
Предкуколка 19 |
Темнокоричневый |

|
Куколка 19 |
Темнокоричневый |

|
Взрослая муха 15–20 |
Черный, частично с белыми голенями и ступнями |

Рис. 2. Крыло Hermetia illucens (Paola et al., 2013)
Fig. 2. Wing of Hermetia illucens (Paola et al., 2013)
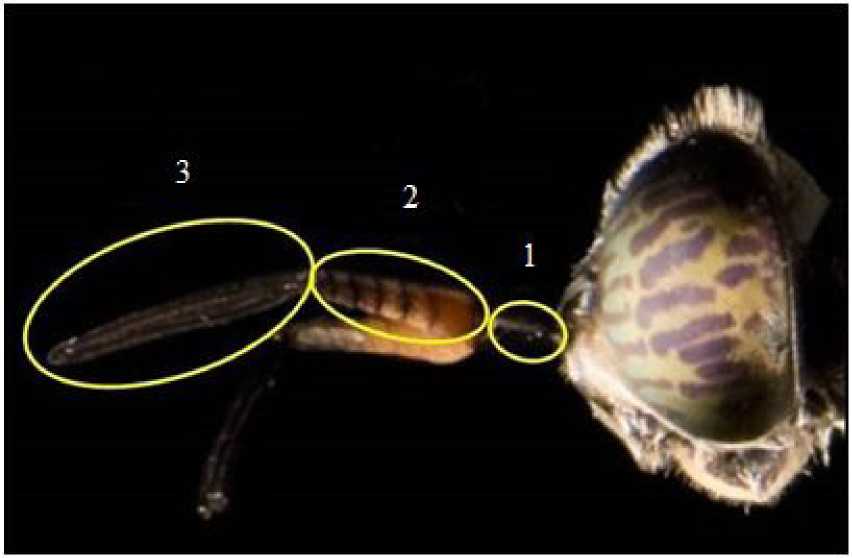
Рис. 3. Строение усиков Hermetia illucens (Jonathan Tan). Круги представляют собой пронумерованные части усиков (1 – скейп, 2 – базальная часть флагеллума, 3 – апикальная часть флагеллума)
Fig. 3. The structure of the antennae of Hermetia illucens (Jonathan Tan). Circles are the numbered parts of the antennae (1 – skeyp, 2 – basal part of the flagellum, 3 – apical part of the flagellum)
на открытом воздухе. Однако в последнее время активно обсуждаются перспективы разведения мухи и как следствие ее использование в регионах с холодным климатом. Это возможно при создании оптимальных искусственных условий, где вид может нормально функционировать, развиваться и размножаться.
При разведении мухи Черная львинка основные факторы, влияющие на рост, развитие и получение кормовой биомассы, – освещение, влажность, температурный режим, кормовой субстрат, химические факторы, к которым относятся газовый состав воздуха, минеральный состав воды, кислот- ность, механический и химический состав среды, в которой развивается насекомое, ее воздухопроницаемость и плотность, а также шум, гамма-излучение и электромагнитные колебания (Чернышев, 1996). Несмотря на весь спектр необходимых факторов среды распространения, насекомое отличается неприхотливостью, а ее личинки – всеядностью и способностью развиваться в широких диапазонах температур (20–50 °С) и влажности (40–90 %). Основные параметры, необходимые для разведения насекомого, – для имаго влажность воздуха до 70 %, температура воздуха – около 30 °С, наличие питьевой воды и освещения. Согласно исследовани-
а) Самка мухи Чёрная львинка б) Самец мухи Чёрная львинка
Рис. 4a–b – особенности полового диморфизма взрослых мух Hermetia illucens на голове (Jonathan Tan)
-
a) Female fly Black lvink
-
b) Male fly Black lvink
Fig. 4a–b – Features of sexual dimorphism of adult flies Hermetia illucens on the head (Jonathan Tan)
ям, минимальная освещенность, необходимая для спаривания взрослых особей мухи, составляет 70 мкмоль/м2/с, максимальная – 100 мкмоль/м2/с (Alvarez, 2012). Для кладки яиц оптимальное значение температуры должно поддерживаться на уровне 27 °С с относительной влажностью окружающей среды 60 %. При таких условиях наблюдается выводимость яиц 80 % и более (Holmes, 2010; Sheppard et al., 2002).
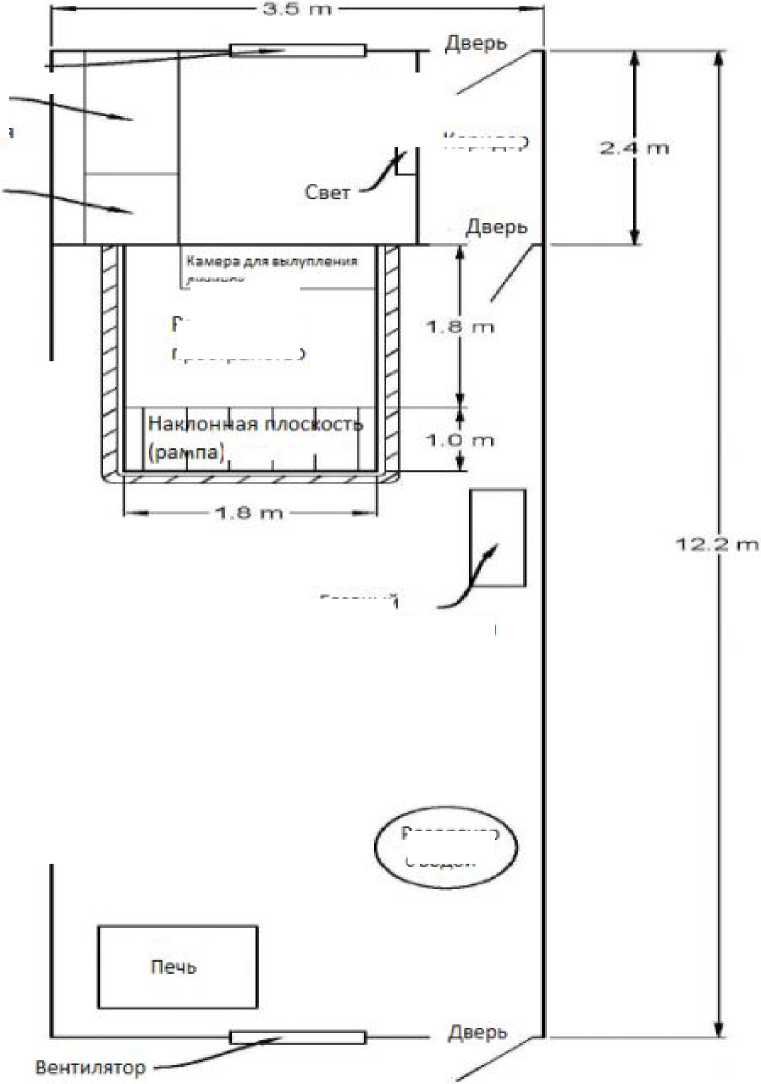
При соблюдении всех необходимых условий окружающей или искусственно созданной среды муха может разводиться в любых географических зонах Земли. Первые исследования по разведению личинок вида в условиях холодного климата проводили в теплице здания биологии при Университете Виндзора, Канада, США. Клетки, где проводили исследования, разместили в теплице, с температурой и относительной влажностью воздуха в пределах 27 °C и 33 °C (оптимальная) и 25 % до 50 % (не является оптимальной, но допустима). Для организации исследования объект был разделен на операционные зоны (рис. 5).
Реакторное пространство представляет собой территорию, на которой недавно вылупившаяся личинка может развиваться с момента вылупления до своей мигрирующей стадии. Пространство имеет форму прямоугольной призмы, изготовленной из ¾ дюйма фанеры, объем территории 1.0 м3 (1.82 м Д. x 1.82 м Ш. х 0.305 м В.). Реакторное пространство соединено наклонной поверхностью (пандус/рампа) с инкубатором (место для взрослых особей мух). Пандус построен также из фанеры под углом
40 градусов, и покрыт мембраной BlueSkin для обеспечения водонепроницаемости. Он обеспечивает выход мигрирующим личинкам к собирающемуся желобу (к камере для окукливания) (Alvarez, 2012).
Реакторное пространство представляет собой территорию, на которой недавно вылупившаяся личинка может развиваться с момента вылупления до своей мигрирующей стадии. Пространство имеет форму прямоугольной призмы, изготовленной из % дюйма фанеры, объем территории 1.0 м3 (1.82 м Д. x 1.82 м Ш. х 0.305 м В.). Реакторное пространство соединено наклонной поверхностью (пандус/рампа) с инкубатором (место для взрослых особей мух). Пандус построен также из фанеры под углом 40 градусов, и покрыт мембраной BlueSkin для обеспечения водонепроницаемости. Он обеспечивает выход мигрирующим личинкам к собирающемуся желобу (к камере для окукливания) (Alvarez, 2012).
Собирающийся желоб прямоугольной формы (1.82 м Ш. х 0.914 м Д. х 0.457 м В.), изготовлен из фанеры и заполнен щепой (глубина – 0.15 м). В этом месте личинок вместе со щепой собирали, щепу просеивали, самих личинок взвешивали и перемещали в пространство для взрослых насекомых. Пространство для взрослых особей объемом около 14.5 м3 (2.5 м Ш. х 2.35 м Д. х 2.46 м В.) состоит из четырех стенок, покрытых 0.15 мм пластика с обеих сторон. Для предотвращения кладки яиц в нежелательных местах камеры и сокращения количества бесконтрольной миграции личинок все швы и стыки камеры были покрыты акрилом (Alvarez, 2012).
Водохранилище
Измельчитель
Камера для окукливания
Выпускное вентиляционное отверстие -
Коридор
Рис. 5. Схема объекта по производству мухи Черная львинка (при Университете Виндзора, Канада, США)
Пространство для всрослых особей
ЛгчикОх
Реакторное пространство

главный распылитель воды
Резервуар с водой
Fig. 5. Scheme of the construction for the production of flies Black lvink (at the University of Windsor, Canada, USA)
С инженерной точки зрения с поведением мух на взрослой стадии жизни сложнее справиться, чем с мухами на стадии личинки. Взрослые особи отличаются повышенной потребностью в питьевой воде, объемным пространством для поиска самки, воздействием света и наличием подходящего места для кладки яиц. Для удовлетворения потребности в воде установлена система распыления, которая распыляет воду по территории пространства и обеспечивает определенный уровень влажности окружающей среды. Для обеспечения потребности в свете, стены и потолок камеры сделаны из полупрозрачного пластика, а для обеспечения оптимального пространства для поиска самки при спаривании (воздушный поиск) большинство территории камеры было пустым.
Инкубатор для разведения взрослых особей мухи построен из дерева в виде треугольной призмы (0.305 м Д. х 1.6 м Ш. х 0.267 м В.). Одна, самая длинная, сторона строения покрыта листом фанеры, а остальные поверхности – просматриваемыми окнами для обеспечения оптимального светового режима (Alvarez, 2012).
В качестве мест для кладки яиц использовали новые пластиковые яичные картриджи. Картриджи сделаны из сравнительно твердого пластикового картона, который разрезали на части размером 0.305 м х 0.003 м х 0.0254 м. Каждый картридж имел два отверстия (5 мм х 3 мм), через которые были вставлены два стальных резьбовых стержня, соединяющие картриджи вместе. После сборки блоков для укладки яиц их устанавливали в инкубатор (Alvarez, 2012).
В отличие от Америки и стран Западной Европы (Голландия, Германия, Италия и др.), где изучением адаптации и разведением мухи Черная львинка в холодном климате занимаются уже несколько десятков лет, в России и странах Восточной Европы данный вопрос мало изучен.
В северных широтах России исследования по разведению и изучению адаптации чёрной львинки проводятся на территории Архангельской области с 2015 г. на базе малого инновационного предприятия ООО «Норд-ТехСад». Исследования направлены на производство биомассы личинок и предкуколок мухи для введения в корма сельскохозяйственным животным и рыбам в качестве белково-энергетического компонента корма, и в том числе для замены рыбной муки. Технологический процесс производства выглядит следующим образом: температура в помещении, где проводятся работы по разведению мух, в течение всего года поддерживается на уровне 26–29 °С. Для содержания имаго используются клетки объемом 0.5 м3. В каждой клетке находится 3000–3500 особей мух. Длина светового дня составляет 12 часов благодаря светильникам с лампами. В клетке располагается кормушка для имаго, которая представляла собой вискозную губку, пропитанную водой. Питание для мух этого вида не является строго необходимым, однако при его наличии продолжительность жизни насекомого существенно увеличивает.
Для откладки яиц черной львинки использовали соты и картон, установленные на дно клетки, которые располагаются над емкостью с едой. Когда цикл запущен, на дно клетки размещается емкость с куколками мух. Вылупившиеся самцы и самки мухи спариваются в полете, начиная с третьего дня жизни. Первые кладки яиц появляются на третий день с момента выхода первых особей. Самки откладывают яйца в отверстия сот и картона, содержащие от 250 до 1200 штук яиц в ячейке. Продолжительность жизни имаго составляет от 10 до 28 суток.
Яйца вида инкубируются в чашках Петри в сухом картоне при температуре 26 °С и влажности воздуха 80 %. Продолжительность развития яиц мухи черной львинки при указанной температуре составляет трое суток. Яйца третьего дня инкубации помещали в пластиковые контейнеры с питательным субстратом и накрывали мелкоячеистой сеткой. На пятый день субстрат с личинками помещали в контейнеры, где личинки перерабатывали практически любые органические отходы – овощи, мясо, фрукты, остатки пищи из мест общественного питания, причем как свежие, так и испорченные.
Развитие личинок до стадии предкуколки продолжается 2–3 недели в зависимости от режима питания и температуры. Личинки, завершившие питание, линяют и приобретают темную, почти черную окраску. На этой стадии развития они ищут подходящее место для окукливания. Если субстрат недостаточно влажный, окукливание может произойти в толще субстрата. Если же в субстрат добавить воды, предкуколки вылезают на поверхность в поисках более сухого места для окукливания. Эта биологическая особенность вида может быть использована для отделения их от субстрата.
В процессе выращивания личинок и, как следствие, предкуколок важно следить за хорошей аэрацией, температурой в контейнерах и влажностью субстрата. Предкуколки могут сохранять жизнеспособность до нескольких месяцев при температуре 10–15 °С, а при температуре 26 °С окукливание проходит в течение 6–12 суток. Если плотность личинок возрастает (15–50 шт./см2), температура субстрата также повышается (до 43 °С). Однако это не приводит к гибели личинок, а, напротив, подавляет значительное число патогенов в субстрате.
Всеядность и питательность обуславлива- ется способностью личинок чёрной львинки поедать без исключения любые твердые органические отходы и в результате накапливать в своем организме комплекс макро- и микроэлементов, процентное содержание которых зависит от диеты питания. В табл. 2 представлен состав и процентное содержание веществ личинок мухи Черная львинка выращенных на помете свиней. Исследования проведены в лабораторных условиях на базе Университета Виндзора, Канада, США.
Таблица 2. Cостав личинок Hermetia illucens , выращенных на помете свиней (Newton et al., 1977)
|
Изучаемые показатели |
Процентное содержание веществ, % |
|
Белки |
42.1 |
|
Жиры |
34.8 |
|
Волокно (хитин) |
7.0 |
|
Влажность |
7.9 |
|
БЭВ (безазотистые экстрактивные вещества) |
1.4 |
|
Зола |
14.6 |
|
Кальций |
5.0 |
|
Фосфор |
1.5 |
При проведении исследований установлено, что на содержание протеина в личинке не оказывает влияние состав кормового субстрата, в то время как количество жира и золы колеблется в зависимости от типа корма – для жира 20–45 %, для золы 3–20 % (Spranghers et al., 2015). Основной компонент липидов этого насекомого – лауриновая кислота и ее эфиры. Среди идентифицированных глицеридов лауриновой кислоты доминирует моноглицерид, который обладает значительной биологической активностью. Считается, что в организме животных и человека лауриновая кислота, которая содержится в грудном молоке, преобразуется в монолаурин, который является противовирусным, антибактериальным и антипрото-зойным глицеридом (Elwert et al., 2010; Гончаров, Хамидуллин, 2012). Кислота угнетает и подавляет многие вирусы, включая вирус ВИЧ, вирус кори, клостридий и многих патогенных простейших микроорганизмов.
Аминокислотный состав белка в личинке демонстрирует присутствие широкого спектра аминокислот и относительно высокое содержание лизина. В табл. 3 приведены результаты исследования аминокислотного состава, содержащегося в сухой муке личинок мухи.
Незаменимыми аминокислотами богаты корма животного происхождения, поэтому они считаются более полноценными. Из приведенных в табл. 3 данных обращает на себя внимание, что в относительно большом количестве присутствуют незаменимые L-аминокислоты с разветвленной цепью (лейцин, валин и изолейцин), составляя в сумме более 20 % от всех аминокислот. Лейцин и изолейцин необходимы для синтеза белков плазмы крови, тканей, нормального использования аминокислот корма и стимулируют выделение гормона роста. Изолейцин необходим для синтеза гемоглобина, а также регулирует уровень сахара в крови и процессы энергообеспечения. Валин оказывает стимулирующее действие и необходим для метаболизма в мышцах, восстановления поврежденной ткани. Он участвует в синтезе белков и гликогенов. Недостаток валина приводит к потере аппетита, снижению прироста живой массы у молодняка, вызывает глубокие дегенеративные изменения центральной нервной системы, выражающиеся в нарушении координации движений, повышенной возбудимости к внешним раздражителям (Горчакова и др., 2010; Baker et al., 2002).
Таблица 3. Аминокислотный состав сухой муки личинок Hermetia illucens , выращенных на помете свиней (Newton et al., 1977).
|
Аминокислоты |
Процентное содержание, % |
|
Аспарагиновая кислота |
4.56 |
|
Треонин |
0.55 |
|
Серин |
0.12 |
|
Глутаминовая кислота |
3.81 |
|
Пролин |
3.26 |
|
Глицин |
2.88 |
|
Аланин |
3.69 |
|
Цистин |
0.06 |
|
Валин |
3.41 |
|
Метионин |
0.86 |
|
Изолейцин |
1.96 |
|
Лейцин |
3.53 |
|
Тирозин |
2.51 |
|
Фенилаланин |
2.2 |
|
Гистидин |
1.91 |
|
Лизин |
3.37 |
|
Аргинин |
2.24 |
|
Триптофан |
0.2 |
|
Сумма аминокислот |
40.12 |
Проведенные исследования указывают на биологическую активность аминокислот белков мухи Черная львинка и подтверждают необходимость использования личинок в качестве кормовой добавки крупному рогатому скоту и птице. При кормлении животных и птиц кормами с добавлением муки из высушенных личинок иммунная система становится более устойчивой к внешним раздражителям, стимулируется выделение гормона роста, что приводит к приросту организма по массе, а также указанные аминокислоты обеспечивают поддержание нормального обмена азота в организме животных, что приводит к нормализации обмена веществ и повышению иммунитета.
Заключение
Муха Черная львинка – насекомое, вызывающее большой научный и практический интерес. Личинки мухи полезны не только как корм для домашних животных, но и как корм для рыбных ферм и сельскохозяйственных представителей. Личинки способны эффективно перерабатывать органические отходы, в том числе экскременты свиней и птиц, накапливая в своем организме комплекс веществ, процентное содержание которых зависит от диеты питания.
Насекомое не требовательно к внешним факторам, и при минимальных вложениях и небольших усилиях можно добиться значительных успехов в разведении данного вида в районах Крайнего Севера. В Архангельской области в лабораторных условиях уже проводятся работы по созданию опытных партий личинок, усовершенствованию технологий разведения мухи в условиях циркумполярного региона на базе малого инновационного предприятия ООО «НордТехСад» и проведению испытаний на животных при добавлении личинок в качестве кормовой добавки. Заявленные направления исследований обеспечат развитие сельскохозяйственной и пищевой промышленности региона. За счет способности к биоконверсии личинки определят экологическую направленность по улучшению состояния окружающей среды региона и позволят развить ряд направлений в биотехнологии на севере России. Согласно вышеизложенному черная львинка является перспективным объектом исследований, поскольку широко зарекомендовала себя в логически безопасной биоутилизации ор-качестве кормовой добавки сельскохозяй- ганических отходов, что важно для условий ственным животным и аквакультуре, а также палеарктики и циркумполярного региона. вид связан с актуальным направлением эко
Список литературы Кардиоактивность раков Cherax quadricarinatus (Von Martens 1868) в различных физиологических состояниях
- Баевский Р. М., Берсенева А. П. Оценка адаптационных возможностей организма и риска развития заболеваний . М.: Медицина, 1997. 235 с.
- Иванов А. В., Холодкевич С. В., Куракин A. С. Самодиагностика биоэлектронных систем мониторинга окружающей среды в реальном времени //Системы контроля окружающей среды. 2012. № 17. С. 26-;31.
- Кузнецова Т. В., Сладкова С. В., Холодкевич С. В. Оценка функционального состояния раков в нормальной и токсической среде по их кардиоактивности и биохимическим показателям гемолимфы //Журн. эвол. биохим. и физиол. 2010. Т. 46. № 3. С. 203-;210.
- Мельник Е. А., Рублевская О. Н., Панкова Г. А., Холодкевич С. В., Иванов А. В., Корниенко Е. Л., Сладкова С. В., Любимцев В. А., Куракин А. С. Биоэлектронная система контроля токсикологической безопасности биологически очищенных сточных вод //Водоснабжение и санитарная техника. 2013. № 1. C. 7-;12.
- Сладкова C. В., Сафронова Д. В., Холодкевич С. В. Изучение влияния изменений режимов освещенности, температуры и процесса кормления на кардиоактивность раков-биоиндикаторов в биоэлектронных системах мониторинга качества поверхностных вод //Вестник Санкт-Петербургского университета. Серия 3. Биология. 2016. № 1. С. 137-;149.
- Сладкова С. В., Холодкевич С. В. Общий белок в гемолимфе раков Pontastacus leptodactylus как показатель функционального состояния животных и биомаркер качества среды обитания //Журн. эвол. биохим. и физиол. 2011. Т. 47. № 2. С. 136-;141.
- Удалова Г. П., Холодкевич С. В., Сладкова С. В., Иванов А. В., Рымша В. А. Исследование циркадианной активности раков Pontastacus leptodactylus при их многомесячном содержании в протоке речной воды //Журн. эволюц. биохим. и физиол. 2009. T. 45. № 3. С. 304-;312.
- Федотов В. П., Холодкевич С. В., Строчило А. Г. Особенности активности сердца рака Astacus astacus в различных функциональных состояниях //Журн. эволюц. биохим. и физиол. 2002. Т. 38. № 1. С. 36-;44.
- Холодкевич С. В. Волоконно-оптические дистанционные биосенсорные системы непрерывного биологического мониторинга качества поверхностных вод и донных отложений в реальном времени //Нефть и газ арктического шельфа -; 2006: Материалы международной конференции, Мурманск, 15-;17 ноября. Мурманск: ММБИ КНЦ РАН, 2006. С. 287-;296.
- Холодкевич С. В. Биоэлектронный мониторинг уровня токсичности природных и сточных вод в реальном времени //Экологическая химия. 2007. Т. 16. № 4. С. 223-;232.
- Цукерсис Я. М. Биология широкопалого рака . Вильнюс: Милятис, 1970. 204 с.
- Черкашина Н. Я. Динамика популяций раков родов Pontastacus и Caspiastacus (Crustacea, Decapoda, Astacidae) и пути их увеличения . М.: Нацрыбресурс, 2002. 256 с.
- Ahearn G. A., Mandal P. K., Mandal A. Calcium regulation in crustaceans during the molt cycle: a review and update//Comp. Biochem. Physiol. A. Mol. Integr. Physiol. 2004. Vol. 137. P. 247-;257.
- Aiken D. E., Waddy S. L. Winter temperature and spring photoperiod requirements for spawning in the American lobster (Homarus americanus)//J. Shellfish Res. 1990. Vol. 9. P. 41-;43.
- Aiken D. E., Waddy S. L. The growth-process in crayfish//Rev. Aquat. Sci. 1992. Vol. 6. P. 335-;381.
- Armitage K. B., Buikema A. L., Willems N. J. The effect of photoperiod on organic constituents and molting of the crayfish Orconectes nais (Faxon)//Comp. Biochem. Physiol. 1973. Vol. 44(A). P. 431-;456.
- Bamber S. D., Depledge M. H. Responses of shore crabs to physiological challenges following exposure to selected environmental contaminants//Aquatic Toxicology. 1997. Vol. 40. P. 79-;92.
- Barki A., Levi T., Hulata G., Karplus I. Annual cycle of spawning and molting in the red-claw crayfish, Cherax quadricarinatus, under laboratory conditions//Aquaculture. 1997. Vol. 157. P. 239-;249.
- Bojsen B. Н., Witthofft H., Styrishave B. In situ studies on heart rate and locomotor activity in the noble freshwater crayfish, Astacus astacus (L.) in relation tо natural fluctuation in temperature and light intensity//Freshwater Biology. 1998. Vol. 39. P. 455-;465.
- Carreñ;o-Leó;n D., Racotta-Dimitrov I., Casillas-Herná;ndez R., Monge-Quevedo A., Ocampo-Victoria L., Naranjo-Pá;ramo J., Villarreal H. Growth, metabolic and physiological response of juvenile Cherax quadricarinatus fed different available nutritional substrates//J. Aquac. Res. Development. 2014. Vol. 5. № 2 DOI: 10.4172/2155-9546.1000220
- Depledge M. H. Disruption of circulatory and respiratory action in shore crabs Carcinus maenas (L.) exposed to heavy metal pollution//Comp. Biochem. Physiol. 1984. Vol. 78. P. 445-;459.
- Drach P. Mue et cycle d'intermue chez les Crustacé;s dé;capodes. Ann. Inst. Océ;anogr. Paris (Monaco), 1939. 19. pp. 103-;391.
- Dubé P., Portelance B. Temperature and photoperiod effects on ovarian maturation and egg laying of the crayfish Orconectes limosus//Aquaculture. 1992. Vol. 102. P. 161-;168.
- Fingerman M., Lago A. D. Endogenous twenty four hour rhythms of locomotor activity and oxygen consumption in the crayfi sh Orconectes clypeatus//The American Midland Naturalist. 1957. Vol. 58. P. 383-;393.
- Ghanawi J., Saoud I. P. Molting, reproductive biology, and hatchery management of red claw crayfish Cherax quadricarinatus (von Martens 1868)//Aquaculture. 2012. Vol. 358-;359. P. 183-;195.
- Kholodkevich S. V., Ivanov A. V., Kurakin A. S., Kornienko E. L., Fedotov V. P. Real time biomonitoring of surface water toxicity level at water supply stations//J. Environmental Bioindicators. 2008. Vol. 3. № 1. P. 23-;34.
- Kozák P., Kuklina I. Crayfish as tools of water quality monitoring//Freshwater Crayfish: A Global Overview/CRS Press, eds. T. Kawai, Z. Faulkes, G. Scholtz. Boca Raton, 2016. P. 275-;298.
- Nakayama S. M., Ikenaka Y., Muzandu K,. Choongo K., Oroszlany B., Teraoka H., Mizuno N., Ishizuka M. Heavy metal accumulation in lake sediments, fish (Oreochromis niloticus and Serranochromis thumbergi), and crayfish (Cherax quadricarinatus) in Lake Itezhi-tezhi and Lake Kariba, Zambia//Arch. Environ. Contam. Toxicol. 2010. Vol. 59. № 2. P. 291-;300.
- Passano L. M. Molting and its control//Physiology of Crustacea. 1960. Vol. 1. P. 473-;536.
- Pollard T. G., Larimer J. L. Circadian rhythmicity of heart rate in the crayfish, Procambarus clarcii//Comp. Biochem. Physiol. 1977. Vol. 57(A). P. 221-;226.
- Reynolds J., Souty-Grosset C. Management of Freshwater Biodiversity. Cambridge: University press, 2012. 374 p.
- Rice P. R., Armitage K. B. The effect of photoperiods on oxygen consumption of the crayfish Orconectes nais (Faxon)//Comp. Biochem. Physiol. 1974. Vol. 47(A). P. 261-;270.
- Shechter A., Berman A., Singer A., Freiman A., Grinstein M., Erez J., Aflalo E. D., Sagi A. Reciprocal Changes in Calcification of the Gastrolith and Cuticle During the Molt Cycle of the Red Claw Crayfish Cherax quadricarinatus//Biol. Bull. 2008. Vol. 214. P. 122-;134.
- Styrishave B., Rasmussen A. D., Depledge M. H. The influence of bulk and trace metals on the circzdian rhythm of heart rates in freshwater crayfish Astacus astacus//Marine Pollution Bulleten. 1995. Vol. 31. № 1-;3. P. 87-;92.
- Styrishave B., Bojsen B. Н., Witthofft H., Andersen O. Diurnal variations in physiology and behaviour of the noble crayfish Astacus astacus and the signal crayfish Pacifastacus leniusculus//Marine and Freshwater Behaviour and Physiology. 2007. Vol. 40. № 1. P. 63-;77.
- Westin L., Gydemo R. Influence of light and temperature on reproduction and moulting frequency of the crayfish, Astacus astacus L.//Aquaculture. 1986. Vol. 52. P. 43-;50.



