Кардиомиопатия Такоцубо при местнораспространенном раке ректосигмоидного соединения: междисциплинарное преодоление осложнений
Автор: Алексеев И.Э., Лысоволенко Н.Л., Гаврилюк Е.В., Хвостовой В.В., Лазарева Н.В., Быканова А.М., Гребенкин Е.Н., Станоевич И.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 5 т.22, 2023 года.
Бесплатный доступ
Актуальность. В сравнении с общей популяцией у пациентов, страдающих злокачественными новообразованиями, кардиомиопатия такоцубо встречается чаще, чему способствуют не только наличие новообразования как такового, но и неразрывно связанные с опухолевым процессом моменты, такие как психоэмоциональные переживания, инвазивные диагностические и лечебные мероприятия. Цель исследования - представление клинического наблюдения кардиомиопатии такоцубо в послеоперационном периоде у больной с местнораспространенным раком ректосигмоидного соединения и роли междисциплинарного подхода к своевременной диагностике и лечению спектра осложнений опухолевого процесса. Описание клинического наблюдения. Больная К., 54 лет, с диагнозом: Рак ректосигмоидного соединения стадии IIIC сT4bcN2M0, осложненный острой обтурационной кишечной непроходимостью. В раннем послеоперационном периоде зафиксированы внезапное снижение артериального давления, инверсия зубца Т и удлинение корригированного интервала QT на электрокардиограмме (ЭКГ), снижение сократительной способности левого желудочка и наличие зон нарушения локальной сократимости миокарда по данным эхокардиографии (ЭхоКГ), а также повышение биомаркеров повреждения миокарда, что изначально было расценено как острый коронарный синдром, который впоследствии исключен по результатам коронароангиографии, не выявившей обструктивного поражения коронарных артерий. В дальнейшем, учитывая быструю и полную обратную динамику изменений, исключены острый инфаркт миокарда без обструктивного поражения коронарных артерий и острый миокардит, что ретроспективно позволило установить диагноз кардиомиопатии такоцубо.
Кардиомиопатия такоцубо, колоректальный рак, коронарография, острая сердечно-сосудистая недостаточность, кардиоонкология
Короткий адрес: https://sciup.org/140303538
IDR: 140303538 | УДК: 616.349-006.6:616.127-008.46-06 | DOI: 10.21294/1814-4861-2023-22-5-161-172
Текст научной статьи Кардиомиопатия Такоцубо при местнораспространенном раке ректосигмоидного соединения: междисциплинарное преодоление осложнений
Кардиомиопатия такоцубо (КТ) – острая и, чаще всего, обратимая форма сердечной недостаточности, обусловленная воздействием различных стрессовых факторов, которые приводят к систолической дисфункции преимущественно апикальных отделов левого желудочка и протекают под маской острого инфаркта миокарда [1]. В настоящее время истинная распространенность КТ неизвестна. По разным данным, диагноз устанавливается у 1–3 % пациентов, перенесших коронароангиографию при подозрении на острый коронарный синдром [2]. В США стрессовая КТ является причиной госпитализации в 0,02 % случаев и выявляется у 5–6 % женщин с подозрением на острый коронарный синдром с подъемом сегмента ST [3]. Этиология заболевания не установлена, тем не менее существует несколько гипотез, объясняющих механизмы его формирования [4]. Ряд авторов считает генерализованный спазм микрососудов ключевым звеном патогенеза [5, 6]. Другие исследования демонстрируют локальный эффект катехоламинов из-за чрезмерного ответа симпатической нервной системы на триггер, который приводит к острой эндотелиальной дисфункции, обусловливающей проявления стрессовой кардиомиопатии [7]. В 2018 г. Европейским сообществом кардиологов представлены новые международные критерии заболевания – International Takotsubo Diagnostic Criteria (InterTAK) [1, 8] (табл. 1).
Каждому из критериев присвоено определенное количество баллов (например, женский пол – 25 баллов, удлинение QT – 6 баллов и т.д.). У пациентов с итоговым количеством 30 баллов вероятность развития КТ менее 1 %, 50 баллов соответствуют 18 % развития КТ, пациенты, набравшие 70 и более баллов, перенесли КТ с вероятностью 90 %. Данные критерии призваны проводить стратификацию рисков у пациентов с подозрением на КТ и позволяют помочь с выбором дальнейшей тактики ведения больного.
Провоцирующие факторы принято разделять на эмоциональные и физические. К физическим триггерам относятся значительное физическое перенапряжение (например, у спортсменов), прием медикаментов, обострение хронических соматических заболеваний (например, бронхиальной астмы [9]) или острой соматической патологии (в частности, тромбоэмболии легочной артерии) [1, 10]), оперативное лечение и т.д. [11].
Особое внимание исследователей обращено на КТ, развивающуюся у пациентов со злокачественными опухолями, у которых по сравнению с общей популяцией КТ встречается чаще [12], чему может способствовать наличие новообразования
Таблица 1/Table 1
Шкала стратификации риска КТ InterTAK [1, 8]
International Takotsubo diagnostic Criteria (InterTAK) [1, 8]
Критерии/Indicator
Количество баллов/Number of points
Женский пол/Females25
Эмоциональный стресс/Emotional stress24
Физический стресс/Physical stress13
Отсутствие депрессии ST на ЭКГ (кроме отведения AVR)/
Absence of ST depression on the ECG (except for the AVR lead)
Психические нарушения/Mental disorders11
Неврологические нарушения/Neurological disorders9
Удлинение интервала QT на ЭКГ/Prolongation of the QT interval on the ECG6
Примечание: ЭКГ – электрокардиография; таблица составлена авторами.
Note: ECG – electrocardiography; created by the authors.
как такового (сопровождающегося, например, паранеопластическим или хроническим болевым синдромом), а также связанные с ним моменты, такие как психоэмоциональное переживание, диагностические и лечебные мероприятия, в том числе перикардиоцентез [13]). Помимо оперативного лечения, триггером КТ может являться таргетная и химиотерапия, что продемонстрировали A. Desai et al. [12]: среди включенных в обзор клинических наблюдений в подавляющем большинстве КТ возникала уже после первого или второго курса лечения, наиболее частыми препаратами, способствующими развитию кардиомиопатии, являлись препараты платины (цисплатин, оксалиплатин), фторпиримидины (5-фторурацил, капецитабин), а также таргетная терапия бевацизумабом. Потенциальная кардиотоксичность указанных препаратов известна, препараты платины и фторпиримидины способны вызывать спазм сосудов, в том числе коронарных, с развитием стенокардии или инфаркта миокарда, тромбозы и др. При терапии бевацизумабом встречаются следующие побочные реакции со стороны сердечно-сосудистой системы: неконтролируемая тяжелая артериальная гипертензия, зачастую требующая смены режима терапии, венозная и артериальная тромбоэмболия, инфаркт миокарда и/или острое нарушение мозгового кровообращения [14]. Триггерами выступают лекарственные средства, способные прямо нарушить метаболизм и электро-физиологические свойства миокарда, а также обладающие способностью быстро и обратимо влиять на механизмы регуляции сосудистого тонуса коронарных и, по-видимому, других артерий и изменять реологические свойства крови в сторону гиперкоагуляции. Не исключено, что КТ является кардиологическим проявлением специфической острой эндотелиальной дисфункции с параллельной стимуляцией гладкомышечных элементов артериального русла и активацией внутреннего механизма свертывания крови гуморальными факторами эндотелиального происхождения или, наоборот, прекращением их выделения.
Лучевая терапия также способна привести к возникновению КТ. Согласно данным, полученным при анализе национального регистра The National (Nationwide) Inpatient Sample (NIS), число случаев КТ у пациентов, перенесших лучевую терапию по поводу злокачественных новообразований органов грудной клетки, средостения, молочных желез, увеличилось с 2007 по 2014 г. и составило 0,13 %, или 128 случаев на 100 000 человек [12]. Важно учитывать широкий спектр потенциальных триггеров КТ, поскольку действие эмоциональных триггеров может наблюдаться в течение всего периода наблюдения, начиная с момента выявления злокачественного новообразования, а также воздействие нескольких физических триггеров, поскольку онкологические пациенты зачастую получают комплексное лечение. Тем не менее в настоящий момент нет убедительной доказательной базы в отношении противопоказаний к проведению того или иного метода лечения после перенесенной КТ [1].
Среди клинических проявлений КТ доминируют симптомы острой левожелудочковой недостаточности, а также признаки, напоминающие острый коронарный синдром: боль в груди и одышка, реже – учащение сердцебиения, обморок, тошнота/рвота, иногда сопровождающиеся неврологическими и психическими нарушениями, а у некоторых больных заболевание проявляется остановкой кровообращения в связи с нарушениями ритма сердца [1].
Методы диагностики КТ и острого коронарного синдрома схожи: электрокардиография, эхокардиография, коронароангиография, биохимические маркеры повреждения миокарда и сердечной недостаточности [1]. На данный момент мы не располагаем убедительными рекомендациями в отношении терапии КТ. На догоспитальном этапе, учитывая сложность дифференциальной диагностики КТ и острого коронарного синдрома, пациентам назначают базовую терапию, включающую в себя антикоагулянты, антиагреганты, β-блокаторы, нитраты, ингибиторы ангиотензинпревращаю-щего фермента, а также диуретики и инотропные препараты по показаниям. Однако эффективность данного подхода не доказана. В частности, не доказана эффективность приема β-блокаторов как потенциальных патогенетических средств ни в остром, ни в отдаленном периодах [8].
Риски рецидива в долгосрочном периоде также являются нерешенной проблемой: отдаленные результаты сопоставимы с таковыми у больных, перенесших инфаркт миокарда [8]. При этом ведущим фактором риска является характер триггера: более высокая смертность отмечается у пациентов с КТ, вызванной скорее физическим, нежели психоэмоциональным стрессом [15].
В связи с вышеизложенным заслуживает внимания следующее клиническое наблюдение.
Пациентка К., 54 лет, впервые обратилась в ОБУЗ «Курский областной научно-клинический центр им. Г.Е. Островерхова» (КОНКЦ) в мае 2022 г. Из анамнеза: наблюдалась гастроэнтерологом с предположительным диагнозом: Хронический колит, получала консервативное лечение без эффекта. При УЗИ органов брюшной полости и малого таза выявлено объемное новообразование, вовлекающее ректосигмоидное соединение, заднюю стенку матки и яичники, в связи с чем направлена на консультацию к онкологу.
На приеме у онколога предъявила жалобы на частый жидкий стул, постоянную тошноту, периодическую рвоту, отсутствие аппетита и прогрессирующее снижение массы тела до 8 кг, которые беспокоили последние 3 мес с постепенным нарастанием симптоматики. По данным КТ органов брюшной полости и малого таза с внутривенным болюсным усилением выявлена опухоль размерами 50×40 мм, инфильтрирующая дистальный отрезок сигмовидной и проксимальный отрезок прямой кишки, параколярную клетчатку; интимно прилежащую к матке и яичникам с двух сторон; лимфаденопатия внутренних и наружных подвздошных, параректальных лимфоузлов. Также при КТ выполнено вычисление скелетно-мышечного индекса (СМИ) для оценки саркопении, показавшее значительное снижение СМИ – 25,86 см2/м2. При колоноскопии обнаружена опухоль ректосигмоидного соединения со стенозированием просвета до 0,3 см (рис. 1), взята биопсия. Гистологически верифицирована аденокарцинома сигмовидной кишки низкой степени злокачественности (Low Grade).
Госпитализирована в отделение онкоколопрок-тологии и тазовой хирургии КОНКЦ в состоянии средней степени тяжести. Со слов родственников, последние 4 дня не принимала пищу и жидкость. Ex consilium принято решение о переводе пациентки в отделение анестезиологии и реанимации для обследования, коррекции водно-электролитного и метаболического баланса и определения дальней- шей тактики лечения. Параллельно проводимому лабораторному обследованию (табл. 2) проведена коррекция гиповолемии, дегидратации, инициировано смешанное энтерально-парентеральное восполнение белково-энергетической недостаточности тяжелой степени, антибиотикотерапия.
На 4-е сут при стабилизации состояния пациентка переведена в отделение онкоколо-проктологии и тазовой хирургии, где по данным контрольного лабораторного исследования сохранялись признаки анемии и гипопротеинемии. В отделении продолжены инфузионная терапия, смешанное энтерально-парентеральное питание, антибиотикотерапия.
На 6-е сут, несмотря на проводимое лечение, отмечалось резкое ухудшение состояния, с появлением рвоты, интенсивных схваткообразных болей в животе, что клинически соответствовало острой обтурационной толстокишечной непроходимости. Выполнена КТ органов брюшной полости, малого таза с контрастированием: стенки кишки в зоне ректосигмоидного соединения неравномерно утолщены до 20 мм, общей протяженностью до 140 мм, с рваными внутренними контурами, сужением просвета кишки. На этом уровне отмечается инфильтрат, размерами до 80×86 мм, сообщающийся с полостью кишки, включающий в себя петли толстой и тонкой кишки. Проксимально просвет толстой и тонкой кишки расширен, определяются немногочисленные уровни жидкости, свободная жидкость в малом тазу, брюшной полости. Установлен диагноз: рак ректосигмоидного соединения, стадия IIIC сT4bcN2M0, острая обтурационная кишечная непроходимость, принято решение о хирургическом лечении в экстренном порядке.
Пациентка проконсультирована кардиологом. Активно жалоб не предъявляла, при опросе указы-
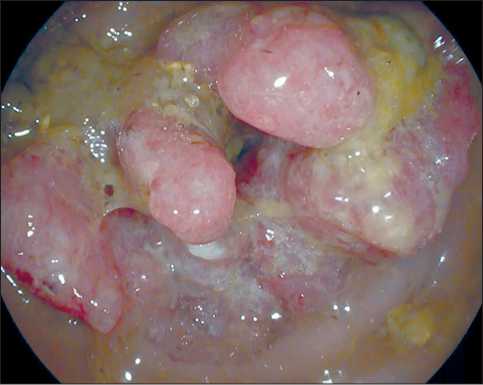
Рис. 1. Эндофото. Опухоль ректосигмоидного соединения со стенозированием просвета кишки. Примечание: изображение выполнено авторами
Fig. 1. Endophoto. Tumor of the rectosigmoid junction with stenosis of the intestinal lumen. Note: created by the authors вала на общую слабость и одышку при подъеме по лестнице на 2-й этаж; боли ангинозного характера отрицала, эпизоды перебоев в работе сердца, учащенного сердцебиения, пре-, синкопальных состояний не отмечала. Ранее у терапевта/кар-диолога по месту жительства не наблюдалась. Кардиологический анамнез не выявил особенностей; гипертоническую болезнь, сахарный диабет, перенесенные инфаркт миокарда, инсульт, табакокурение, а также прием лекарственных препаратов ранее отрицала. Рост и масса тела пациентки на момент осмотра составили 172 см и 59 кг, индекс массы тела – 19,9 кг/м2, что, согласно возрастным нормам, является дефицитом массы тела. Учитывая дефицит массы тела, с прогрессирующим снижением на более чем 5 % за последние 6 мес, потерю скелетной мускулатуры (согласно значению СМИ по данным КТ), а также признаки системного воспаления (по данным лабораторных анализов), у пациентки установлен синдром анорексии-кахексии онкологического больного. Артериальное давление на левой руке 122/79 мм рт. ст., на правой руке – 130/81 мм рт. ст., пульс правильного ритма, удовлетворительного наполнения, напряжения, соответствующий частоте сердечных сокращений 88 ударов в 1 мин, частота дыхательных движений 16 в 1 мин. Границы относительной и абсолютной сердечной тупости, аускультация сердца не выявили отклонений. Таким образом, согласно шкалам Score и Score2, пациентка имела низкий сердечно-сосудистый риск. Кардиологический риск пациентки, согласно индексу Lee (пересмотренному индексу кардиального риска RCRI), составил 1 балл (планирующееся хирургическое вмешательство повышенного риска), что соответствует риску большого кардиального события 0,4 %. Однако интерпретация результатов данного индекса затруднена в связи с экстренным характером планируемой операции. Физический статус пациентки по шкале ASA (Американского общества анестезиологов) III.
При срединной лапаротомии в брюшной полости до 1 л асцитической жидкости, которая удалена и взята для цитологического исследования. Тонкая кишка раздута, в просвете – жидкое содержимое и газ. При ревизии брюшной полости обнаружен опухолевый конгломерат в малом тазу, включающий в себя прямую кишку, дистальный отрезок и брыжейку сигмовидной кишки, матку с придатками, мочевой пузырь, слепую и восходящую толстую кишку, дистальный отрезок подвздошной кишки (около 20 см в диаметре), отдаленных метастазов не выявлено. Интраоперационно Ex consilium принято решение выполнить комбинированную эвисцерацию малого таза и правостороннюю гемиколэктомию. От формирования илеокондуи-та решено воздержаться в связи с ослабленным состоянием пациентки, травматичной тяжелой операцией. Сформировать уретерокутанеосто-му не представлялось возможным: длины левого мочеточника недостаточно для его выведения вправо (слева – колостома). Принято решение в раннем послеоперационном периоде выполнить двустороннюю перкутанную нефростомию.
Гистологическое исследование операционного материала: аденокарцинома ректосигмоидного соединения низкой степени злокачественности (Grade 1), прорастающая всю толщу кишечной стенки с инвазией в прилежащую клетчатку, тело матки, маточные трубы и яичники, заднюю стенку мочевого пузыря, припаянный отрезок тонкой кишки с формированием межкишечного свища. В окружающей жировой клетчатке – 25 лимфоузлов с неспецифическими реактивными изменениями.
Ранний послеоперационный период протекал удовлетворительно. С 1-х по 5-е сут состояние пациентки оставалось стабильным, на 6-е сут около 5:45 отмечено резкое ухудшение: снижение артериального давления до 87/54 мм рт. ст., увеличение частоты пульса до 119 в 1 мин на фоне усиления общей слабости, чувства нехватки воздуха, потребовавших проведения вазопрессорной поддержки норадреналином в дозе 0,2 мкг/кг/мин. На прикроватном ЭКГ-мониторе отмечалось появление отрицательного зубца Т в отведениях I и II. В 8:15 осмотрена кардиологом: в сознании, в пространстве, времени ориентирована. Жалобы на дискомфорт в области послеоперационной раны; ангинозные боли, одышку, перебои в работе сердца отрицала. АД на момент осмотра на правой руке 96/62 мм рт. ст. Аускультация сердца и легких без патологии. Выполнено ЭКГ, выявлена инверсия зубца Т в отведениях I, II, III, AVF, V2-V6 (рис. 2), удлинение корригированного интервала QT по формуле Friderici до 493 мс, отрицательная динамика в сравнении с предоперационным исследованием. При эхокардиографии в условиях палаты реанимации и интенсивной терапии диагностировано снижение сократительной способности левого желудочка, выявлены зоны нарушения локальной сократимости: акинез верхушки, апикальных, средних сегментов, гиперкинез базальных сегментов левого желудочка циркулярно (рис. 3). Индекс нарушения локальной сократимости составил 2,25, что при значении 1,75 и более позволяет установить КТ с уровнем чувствительности 83 % и специфичности 100 % [8]. Фракция выброса, определенная биплановым методом Симпсона, составила 37 %, систолическое давление в легочной артерии 24 мм рт. ст., среднее давление в легочной артерии – 16 мм рт. ст. Данные лабораторных методов исследования представлены в табл. 2. В связи с положительным результатом на высокочувствительный тропонин I (cTnI) через 2,5 ч после появления симптомов, а также данными ЭКГ и УЗИ сердца установлен предварительный диагноз: Острый коронарный
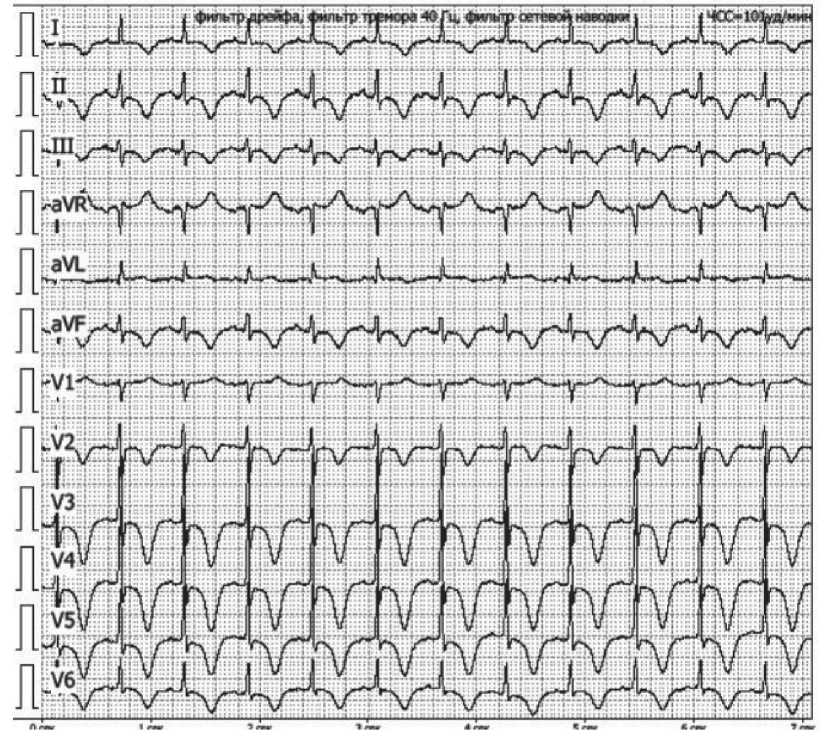
Рис. 2. Электрокардиографическое исследование на момент появления кардиальных симптомов. Примечание: изображение выполнено авторами Fig. 2. Electrocardiographic examination at the time of onset of cardiac symptoms.
Note: created by the authors
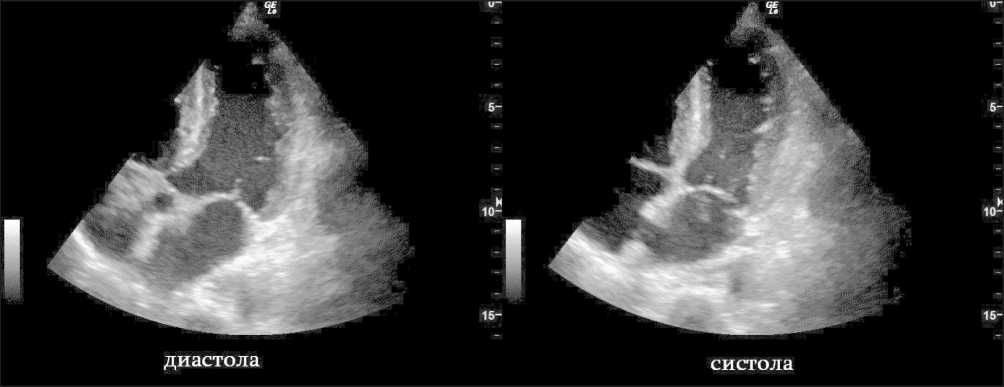
Рис. 3. Эхокардиографическое исследование на момент появления кардиальных симптомов. Примечание: изображение выполнено авторами Fig. 3. Echocardiography at the time of onset of cardiac symptoms. Note: created by the authors
синдром без подъема сегмента ST, и принято решение о селективной коронароангиографии, которая не выявила гемодинамически значимого поражения коронарных артерий. Учитывая повышение уровня МВ-фракции креатинфосфокиназы, cTnI, высокий уровень NT-терминального мозгового натрийуретического пропептида (NT-proBNP), неоднозначные изменения по данным ЭКГ, а также снижение сократительной способности левого желудочка с характерным паттерном «балло-нирования», дифференциальная диагностика проводилась между кардиомиопатией такоцубо, острым инфарктом миокарда без обструктивного поражения коронарных артерий (в частности, острым инфарктом миокарда 2-го типа), острым миокардитом, тромбоэмболией легочной артерии, которая, в свою очередь, может стать триггером для КТ.
Проведенная в тот же день КТ органов грудной клетки с внутривенным болюсным усилением не выявила дефектов наполнения контрастного вещества. Диагностический поиск осложнял ранний послеоперационный период, существенно влиявший на показатели некоторых маркеров: интерпретация повышенного уровня КФК-МВ в раннем послеоперационном периоде, как и D-димера, затруднена в связи с интраоперационным повреждением мышц и внутренних органов. На основании отсутствия свидетельств атеротромботиче-ского генеза вышеописанных изменений, а также учитывая ранний послеоперационный период, от приема антитромботической терапии решено воздержаться. С целью профилактики тромбоза пациентка получала фрагмин 5000 Ед 1 раз в день, кроме того, продолжалась вазопрессорная поддержка норадреналином в дозировке 0,2 мкг/кг/мин в течение 2 сут, с последующей отменой при стабилизации артериального давления на уровне 110/60–115/70 мм рт. ст. Результаты ЭКГ, проводимой ежедневно с 1-х по 3-и сут после
Результаты лабораторных исследований на стационарном этапе
Blood test results
Таблица 2/Table 2
|
Показатели/ Parameters |
"Рн 5 5 о .у с р о |
1’ |
X ® ° ” g Q w о 2 s g о О О о |
5 о га w § га s 2 о g ° ° d I о § о s g С О О 8 || ^ t еч |
S М _<Й U § ^ и Эно с g ° d й 8 о о о * g & О S ° g с Я Н 8 н ” Ц S ^ О 5 к_ S га S m « Q |
5 о Р-| га « § s S о щ S 4-1 g ° ° § ™ § О § о s g & С о ° d 8 || ^ t и |
5 о Р-| га « § s S о g ° ° § ™ § О § о s g & С о ° d 8 || ^ t и |
|
Гемоглобин, г/л/Hemoglobin, g/l |
83,0 |
96,0 |
90,0 |
90,1 |
90,3 |
90,1 |
90,1 |
|
Гематокрит, %/Hematocrit, % |
29,1 |
25,7 |
29,1 |
25,4 |
25,3 |
25,5 |
25,4 |
|
Лейкоциты, 109/л/Leukocytes, 109/l |
11,28 |
8,98 |
9,29 |
9,13 |
8,96 |
8,79 |
8,72 |
|
Общий холестерин, ммоль/л/ Total cholesterol, mmol/l |
4,2 |
4,1 |
3,9 |
||||
|
Глюкоза, ммоль/л/Glucose, mmol/l |
5,5 |
5,8 |
5,9 |
5,3 |
5,2 |
5,4 |
5,5 |
|
Общий белок, г/л/Total protein, g/l |
42,5 |
43,5 |
43,4 |
43,1 |
43,2 |
43,3 |
43,4 |
|
Мочевина, ммоль/л/Urea, mmol/l |
3,8 |
2,4 |
4,0 |
4,2 |
3,3 |
2,6 |
2,5 |
|
Креатинин, мкмоль/л/ Creatinine, mmol/l |
79,0 |
58,9 |
88,1 |
87,2 |
67,3 |
67,0 |
68,0 |
|
Билирубин общий, ммоль/л/ Total bilirubin, mmol/l |
12,0 |
4,7 |
5,1 |
5,4 |
5,8 |
5,2 |
5,0 |
|
АЛТ, Ед/л/ALT, Units/l |
11,0 |
13,0 |
22,0 |
24,0 |
20,0 |
19,0 |
14,0 |
|
АСТ, Ед/л/AST, Units/l |
8,0 |
9,0 |
12,0 |
12,0 |
10,0 |
9,0 |
9,0 |
|
СРБ, мкг/л/C-reactive protein, mcg/l |
118,0 |
109,0 |
118,0 |
110,0 |
103,0 |
103,0 |
102,0 |
|
Калий, ммоль/л/Potassium, mmol/ |
3,1 |
4,3 |
4,2 |
4,7 |
4,2 |
4,4 |
4,6 |
|
NT-натрийуретический пропептид, пг/мл/ NT-proBNP, pg/ml |
1112 |
2870 |
1489 |
469 |
218 |
||
|
Высокочувствительный тропонин I, пг/мл (норма менее 8 пг/мл)/ High sensitivity troponin I pg/ml (normal value is less than 8 pg/ml) |
16 |
10 |
0,4 |
0,2 |
|||
|
КФК-МВ, Ед/л/CK-MB U/l |
40 |
210 |
62 |
55 |
39 |
||
|
Д-димер, нг/мл/D-dimer, ng/ml |
2802 |
1978 |
2635 |
2343 |
2113 |
1986 |
1623 |
Примечание: таблица составлена авторами.
Note: created by the authors.
манифестации кардиальных симптомов, не имели существенной динамики, на 4–6-е сут отмечалось последовательное значительное снижение амплитуды отрицательных зубцов Т в указанных отведениях, с полным восстановлением на 7-е сут (рис. 4). С учетом стабилизации артериального давления пациентке рекомендован прием бисо-пролола в дозе 2,5 мг в сут. На 7-е сут на фоне стабилизации состояния выполнена эхокардиография, выявившая исчезновение зон нарушения локальной сократимости, фракция выброса биплановым методом Симпсона составила 57 %, что расценено как положительная динамка. Высокий уровень NT-proBNP, быстрая и полная обратная динамика изменений на электрокардиограмме, эхокардиограмме, кардиомаркеров, отсутствие ассоциации зон нарушения локальной сократимости с бассейнами кровоснабжения коронарных артерий позволили исключить инфаркт миокарда без обструкции коронарных артерий. Кроме того, указанные изменения, типичный паттерн «балло-нирования» миокарда левого желудочка, высокий риск КТ, согласно международным критериям InterTAK (набрано 80 баллов: 25 баллов за женский пол, 24 балла за эмоциональный стресс (страх операции, нахождения в хирургическом стационаре, онкологический диагноз)), 13 баллов за физический стресс (оперативное лечение большого объема, осложнения основного заболевания в виде водноэлектролитных нарушений и т. д.), 12 баллов за отсутствие депрессии сегмента ST (у пациентки отмечались неспецифическая диффузная инверсия
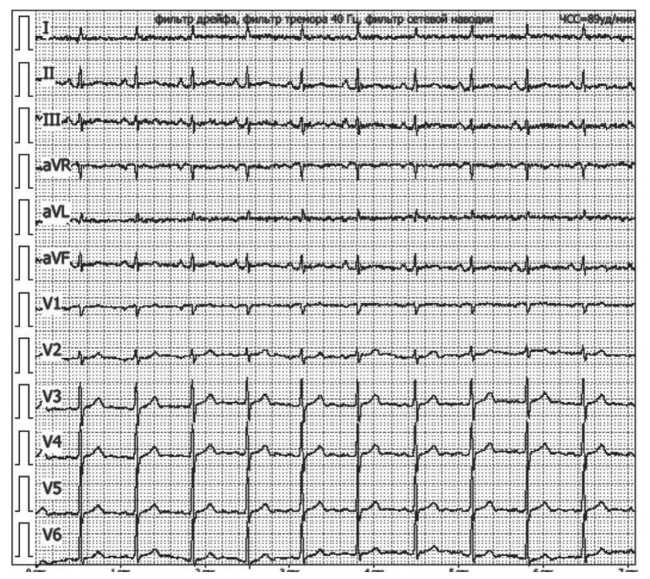
Рис. 4. Электрокардиографическое исследование на 7-е сут после появления кардиальных симптомов. Примечание: изображение выполнено авторами Fig. 4. Electrocardiographic examination on day 7 after onset of cardiac symptoms. Note: created by the authors
зубца Т), а также 6 баллов за удлинение сегмента QT (более 460 мс), что соответствует 97,3 % вероятности КТ) также указывали в пользу КТ, хотя и не позволяли полностью исключить диагноз миокардита. Согласно алгоритму InterTAK, при высоком риске КТ, отсутствии поражения коронарных артерий, способных объяснить появление зон нарушения локальной сократимости, отсутствии признаков миокардита, таких как перикардит, симптомы вирусных заболеваний, которые, в свою очередь, не выявлены у больной (повышенный уровень С-реактивного белка расценен авторами как проявление эндогенной интоксикации на фоне тяжелого онкологического процесса и не связан с инфекционными заболеваниями), отсутствие перенесенных бактериальных и вирусных инфекций за предыдущие 2 мес, а также не выявившая возбудителя новой коронавирусной инфекции COVID-19 проведенная полимеразная цепная реакция материала, полученного при заборе мазка из носоглотки, перед поступлением в стационар и в день появления кардиальных симптомов, и, что немаловажно, быстрое и полное восстановление клинической, лабораторной, электрокардиографической и сонографической картины делают диагноз миокардита менее вероятным и позволяют установить окончательный диагноз: Стрессовая кардиомиопатия такоцубо. Таким образом, окончательный диагноз КТ установлен ретроспективно по совокупности данных: высокой вероятности КТ по шкале InterTAK, типичного паттерна изменения регионарной сократимости левого желудочка по данным эхокардиографии, значительного повышения натрийуретических пептидов на фоне диагностически значимого, но менее интенсивного повышения маркеров повреждения миокарда, интактного коронарного русла согласно результатам проведенной коронароан-гиографии, отсутствия признаков миокардита, а также быстрого (к 7-м сут) и полного восстановления гемодинамики, показателей электрокардиографии, эхокардиографии.
В дальнейшем в связи со стабилизацией состояния пациентка переведена в отделение колопроктологии и тазовой хирургии. На 14-е сут от манифестации КТ при контрольном эхокардиографическом исследовании зон нарушения локальной сократимости не выявлено, фракция выброса по Симпсону составила 60 %. По данным контрольной электрокардиографии определен регулярный синусовый ритм, физиологическая частота сердечных сокращений – 66 ударов в 1 мин, отсутствие инверсии зубца Т. При выписке больной рекомендован ежедневный прием бисопролола 2,5 мг/сут. Учитывая положительную динамику, полное восстановление функции сердечно-сосудистой системы, кардиологических противопоказаний к адъювантной химиотерапии не установлено.
Обсуждение
Заболеваемость колоректальным раком имеет один из наиболее высоких темпов прироста. Высока доля таких пациентов среди лиц пожилого и старческого возраста, причем значительную долю составляют лица с III и IV стадиями онкологического процесса, диагностируемого на этапе развития жизнеугрожающих осложнений, таких как кишечная непроходимость, перитонит, кровотечение, кахексия, тяжелая анемия и т.д., что обусловливает сохраняющуюся высокую общую и послеоперационную летальность [16]. Несомненную негативную роль в высокой смертности подобных больных играет как исходный скомпрометированный сердечно-сосудистый статус, так и усугубление сердечно-сосудистых рисков в процессе противоопухолевого лечения. По данным литературы, среди включенных в исследование клинических наблюдений КТ у онкологических пациентов почти половина больных страдает злокачественными новообразованиями желудочнокишечного тракта [12].
Кроме того, исследования, посвященные анализу периоперационных кардиоваскулярных осложнений, также демонстрируют неутешительные данные. Согласно крупному международному проспективному когортному исследованию, диагностически значимое повышение уровня тропонина Т (0,03 нг/мл и более) в послеоперационном периоде после внесердечных хирургических вмешательств является независимым предиктором 30-дневной смертности (скорректированное отношение рисков составило 3,87; 95 % ДИ, 2,96–5,08) больных наряду с ТЭЛА, инсультом и сепсисом. Более того, среди пациентов со значимым повышением уровня тропонина более половины (58,2 %) не соответствовали критериям универсального определения инфаркта миокарда, а ишемические изменения на ЭКГ (инверсия зубца Т, девиация сегмента ST) и вовсе наблюдались только у 34,9 % пациентов [17].
Кардиомиопатия такоцубо – неотложное состояние, требующее оказания экстренной кардиологической помощи. Среди всех неотложных состояний в кардиологии КТ занимает особое место, имея сопоставимые с острым коронарным синдромом риски, и не обладает достаточной доказательной базой ни в отношении терапии, ни в отношении профилактики [1], что затрудняет выбор оптимальной тактики лечения как самой кардиомиопатии, так и основного заболевания, в частности дальнейшего выбора режима химиотерапии.
Ведущая роль в механизме отдается катехоламиновой токсичности, которая проявляется в вазоконстрикции периферических и коронарных артерий, а также прямому повреждению миокарда в виде его «оглушения», или так называемого станнирования – обратимого повреждения с временным нарушением функции в апикальных сегментах, наиболее насыщенных бета-адренергическими рецепторами, что, во-видимому, имело место в данной клинической ситуации [18]. Наиболее подвержены КТ женщины старше 50 лет, имеющие 10-кратный риск развития КТ по сравнению с мужчинами [1]. Исходя из патогенеза, закономерными выглядят нарушения, выявляемые при использовании визуализирующих методик: характерный паттерн проявляется в виде так называемого баллонирования апикальных отделов левого желудочка – дискинеза или акинеза апикальных и средних отделов в сочетании с гиперкинезом базальных отделов левого желудочка, как и было представлено в нашем клиническом наблюдении. Триггером КТ принято считать стресс, психический и физический. Пациенты со злокачественными новообразованиями, в частности с раком прямой кишки, имеют эти факторы риска, что находит отражение в статистике: по данным наблюдений, злокачественные новообразования выявляются у 14 % пациентов с КТ в острую фазу и у 10 % – при дальнейшем наблюдении [19]. Типично и течение заболевания: остро возникшая сердечная недостаточность, неспецифические изменения на электрокардиограмме, повышение специфических кардиомаркеров, преимущественно за счет NT-proBNP, отсутствие значимого поражения коронарных артерий, быстрая обратная динамика и полное восстановление. Типичные проявления КТ вкупе с отсутствием так называемых красных флагов миокардита (недавно перенесенные инфекционные заболевания или имеющиеся симптомы таковых, перикардит) позволяют установить диагноз, не прибегая к проведению магнитно-резонансной томографии сердца в острый период, что является важным в отсутствие возможности проведения данного метода исследования [8].
Данный клинический пример представляет пациентку со злокачественным новообразованием ректосигмоидного соединения, осложненного острой кишечной непроходимостью, поступившей в стационар в тяжелом состоянии с выраженным отклонениями гомеостаза, потребовавшей экстренной операции большого объема и высокого анестезиологического риска. Несмотря на исходный низкий кардиологический риск, вероятно, сочетание вышеописанных факторов привело к усугублению течения основного заболевания с развитием такого осложнения со стороны сердечно-сосудистой системы, как стрессовая КТ. Кардиомиопатию такоцубо принято считать доброкачественной, тем не менее жизнеугрожающие осложнения встречаются у 20–45 % пациентов, а уровень госпитальной летальности, по разным данным, составляет 1–8,7 % [6]. Отдаленная смертность таких пациентов также выше, чем в обычной популяции, и сопоставима с таковой у больных ишемической болезнью сердца. Благодаря адекватному лечению, тесному взаимодействию онкологов, анестезиологов-реаниматологов и кардиологов в составе мультидисциплинарной команды достигнут благоприятный исход заболевания, что позволило запланировать проведение адъювантной химиотерапии.
Заключение
Тяжелое течение онкологического заболевания, осложняющегося нарушением гемостаза, белковоэнергетической недостаточностью, электролитными нарушениями, неоднократным хирургическими вмешательствами большого объема, можно отнести к триггерам кардиомиопатии такоцубо. Сочетание таких обстоятельств нередко встречается у онкологических пациентов, как было и в представленном наблюдении. Значимость сердечно-сосудистых осложнений у онкологических пациентов во вре- мя специализированного лечения, в частности на фоне хирургических вмешательств, демонстрирует актуальность данной проблемы, а также необходимость параллельного мониторинга и динамической оценки кардиологического статуса.
Список литературы Кардиомиопатия Такоцубо при местнораспространенном раке ректосигмоидного соединения: междисциплинарное преодоление осложнений
- Болдуева С.А., Евдокимов Д.С. Кардиомиопатия такоцубо. Обзор данных литературы: понятие, эпидемиология, патогенез. Часть I. Российский кардиологический журнал. 2022; 27(3s): 4993. [Boldueva S.A., Evdokimov D.S. Takotsubo cardiomyopathy. Literature review: concept, epidemiology, pathogenesis. Part I. Russian Journal of Cardiology. 2022; 27(3s): 4993. (in Russian)]. doi:10.15829/1560-4071-2022-4993.
- Ghadri J.R., Kato K., Cammann V.L., Gili S., Jurisic S., Di Vece D., Candreva A., Ding K.J., Micek J., Szawan K.A., Bacchi B., Bianchi R., Levinson R.A., Wischnewsky M., Seifert B., Schlossbauer S.A., Citro R., Bossone E., Münzel T., Knorr M., Heiner S., D’Ascenzo F., Franke J., Sarcon A., Napp L.C., Jaguszewski M., Noutsias M., Katus H.A., Burgdorf C., Schunkert H., Thiele H., Bauersachs J., Tschöpe C., Pieske B.M., Rajan L., Michels G., Pfister R., Cuneo A., Jacobshagen C., Hasenfuß G., Karakas M., Koenig W., Rottbauer W., Said S.M., Braun-Dullaeus R.C., Banning A., Cuculi F., Kobza R., Fischer T.A., Vasankari T., Airaksinen K.E.J., Opolski G., Dworakowski R., MacCarthy P., Kaiser C., Osswald S., Galiuto L., Crea F., Dichtl W., Empen K., Felix S.B., Delmas C., Lairez O., El-Battrawy I., Akin I., Borggrefe M., Horowitz J., Kozel M., Tousek P., Widimský P., Gilyarova E., Shilova A., Gilyarov M., Winchester D.E., Ukena C., Bax J.J., Prasad A., Böhm M., Lüscher T.F., Ruschitzka F., Templin C. Long-Term Prognosis of Patients With Takotsubo Syndrome. J Am Coll Cardiol. 2018; 72(8): 874–82. doi: 10.1016/j.jacc.2018.06.016.
- Deshmukh A., Kumar G., Pant S., Rihal C., Murugiah K., Mehta J.L. Prevalence of Takotsubo cardiomyopathy in the United States. Am Heart J. 2012; 164(1): 66–71. doi: 10.1016/j.ahj.2012.03.020.
- Kato K., Lyon A.R., Ghadri J.R., Templin C. Takotsubo syndrome: aetiology, presentation and treatment. Heart. 2017; 103(18): 1461–9. doi: 10.1136/heartjnl-2016-309783.
- Vitale C., Rosano G.M., Kaski J.C. Role of Coronary Microvascular Dysfunction in Takotsubo Cardiomyopathy. Circ J. 2016; 80(2): 299–305. doi: 10.1253/circj.CJ-15-1364.
- Rawish E., Stiermaier T., Santoro F., Brunetti N.D., Eitel I. Current Knowledge and Future Challenges in Takotsubo Syndrome: Part 1-Pathophysiology and Diagnosis. J Clin Med. 2021; 10(3): 479. doi: 10.3390/jcm10030479.
- Del Buono M.G., Montone R.A., Camilli M., Carbone S., Narula J., Lavie C.J., Niccoli G., Crea F. Coronary Microvascular Dysfunction Across the Spectrum of Cardiovascular Diseases: JACC State-of-the-Art Review. J Am Coll Cardiol. 2021; 78(13): 1352–71. doi: 10.1016/j.jacc.2021.07.042.
- Ghadri J.R., Wittstein I.S., Prasad A., Sharkey S., Dote K., Akashi Y.J., Cammann V.L., Crea F., Galiuto L., Desmet W., Yoshida T., Manfredini R., Eitel I., Kosuge M., Nef H.M., Deshmukh A., Lerman A., Bossone E., Citro R., Ueyama T., Corrado D., Kurisu S., Ruschitzka F., Winchester D., Lyon A.R., Omerovic E., Bax J.J., Meimoun P., Tarantini G., Rihal C., Y-Hassan S., Migliore F., Horowitz J.D., Shimokawa H., Lüscher T.F., Templin C. International Expert Consensus Document on Takotsubo Syndrome (Part II): Diagnostic Workup, Outcome, and Management. Eur Heart J. 2018; 39(22): 2047–62. doi: 10.1093/eurheartj/ehy077.
- Kotsiou O.S., Douras A., Makris D., Mpaka N., Gourgoulianis K.I. Takotsubo cardiomyopathy: A known unknown foe of asthma. J Asthma. 2017; 54(8): 880–6. doi: 10.1080/02770903.2016.1276586.
- Jin Q., Luo Q., Zhao Z., Zhao Q., Yu X., Yan L., Gao L., Liu Z. Takotsubo syndrome with pulmonary embolism: a case report and literature review. BMC Cardiovasc Disord. 2018; 18(1): 229. doi: 10.1186/s12872-018-0953-7.
- Agarwal S., Bean M.G., Hata J.S., Castresana M.R. Perioperative Takotsubo Cardiomyopathy: A Systematic Review of Published Cases. Semin Cardiothorac Vasc Anesth. 2017; 21(4): 277–90. doi: 10.1177/1089253217700511.
- Desai A., Noor A., Joshi S., Kim A.S. Takotsubo cardiomyopathy in cancer patients. Cardiooncology. 2019; 5: 7. doi: 10.1186/s40959-019-0042-9.
- Ayoub C., Chang M., Kritharides L. A case report of ventricular dysfunction post pericardiocentesis: stress cardiomyopathy or pericardial decompression syndrome? Cardiovascular Ultrasound. 2015; 13: 32. doi: 10.1186/s12947-015-0026-3.
- Lyon A.R., López-Fernández T., Couch L.S., Asteggiano R., Aznar M.C., Bergler-Klein J., Boriani G., Cardinale D., Cordoba R., Cosyns B., Cutter D.J., de Azambuja E., de Boer R.A., Dent S.F., Farmakis D., Gevaert S.A., Gorog D.A., Herrmann J., Lenihan D., Moslehi J., Moura B., Salinger S.S., Stephens R., Suter T.M., Szmit S., Tamargo J., Thavendiranathan P., Tocchetti C.G., van der Meer P., van der Pal H.J.H.; ESC Scientific Document Group. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). Eur Heart J. 2022; 43(41): 4229–361. doi: 10.1093/eurheartj/ehac244. Erratum in: Eur Heart J. 2023; 44(18): 1621.
- Станоевич У.С., Горелик С.Г., Звягин И.Н., Полянский М.Б., Рукавишников А.С. Распространенность колоректального рака у пациентов старших возрастных групп. Современные проблемы здравоохранения и медицинской статистики. 2021; 4: 235–50. [Stanoevich U.S., Gorelik S.G., Zvyagin I.N., Polyansky M.B., Rukavishnikov A.S. Prevalence of colorectal cancer in older age patients. Current problems of health care and medical statistics. 2021; 4: 235–50. (in Russian)].
- Botto F., Alonso-Coello P., Chan M.T., et al. Myocardial injury after noncardiac surgery: a large, international, prospective cohort study establishing diagnostic criteria, characteristics, predictors, and 30-day outcomes. Anesthesiology. 2014; 120(3): 564–78. doi: 10.1097/ALN.0000000000000113.
- Akashi Y.J., Nef H.M., Lyon A.R. Epidemiology and pathophysiology of Takotsubo syndrome. Nat Rev Cardiol. 2015; 12(7): 387–97. doi: 10.1038/nrcardio.2015.39.
- Watanabe M., Izumo M., Akashi Y., J. Novel Understanding of Takotsubo Syndrome. Int Heart J. 2018; 59(2): 250–5. doi: 10.1536/ihj.17-586.
- Станоевич У. Коррекция факторов риска колоректального рака – путь к первичной патогенетической профилактике. Вестник Российского научного центра рентгенорадиологии. 2016; 16(3): 8. [Stanoevich U. Risk factors correction of colorectal cancer – the way to the primary pathogenetic prevention. Bulletin of the Russian Scientific Center of Radiology. 2016; 16(3): 8. (in Russian)].


