Каротидная эндартерэктомия в остром периоде ишемического инсульта
Автор: Казанцев Антон Николаевич, Бурков Н.Н., Тарасов Р.С., Ануфриев А.М., Шабаев А.Р., Рубан еВ., Миронов А.В., Херасков В.Ю.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Случаи из клинической практики
Статья в выпуске: 1 т.22, 2018 года.
Бесплатный доступ
В отечественных и зарубежных рекомендациях по реваскуляризации головного мозга нет окончательного решения в определении сроков и возможности проведения каротидной эндартерэктомии в остром периоде ишемического инсульта. В статье представлен комплекс мероприятий, позволивший получить удовлетворительный исход каротидной эндартерэктомии при остром нарушении мозгового кровообращения по ишемическому типу. Для профилактики гиперперфузионных осложнений использованы временный шунт и низкие дозы нефракционированного гепарина, адекватная дезагрегантная, гипотензивная и гиполипидемическая терапия. Рассмотрены основные преимущества и недостатки всех современных методов оперативного лечения данного состояния.
Каротидная эндартерэктомия, острый период ишемического инсульта, экстренная реваскуляризация головного мозга
Короткий адрес: https://sciup.org/142230649
IDR: 142230649 | DOI: 10.21688/1681-3472-2018-1-66-72
Текст научной статьи Каротидная эндартерэктомия в остром периоде ишемического инсульта
Несмотря на ряд исследований, посвященных оптимизации сроков выполнения каротидной эндартерэктомии (КЭЭ) после острого нарушения мозгового кровообращения (ОНМК), единого мнения относительно целесообразности применения данного метода лечения больных в остром периоде ишемического инсульта нет [1–3]. Согласно национальным рекомендациям по реваскуляризации головного мозга при атеросклеротическом поражении брахиоцефальных артерий, КЭЭ выполняется в течение двух нед. от последнего эпизода ОНМК/транзиторной ишемической атаки [4]. В соответствии с европейскими рекомендациями по ведению больных с ишемическим инсультом и транзиторной ишемической атакой, КЭЭ должна осуществляться как можно раньше после цереброваскулярной катастрофы: в идеале в течение двух недель (класс II, уровень В) [5]. Однако частота повторных ОНМК/транзиторной ишемической атаки в этот период достигает 21%, что сдер- живает хирургическую активность при ОНМК в клинической практике [2].
Представлен случай успешной активной хирургической тактики в объеме каротидной эндартерэктомии в остром периоде ишемического инсульта.
Клинический случай
Женщина 61 года поступила в клинику в плановом порядке для выполнения каротидной эндартерэктомии. Жалобы на слабость и онемение в левых конечностях. История заболевания: ОНМК по ишемическому типу перенесла в 2015 г., после чего сохранялся неврологический дефицит с левосторонним гемипарезом до 4 баллов в руке и гемигипестезией. При обследовании по данным ангиографии брахиоцефальных артерий от 05.04.2017 выявлен стеноз внутренней сонной артерии (ВСА) справа 95% (рис. 1).
По результатам коронарографии от 05.04.2017, ок-клюзионно-стенотические поражения отсутствовали.
@ (D
Статья доступна по лицензии Creative Commons Attribution 4.0.
Общий осмотр: состояние больной относительно удовлетворительное. Кожа телесного цвета, чистая. При аускультации сонных артерий шумов не выявлено. Дыхание везикулярное, хрипов нет. Частота дыхания — 16 в мин. Тоны сердца ясные, ритмичные. Частота сердечных сокращений— 72 уд./мин. Артериальное давление — 110/60 мм рт. ст. Живот мягкий, безболезненный. Поясничная область без особенностей, симптом поколачивания отрицательный. Функция тазовых органов в норме.
В первые сутки госпитализации пациентка пожаловалась на усиление слабости в левых конечностях. В неврологическом статусе: сознание ясное, реакции адекватны, ориентировка сохранена. Движения глаз в полном объеме, нистагма нет. Зрачки D = S, фотореакции (прямая и содружественная) живые, конвергенция достаточная. Чувствительность на лице снижена слева. Лицо симметрично в покое и при мимических движениях. Язык по средней линии, подвижен. Глоточные рефлексы сохранены. Глотание и фонация в норме. Имеются элементы дизартрии. Снижена сила в левой руке до трех баллов, в левой ноге до четырех. Рефлексы с трехглавой мышцы плеча D = S, двуглавой мышцы плеча D = S, карпорадиальные рефлексы D ≤ S, коленные D ≤ S, ахилловы D = S живые. Патологических рефлексов нет. Тонус мышц в норме D = S. Чувствительность снижена по гемитипу слева. Менингеальные знаки отрицательные. Координаторные пробы нечетко слева. В позе Ромберга пошатывается. Показатель по Шкале инсульта Национального института здоровья (англ. National Institutes of Health Stroke Scale) — 3. Индекс мобильности Ривермид — 14. Показатели по Модификационной шкале Рэнкина — 2, шкале Бартела — 100.
В экстренном порядке выполнена компьютерная томография: имеются признаки хронической ишемии голов ного мозга. По результатам магнитно-резонансной томографии головного мозга, признаки мелкого очага острой ишемии в правой теменной доле бассейна правой средней мозговой артерии (СМА) до 6,0 мм интенсивного сигнала на TIRM и выраженным ограничением диффузии DWI. Также отмечен участок течения остро-подострых ишемических изменений в правой затылочной доле на границе переходной зоны кровоснабжения правой СМА и задней мозговой артерии, размерами до 22 мм. Отмечены многочисленные субкортикальные очаги хронической ишемии в лобных и теменных долях обоих полушарий мозга. Небольшой постишемический очаг в левом полуовальном центре. Незначительное заместительное расширение субарахноидального пространства. Прочих патологических изменений не отмечено (рис. 2).
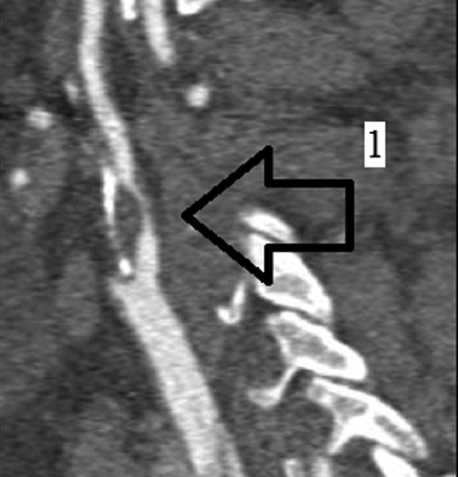
Рис. 1. Ангиография брахиоцефальных артерий Примечание. 1 — гемодинамически значимый стеноз внутренней сонной артерии
Fig. 1. Brachiocephalic artery angiography. 1 — hemodynamically significant stenosis of internal carotid artery
Установлен диагноз «атеросклероз». Субокклюзия ВСА справа. Повторное ОНМК по ишемическому типу в бассейне правой СМА от 23.04.2017. Резидуальный период ОНМК по ишемическому типу в бассейне правой СМА 2015 г. Левосторонний умеренный гемипарез, гемигипес-тезия слева. Хроническая ишемия головного мозга II ст. Вестибуло-атактический синдром. Гипертоническая болезнь III стадии, 4-я степень риска.
В утренние часы пациентке проводилась повторная магнитно-резонансная томография головного мозга: увеличение размеров ранее выявленных острого очага и участка течения ишемических изменений в бассейне правой СМА не отмечалось. Коллегиально (кардиохирург, ангиохирург, рентгенохирург, нейрохирург, невролог) приняли решение об экстренном оперативном лечении в объеме КЭЭ справа с применением временного шунта. Оперативное вмешательство выполнялось по стандартной методике с использованием заплаты из ксеноперикарда («НеоКор»), период пережатия сонных артерий — 26 мин. Интраоперационные характеристики стеноза ВСА: атероматозная, кальцинированная атеросклеротическая бляшка
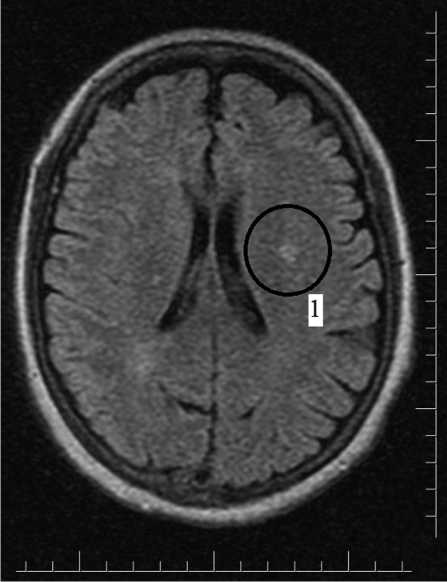
Рис. 2. Магнитно-резонансная томография головного мозга
Примечание. 1 — признаки мелкого очага острой ишемии
Fig. 2. Magnetic resonance imaging of the brain. 1 — signs of small ischemic loci со свежим красным тромбом в дистальном сегменте, не-окклюзирующим просвет сосуда.
Результаты и обсуждение
Несмотря на своевременную диагностику стеноза ВСА по результатам цветового дуплексного сканирования и рекомендации, данные в районной больнице, больная воздержалась от дальнейшего обследования с целью определения показаний к хирургической коррекции, что привело к развитию первого ОНМК. После лечения пациентку выписали с рекомендациями проведения мультиспиральной компьютерной томографии с ангиографией брахиоцефальных артерий. Однако больная явилась на обследование через 2 года, когда был верифицирован субтотальный стеноз ВСА. Необходимо отметить, что пациентка пренебрегала назначенной медикаментозной терапией и рекомендациями врача. Низкая комплаентность больной явилась основной причиной поздней госпитализации для хирургиче- ской коррекции и формирования повторного ОНМК, которое потребовало срочной каротидной эндартерэктомии.
Важным способом реваскуляризации в остром периоде ишемического инсульта является тромболитическая терапия (ТЛТ) [6]. Однако известно, что в данной когорте больных эффект процедуры сопряжен с геморрагическими осложнениями, носящими летальный характер в 2–8% случаев [6–8]. В связи с чем данная опция лечения не является оптимальной. Следует отметить, что эффективность ТЛТ ограничивается интервалом терапевтического окна (4,5 ч при внутривенном введении тромболитика и 6 ч при селективном введении препарата) и выраженностью неврологического дефицита. В связи с существенным количеством противопоказаний не более 10% больных ОНМК по ишемическому типу потенциально могут соответствовать критериям для выполнения ТЛТ. Необходимо подчеркнуть, что ТЛТ не влияет на гемодинамически значимый стеноз ВСА, обеспечивая только лизис свежего тромба. На результат ТЛТ влияет калибр пораженного сосуда: вероятность успешной реканализации варьирует от 77% для M2-сегмента средней мозговой артерии (СМА) до 35% для ВСА [2]. Низкая способность к проникновению в тромб ограничивает эффективность ТЛТ при протяженных тромбозах. Так, при протяженности тромба в M1-сегменте СМА более 8 мм вероятность успешной реканализации стремится к нулю, а при протяженности тромбоза до 2 мм превышает 90% [9].
До сих пор не определено место и не установлены временные рамки для выполнения КЭЭ после тромболизиса. Согласно данным К. Fassbender, после ТЛТ гипокоагуляция может сохраняться до 72 ч, что создает дополнительные трудности в выборе стратегии реваскуляризации головного мозга и значимо увеличивает риск геморрагических осложнений при активной хирургической тактике [10]. Убедительная доказательная база по данному вопросу отсутствует, тем не менее, согласно данным международного регистра, нет разницы в частоте смертельных исходов и кардиоваскулярных событий между группой больных, перенесших ТЛТ и КЭЭ, и группой КЭЭ в 30-дневном послеоперационном периоде [11].
Еще одним методом реваскуляризации, набирающим доказательную базу в последние годы, является эндоваскулярная тромбоаспирация. Эта методика, обеспечивающая быструю реперфузию, позволяет расширить диапазон терапевтического окна при лечении пациен- тов с ишемическим ОНМК с 4,5–6 до 8 ч [9, 12]. В ряде рандомизированных исследований показана высокая эффективность данного метода лечения, что выражалось в снижении частоты развития геморрагических осложнений в сравнении с ТЛТ [13]. По данным исследований использования современных стентов-ретриверов для эндоваскулярной тромбоаспирации, успешная реканализация достигается в 61–86% случаев, 40–58% больных имеют положительные результаты в 90-дневном послеоперационном периоде, а летальность колеблется в пределах 17–34% [9, 14]. Главный вывод проведенных исследований в том, что эндоваскулярная тромбоаспирация улучшает клинический исход только при подтвержденной проксимальной окклюзии крупных артерий каротидных бассейнов (ВСА, М1–М2-сегменты СМА, А1–А2-сегменты передней мозговой артерии). Это позволяет рекомендовать включение методов визуализации сосудов головного мозга в стандартный протокол обследования больных с ОНМК по ишемическому типу. Таким образом, и такой перспективный способ лечения пациентов не является универсальным.
Каротидная эндартерэктомия в остром периоде ишемического инсульта сопряжена с высоким хирургическим риском. Однако последние достижения в области нейровизуализации, а также наличие междисциплинарной команды, включающей сердечно-сосудистого хирурга, нейрохирурга, эндоваскулярного хирурга, анестезиолога, невролога и кардиолога, позволяют выбрать оптимальный способ лечения пациента с острой сосудистой патологией, включая экстренное хирургическое вмешательство. Кроме того, современные протоколы анестезиологического пособия, а также гипотензивная, антиагрегантная, гиполипидемическая и кардиопротекторная фармакотерапия значительно минимизируют оперативные риски [15, 16]. По данным ряда исследований, КЭЭ при ОНМК необходимо выполнять в мультимодальном сосудистом центре, что минимизирует риски периоперационных осложнений и в значительной степени способствует регрессу неврологической симптоматики [17]. Согласно результатам многоцентрового исследования G. Tsivqoulis, комбинированная конечная точка в 30-дневном послеоперационном периоде, включающая ОНМК, инфаркт миокарда и смерть, при выборе хирургического метода лечения достигает 5,5%, что является более оптимальным показателем по сравнению с консервативной и тромболитической терапией [18].
Продолжаются споры об оптимальных сроках выполнения КЭЭ после начала неврологической симптоматики. Однако результаты одного из зарубежных исследований нашли признание в мировой практике. Каротидная эндартерэктомия, выполненная в течение 48 ч с момента манифестации неврологического дефицита, приводит к значимому снижению периоперационных ОНМК/транзиторной ишемической атаки по сравнению с хирургической коррекцией в период, превышающий 48 ч (4,4 против 8,8%) [19]. Таким образом, экстренная каротидная эндартерэктомия в представленном клиническом случае (через 12 ч от появления неврологического дефицита) оказалась обоснованной и соответствующей актуальным европейским рекомендациям мерой [5] и способствовала успешному исходу заболевания.
Трансформация ишемического в обширный геморрагический инсульт давно рассматривается как основной риск раннего оперативного вмешательства. Тем не менее, по данным мировой литературы, в 30-дневном послеоперационном периоде частота подобных конверсий не превышает 2% [20]. Это осложнение чаще всего сопряжено с гиперперфузионным синдромом, возникающим после адекватной реваскуляризации головного мозга [21]. В актуальных отечественных и зарубежных рекомендациях не освещен вопрос решения данной проблемы, а также нет информации по поводу интраоперационной антикоагулянтной терапии [4, 5]. Таким образом, по решению консилиума, хирургическое вмешательство выполнялось на базе нейрохирургического отделения при участии нейрохирурга для возможности ранней диагностики и экстренного вмешательства на головном мозге при геморрагической трансформации зоны ишемии. КЭЭ сопровождалась применением временного шунта и минимальным болюсным введением гепарина (2,5 тыс. ед.), что позволило достичь удовлетворительного исхода.
В послеоперационном периоде отмечался регресс неврологического дефицита до исходного уровня (левосторонний гемипарез до 4 баллов, гемигипестезия слева). Пациентка выписана на 7-е сут. в удовлетворительном состоянии.
В литературе недостаточно данных об использовании временного шунта в условиях ОНМК по ишемическому типу. Чаще всего его применение связано с профилактикой осложнений у плановых пациентов с контралатеральной окклюзией ВСА [22]. Однако, по данным крупного многоцентрового исследования I.
Barbettа, из 103 больных с экстренной КЭЭ у 3,9% зафиксирован послеоперационный геморрагический инсульт и один летальный исход, что было вызвано гиперперфузионным отеком головного мозга. Временный шунт можно применять для профилактики этих осложнений [19], что и явилось фактором успешного исхода в представленном клиническом случае.
Таким образом, выполнение КЭЭ при остром нарушении мозгового кровообращения в ряде случаев является оптимальным способом реперфузии при ишемическом инсульте. Для профилактики гиперперфузионных осложнений КЭЭ целесообразно использовать временный шунт и низкие дозы нефракционированно-го гепарина, адекватной дезагрегантной, гипотензивной и гиполипидемической терапии.
Заключение
Современный центр сердечно-сосудистой хирургии должен располагать арсеналом способов лечения пациентов с ишемическим инсультом, а выбор оптимального метода и сроков его реализации необходимо осуществлять мультидисциплинарной командой. Применение тактики экстренного хирургического вмешательства в объеме КЭЭ в остром периоде ишемического инсульта обеспечило профилактику фатальных осложнений и полный регресс неврологического дефицита. Тем не менее требуются дальнейшие рандомизированные исследования с целью утверждения протоколов лечения данной когорты больных.
Финансирование
Работа выполнена при поддержке комплексной программы фундаментальных научных исследований Сибирского отделения Российской академии наук.
Список литературы Каротидная эндартерэктомия в остром периоде ишемического инсульта
- Шатравка А.В., Сокуренко Г.Ю., Суворов С.А., Ризаханова М.Р., Логинов И.А., Алексеева Н.В. Результаты операций каротидной эндартерэктомии, выполненных в остром периоде ишемического инсульта. Ангиология и сосудистая хирургия. 2016; 22(2): 133-137. Режим доступа: http://www.angiolsurgery.org/magazine/2016/2/18.htm
- Цукурова Л.А., Тимченко Л.В., Головко E.H., Усачев А.А., Фе-дорченко А.Н., Порханов В.А. Успешное проведение экстренных оперативных вмешательств на брахиоцефальных артериях у двух пациентов в острейшем периоде ишемического инсульта. Нейрохирургия. 2013; (4): 70-72. Режим доступа: http://www.therjn.com/jour/article/view/65
- Гудкова B.B., Шанина T.B., Петрова E.A., Стаховская Л.В. Тран-зиторная ишемическая атака мультидисциплинарная проблема. Неврология, нейропсихиатрия, психосоматика. 2012; 4(3): 20-24. http://dx.doi.оrg/ DOI: 10.14412/2074-2711-2012-397
- Rathenborg L.K., Venermo M., Troëng T., Jensen L.P., Vikatmaa P., Wahlgren C., Ijäs P., Björck M., Kragsterman B. Editor's choice -Safety of carotid endarterectomy after intravenous thrombolysis for acute ischaemic stroke: a case-controlled multicentre registry study. Eur J. Vase Endovasc Surg. 2014; 48(6): 620-5. PMID: 25443523. http://dx.doi.оrg/ DOI: 10.1016/j.ejvs.2014.09.004
- Национальные рекомендации по ведению пациентов с заболеваниями брахиоцефальных артерий. Ангиология и сосудистая хирургия. 2013; 19(S2): 4-68. Режим доступа: http://www.angiolsurgery.оrg/recommendations/2013/recommendations_ brachiocephalic.pdf


