Каррагинаны как новые субстанции для лекарственных средств с радиопротекторным действием
Автор: Подкорытова Елена Алексеевна, Хожаенко Елена Владимировна, Ковалев Валерий Владимирович
Рубрика: Коррекция экологического неблагополучия
Статья в выпуске: 5-2 т.16, 2014 года.
Бесплатный доступ
Каррагинаны - природные полисахариды, получаемые из красных водорослей. Одним из их важнейших биологических свойств является способность связывать ионы металлов. Это свойство позволяет рассматривать каррагинаны как основу для разработки лекарственных препаратов с радиопротекторным действием. Металлсвязывающая активность различных типов каррагинанов была изучена в системах, содержащих ионы стронция или церия. По результатам эксперимента установлено, что k- и i-каррагинаны эффективно связывают ионы стронция и церия, при этом наибольшая активность наблюдалась у i-каррагинана.
Каррагинаны, сорбция, радионуклиды, стронций, церий
Короткий адрес: https://sciup.org/148101814
IDR: 148101814 | УДК: 612.396.11:
Текст научной статьи Каррагинаны как новые субстанции для лекарственных средств с радиопротекторным действием
– ферроцианиды, бария сульфат, полисурьмин, цеолиты, комплексообразователи и другие соединения, многие из которых являются довольно токсичными веществами и не предназначены для длительного применения [3, 11, 13]. Это обстоятельство делает актуальным поиск новых безопасных и эффективных средств обеспечения фармакологической защиты человека от воздействия источников внутреннего облучения. В качестве таких перспективных средств защиты могут рассматриваться некоторые некрахмальные полисахариды, так как они не вызывают токсических и выраженных побочных эффектов и при этом обладают достаточной сорбционной емкостью в отношении вышеприведенных металлов [7, 8, 12, 15]. В нашем исследовании использовали полисахариды красных водорослей – каррагинаны. В химическом плане каррагинаны представляют собой сульфатированные галактаны, состоящие из повторяющихся дисахаридных звеньев D-галактозы и ее производных, соединенных регулярно чередующимися β-(1→4)- и α-(1→3)-гликозидными связями. Для каррагинанов характерно большое структурное разнообразие, обусловленное тем, что 4-О-замещенный моносахаридный остаток может быть остатком как галактозы, так и ее 3,6-ангидропроизводного, а гидроксильные группы могут быть сульфатированы [1]. Характерной особенностью каррагинанов является их способность образовывать комплексы с ионами некоторых металлов, при этом катионы металлов взаимодействуют с сульфатными группами соседних участков молекул каррагинана с образованием межмолекулярных «мостиков», за счет которых происходит форми- рование и стабилизация структуры каррагинанового геля [10]. Способность каррагинанов к образованию комплексов с металлами зависит, в первую очередь, от индивидуальных особенностей их структуры. Несмотря на многочисленные работы, посвященные взаимодействию каррагинанов с металлами и проведенные детальные исследования структуры образующихся комплексов, в литературе практически отсутствуют сведения о взаимодействии каррагинанов c радионуклидами [4, 9].
Цель работы: проведение сравнительной оценки связывающей способности разных типов каррагинанов по отношению к ионам стронция и церия.
Материалы и методы. В экспериментальной работе были использованы коммерческие образцы ι-каррагинана (CAS номер 79062 07-1, тип II, Sigma), κ-каррагинана (CAS номер 11114-20-8, тип II, Aldrich), λ-каррагинана (CAS номер 9064-57-7 , тип I, Aldrich). Эти каррагинаны являются линейными полисахаридами, построенными из чередующихся остатков 1,3-связанной α -D-галактопиранозы и 1,4-связанной 3,6-ангидро-β-галактопиранозы и отличаются различным содержанием сульфатных групп. ι-каррагинан и κ-каррагинан относятся к желирующим типам, а λ-каррагинан желирующей способностью не обладает.Хлорид стронция (CAS номер 10476-85-4) и сульфат церия (CAS номер 13590-82-4) были произведены фирмой Aldrich.
Способность каррагинанов связывать ионы стронция и церия in vitro при разных значениях рН среды определялась по схеме, описанной нами ранее для пектинов [7]. Количество связавшихся с каррагинаном ионов металлов вычисляли по формуле:
Q=V(Ci-Cе)/M, где Q – количество ионов стронция или церия, связанных каррагинаном, мг/г; V – общий объем инкубационной смеси, л; Сi – начальная концентрация ионов металла в растворе, мг/л; Сe – равновесная концентрация ионов металла в растворе, мг/л; М – масса каррагинанов, г.
Для изучения кинетики связывания изотопов стронция и церия образцами каррагинанов в емкость, снабженную магнитной мешалкой, вносили 10 мл 0,1 М растворов хлорида стронция или сульфата церия и 10 мл 1,0 М ацетатного буфера со значением рН 4,0. При интенсивном перемешивании добавляли 100 мл 0,5% раствора ι-каррагинана, κ-каррагинана или λ-каррагинана и доводили объем смеси дистиллированной водой до 200 мл. Смесь инкубировали при перемешивании и через заданные промежутки времени отбирали из нее по 20 мл, в отобранной пробе определяли равновесную концентрацию церия или стронция по формуле представленной выше.
Результаты и обсуждение. Графики кинетики связывания каррагинана с ионами металла строили следующим образом: максимальную сорбционную емкость, зарегистрированную в ходе исследования, принимали за 100%, а количество связанных ионов стронция или церия в течение определенного времени инкубации выражали в процентах от максимальной сорбционной емкости. Кинетические кривые связывания стронция каррагинанами различных типов свидетельствуют, что для достижения сорбционного равновесия ι-каррагинану и κ-каррагинану требуется 90 мин и 120 мин соответственно (рис. 1).
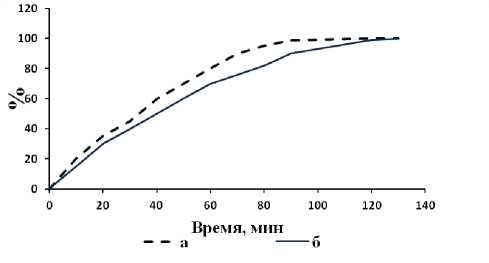
Рис. 1. Кинетика связывания ионов стронция каррагинанами при рН 4,0: а) ι-каррагинан, б) κ -каррагинан
Исследование кинетики сорбции ионов церия показало, что они взаимодействовали с каррагинанами достоверно быстрее, чем ионы стронция. Так, 50%-й уровень сорбции церия для ι -каррагинана, κ -каррагинана достигался через 17-20 мин, а максимальный – через 50-60 мин (рис. 2). Сорбционную активность у λ-каррагинана обнаружить не удалось, поэтому кривые связывания не были построены и показатели сорбционной активности не были рассчитаны.
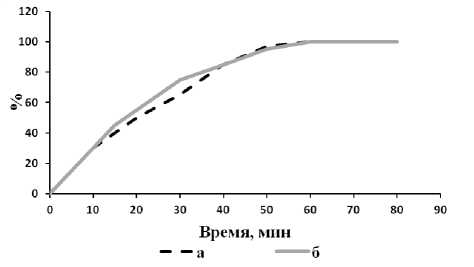
Рис. 2. Кинетика связывания ионов церия каррагинанами при рН 4,0: а) ι-каррагинан, б) κ -каррагинан
На основе экспериментальных данных по связыванию стабильных изотопов стронция и церия образцами каррагинанов были построены изотермы сорбционного равновесия (зависимость сорбции каррагинанами ионов металла от их равновесной концентрации). Форма полученных кривых позволила отнести их к классу изотерм Лэнгмюра. Следовательно, для определения коэффициентов сродства сорбентов к ионам стронция и церия, а также для нахождения максимальной сорбционной емкости исследуемых каррагинанов использовали сорбционную модель Лэнгмюра:
Q=Qmax×b×Ce/1+b×Ce, где Q – связывание стабильных изотопов, мг/г сухой массы каррагинанов; Qmax – максимальное связывание сорбата (церия или стронция) в данных условиях, мг/г каррагинанов; b – коэффициент сродства сорбента к сорбату, л/мг; Се – равновесная концентрация ионов металла в растворе, мг/л. Показатель Qmax является математическим отображением количества активных центров в структуре каррагинанов, которые могут взаимодействовать с молекулами сорбата. Коэффициент сродства (аффинитета) указывает на прочность возникающих связей и скорость образования комплекса сорбент-сорбат.
По результатам экспериментов с ι -каррагинаном не было обнаружено строгой зависимости его связывающей активности от рН среды. Максимум сорбции церия и стронция ι -каррагинаном был зарегистрирован при рН 4,0. При понижении рН до 2,0, а также при ее повышении до 6,0 связывающая активность снижалась незначительно, в целом, оставаясь на высоком уровне (табл. 1, 2). κ -каррагинан выделяется своей способностью активно сорбировать церий и стронций из растворов в диапазоне рН от 2,0 до 4,0, при этом при повышении рН до 6,0 его связывающая активность падала, в среднем, в 1,45 раза.
Таблица 1. Экспериментальные константы Лэнгмюра для связывания ионов стронция различными типами каррагинанов
|
i -каррагинан |
к -каррагинан |
|||||
|
pH 2,0 |
pH 4,0 |
pH 6,0 |
pH 2,0 |
pH 4,0 |
pH 6,0 |
|
|
Q max , мг/г |
40,9±0,8181 |
49,6±0,1489 |
46,5±0,2341 |
40,0±0,6280 |
50,0±0,8982 |
35,0±1,411 |
|
b, л/мг |
0,0263±0,0052 |
0,0633±0,0002 |
0,0548±0,0011 |
0,0172±0,0041 |
0,0430±0,0003 |
0,0074±0,0009 |
|
R2 |
0,995 |
0,999 |
0,996 |
0,998 |
0,997 |
0,988 |
Таким образом, при сорбции стабильных изотопов стронция и церия каррагинанами различных типов не наблюдается такой строгой зависимости от рН среды, как в случае с другими полисахаридами [7, 8]. Сорбционная активность каррагинанов снижается в ряду ι-каррагинан > κ-каррагинан > λ-каррагинан. Более высокие сорбционные характеристики ι-каррагинана в сравнении с κ-каррагинаном позволяют сделать предположение, что с увеличением количества сульфатных групп в молекуле каррагинанов возрастает их сорбционная активность. В то же время содержащий максимальное количество сульфатных групп λ-каррагинан не обладает связывающей активностью. То есть, можно сделать вывод, что образовывать прочные связи с ионами церия и стронция могут только каррагинаны, содержащие ангидрогалактозные звенья и способные в присутствии металлов формировать упорядоченную структуру геля с оптимальным пространственным размещением сульфатных и гидроксильных групп.
Таблица 2. Экспериментальные константы Лэнгмюра для связывания ионов церия различными типами каррагинанов
|
i -каррагинан |
к -каррагинан |
|||||
|
pH 2,0 |
pH 4,0 |
pH 6,0 |
pH 2,0 |
pH 4,0 |
pH 6,0 |
|
|
Q max , мг/г |
107,5±0,7527 |
128,2±0,7692 |
126,5±0,6329 |
90,9±0,5454 |
92,1±0,7272 |
62,5±1,411 |
|
b, л/мг |
0,0848±0,0059 |
0,5591±0,0033 |
0,0320±0,0016 |
0,0152±0,0060 |
0,0301±0,0023 |
0,0513±0,0009 |
|
R2 |
0,999 |
0,997 |
0,999 |
0,998 |
0,994 |
0,996 |
При исследовании влияния рН среды на активность каррагинанов было обнаружено, что ι-каррагинан активно связывает ионы церия и стронция во всем исследованном диапазоне рН среды. Снижение связывающей активности κ-каррагинана при сдвиге рН в щелочную сторону в данном эксперименте труднообъяснимо, особенно принимая во внимание высокую сорбционную активность ι-карраги-нана при тех же условиях и учитывая, что оба каррагинана образуют схожие гелевые структуры. Вместе с тем устойчивость комплексов церия и стронция с ι- и κ-каррагинанами при низких значениях рН может быть связана со стабилизацией данных комплексов за счет дополнительных донорно-акцепторных связей катиона с кислородными атомами галактопираноз-ного кольца и молекулами воды, входящими в структуру комплексов. Наличие таких связей в структуре комплекса металл-карагинан ранее было установлено в работах других авторов, в частности, для кальциевой соли ι-каррагинана [6].
Выводы: ι - и κ -каррагинаны характеризуются способностью прочно и эффективно связывать ионы стронция и церия. Сорбционная активность каррагинанов зависит от их структуры, в том числе от наличия сульфатных групп. ι -каррагинан является наиболее эффективным сорбентом стронция и церия, и может быть использован при создании новых лекарственных препаратов для лечения и профилактики состояний, связанных с поражением радионуклидами.
Работа выполнена в рамках государственного задания Министерства образования и науки РФ, код проекта 413.
Список литературы Каррагинаны как новые субстанции для лекарственных средств с радиопротекторным действием
- Усов, А.И. Проблемы и достижения в структурном анализе сульфатированных полисахаридов красных водорослей//Химия растительного сырья. 2001. №.2. С. 7-20.
- Яблоков, А.В. Миф о безопасности и эффективности мирных подземных ядерных взрывов. -М.: ЦЭПР, 2003. 176 с.
- Ahmadpour, A. Effect of adsorbents and chemical treatments on the removal of strontium from aqueous solutions/A. Ahmadpour, M. Zabihi, M. Tahmasbi, T.R. Bastami//Journal of Hazardous Materials. 2010. Vol. 182 (1-3). P. 552-556.
- Cuppo, F. Non-equilibrium processes of interchain association induced by Cs+ions in κ-carrageenan aqueous solutions/F. Cuppo, H. Reynaers, S. Paoletti et al.//International Journal of Biological Macromolecules. 2004. Vol. 34 (1-2). P. 43-47.
- Imanaka, T. Width and center-axis location of the radioactive plume that passed over Dolon and nearby villages on the occasion of the first USSR A-bomb test in 1949/T. Imanaka, S. Fukutani, M. Yamamoto et al.//Journal of Radiation Research. 2005. Vol. 46 (4). P. 395-399.
- Kara, S. Monovalent and divalent cation effects on phase transitions of i-carrageenan/S. Kara, E. Arda, O. Pekcan//Journal of Bioactive and Compatible Polymers. 2007. Vol. 22 (1). P. 42-61.
- Khotimchenko, M.Y. Cerium binding activity of different pectin compounds in aqueous solutions/M.Y. Khotimchenko, E.A. Kolenchenko, Y.S. Khotimchenko et al.//Colloids and Surfaces B: Biointerfaces. 2010. Vol. 77 (1). P. 104-110.
- Khotimchenko, M.Y. Removal of cesium from aqueous solutions by sodium and calcium alginates/M.Y. Khotimchenko, E.A. Podkorytova, V.V. Kovalev et al.//Journal of Environmental Science and Technology. 2014. Vol. 7 (1). P. 30-43.
- Khotimchenko, Y.S. Carrageenans as a new source of drugs with metal binding properties/Y.S. Khotimchenko, E.V. Khozhaenko, M.Y. Khotimchenko et al.//Marine Drugs. 2010. Vol. 8 (4). P. 1106-1121.
- Lázaro, N. Heavy metal biosorption by gellan gum gel beads/N. Lazaro, A.L. Sevilla, S. Morales, A.M. Marqués//Water research. 2003. Vol. 37 (9). P. 2118-2126.
- Manos, M.J. Layered metal sulfides: exceptionally selective agents for radioactive strontium removal/M.J. Manos, N. Ding, M.G. Kanatzidis//Proceedings of the National Academy of Sciences of the USA. 2008. Vol. 105 (10). P. 3696-3699.
- Nesterenko, V.B. Reducing the 137Cs-load in the organism of “Chernobyl” children with apple-pectin/V.B. Nesterenko, A.V. Nesterenko, V.I. Babenko et al.//Swiss Medical Weekly. 2004. Vol. 134 (1-2). P. 24-27.
- Quinn, K.A. Sorption of yttrium and rare earth elements by amorphous ferric hydroxide: influence of temperature/K.A. Quinn, R.H. Byrne, J. Schijf//Environmental Science and Technology. 2007. Vol. 41 (2). P. 541-546.
- Sakaguchi, A. Radiological situation in the vicinity of Semipalatinsk nuclear test site: Dolon, Mostik, Cheremushka and Budene settlements/A. Sakaguchi, M. Yamamoto, M. Hoshi et al.//Journal of Radiation Research. 2006. Vol. 47 (А). P. A101-A116.
- Wang, M. Adsorption and desorption of Sr(II) ions in the gels based on polysaccharide derivates/M. Wang, L. Xu, J. Peng et al.//Journal of Hazardous Materials. 2009. Vol. 171 (1-3). P. 820-826.


