Кинетические закономерности реакции гексахлорциклотрифосфазатриена с N-оксидом пиридина в смеси органических растворителей в присутствии воды
Автор: Вапиров Владимир Васильевич, Зайцев Дмитрий Олегович
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Физико-математические науки
Статья в выпуске: 6 (151), 2015 года.
Бесплатный доступ
В реакции гексахлорциклотрифосфазатриена (фосфазена) с N-оксидом пиридина в органическом растворителе образуется «ониевая» соль. «Ониевая» соль является промежуточным продуктом в реакции гидролиза фосфазена. Реакция между фосфазеном и N-оксидом пиридина характеризуется первым порядком по фосфазену и N-оксиду. Вода оказывает каталитическое действие на данную реакцию. Каталитическая роль воды заключается в сольватации уходящей группы, что способствует ее более легкому отщеплению.
Фосфазен, химическая кинетика, механизмы реакции
Короткий адрес: https://sciup.org/14750942
IDR: 14750942 | УДК: 547.16:547.823:544.43
Текст научной статьи Кинетические закономерности реакции гексахлорциклотрифосфазатриена с N-оксидом пиридина в смеси органических растворителей в присутствии воды
Циклический тример фосфонитрилхлорида – гексахлорциклотрифосфазатриен (фосфазен) (I) – является наиболее интересным, изучаемым и представляющим наибольшую практическую значимость соединением в ряду циклических фосфонитрилгалогенидов.
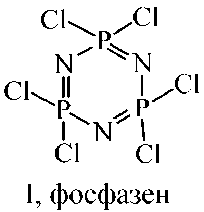
Это соединение может быть достаточно легко синтезировано, к тому же на его основе получен целый ряд производных, которые применяются в различных областях промышленности, физической электронике, медицине и т. д. [1], [3].
Интерес к фосфазену и в настоящее время достаточно широк, о чем свидетельствуют публикации [4], [5], [6], [8], [9], [10].
Преимущественными реакциями фосфазена являются реакции нуклеофильного замещения, которые в зависимости от условий протекают по механизмам SN1 или SN2. Установлено, что реакции замещения с участием высокоосновных нуклеофилов протекают в мягких условиях и практически с количественным выходом. Что же касается реакций фосфазена с низкоосновными нуклеофильными реагентами, то они возможны только в присутствии органических оснований, в качестве которых используются легкодоступные пиридин или триэти-ламин.
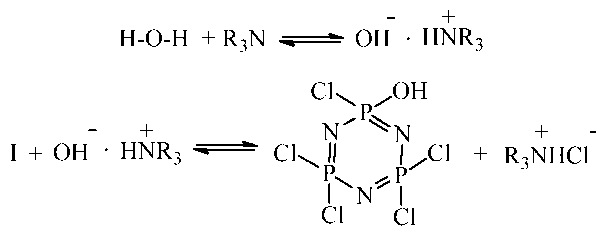
В [2] изучены кинетические закономерности реакций фенолиза и гидролиза фосфазена в присутствии триэтиламина и трибутиламина. Установлено, что роль органического основания в этих процессах заключается не только в связывании выделяющегося в ходе реакции хлороводорода, но и в увеличении органическим основанием нуклеофильных свойств субстрата за счет переноса протона. Например, гидролиз (I) в этих условиях протекает по схеме:
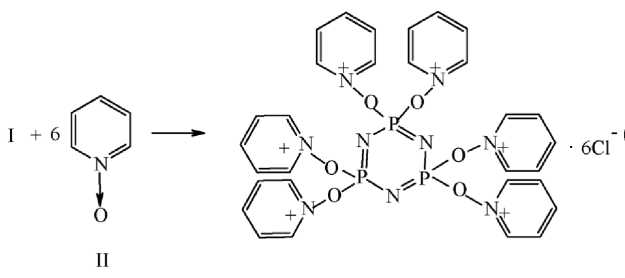
В реакции соединения (I) с пиридином, N-ме-тилимидазолом, диазобициклооктаном и рядом гетероароматических N-оксидов с достаточно высокими выходами выделяются соединения «ониевой» структуры [1], получение которых, на примере N-оксида пиридина, может быть представлено схемой:
Что же касается стерически затрудненного триэтиламина, то для него неизвестны продукты реакции с соединением (I).
Выделенные и охарактеризованные современными методами физико-химического анализа соединения «ониевой» структуры фосфазена с рядом перечисленных гетероциклических соединений различной основности и N-оксидами пиридинового ряда неоднократно постулировались в качестве промежуточных продуктов в реакциях нуклеофильного замещения галогена в соединении (I). Подтвердить участие этих солей в качестве промежуточных продуктов в реакциях нуклеофильного замещения в соединении (I) оказалось очень сложно, так как выделяемые соли практически нерастворимы в органических растворителях. Оказалось, что единственным растворителем, в котором они растворяются, является вода. Для установления возможного участия «ониевых» солей как промежуточных продуктов в процессе гидролиза нами проведен следующий эксперимент. В раствор фосфазена в ацетонитриле добавлялся раствор N-оксида в этом же растворителе. Динамику процесса оценивали по полосе поглощения N-оксида пиридина. При сливании указанных растворов во времени наблюдается уменьшение полосы поглощения N-оксида, при этом реакция проходит практически до конца. Наиболее вероятным процессом при этом с учетом выделяющихся солей можно считать процесс солеобразования. После дальнейшего добавления в ацетонитрильный раствор избытка воды наблюдается увеличение во времени полосы поглощения N-оксида пиридина. Этот процесс наиболее вероятно связан с гидролизом образующейся соли фосфазена с N-оксидом пиридина (3), в результате чего выделяется N-оксид, который как слабое основание практически не связывает выделяющуюся хлороводородную кислоту в водном растворе.
/=\
^р<0”кС7
N -
II |Х1С1 + Н20---* I + Ц+НС1 (3) С1—р
СГ \N<^ "Cl
ш
Полученные данные свидетельствуют о том, что в реакциях нуклеофильного замещения в фосфазене с участием N-оксида пиридина первоначально образуется соль, которая лежит на координате реакции гидролиза (I) в присутствии N-оксида пиридина.
Ранее в [7] были изучены кинетические закономерности реакций соединения (I) c некоторыми N-оксидами. Эти процессы нашли отражение и в диссертационной работе [1], однако в этих работах не изучалось влияние воды на исследуемый процесс.
Целью настоящего исследования явилось изучение количественных закономерностей реакции фосфазена с N-оксидом пиридина в органическом растворителе в присутствии воды.
Наличие шести реакционных центров в соединении (I) предусматривает возможность замещения шести атомов галогена. Для того чтобы упростить задачу кинетического исследования, нами изучался только процесс монозамещения. В этом случае реакция между фосфазеном и N-оксидом описывается уравнением:
I + II → III (4)
Процесс монозамещения в субстрате обеспечивался условиями проведения реакции, когда концентрация фосфазена на несколько порядков превышала концентрацию N-оксида.
Кинетику расходования N-оксида пиридина проводили в смеси CCl 4 -CH 3 CN (15 об.% CH 3 CN). Такое соотношение растворителей обеспечивало скорость реакции, которая могла легко фиксироваться спектрально. Концентрация воды была в избытке по отношению к N-оксиду, однако соизмерима с концентрацией фосфазена. В общем условия проведения реакции соответствовали следующему соотношению реагентов: [H2O] ≈ [I] > [II].
Контроль за ходом процесса осуществлялся спектрофотометрически по убыли полосы поглощения N-оксида пиридина в области 280 нм. В указанных условиях проведения эксперимента наблюдаемая константа скорости псевдопервого порядка (k набл , с–1) постоянна по ходу процесса (таблица), что указывает на первый порядок реакции по N-оксиду пиридина.
Наблюдаемая константа скорости реакции (с–1), рассчитанная по кинетической кривой «оптическая плотность – время»
|
Время, с |
Оптическая плотность |
k, с–1 |
|
210 |
0,938 |
1,248∙10–4 |
|
510 |
0,906 |
1,252∙10–4 |
|
810 |
0,878 |
1,210∙10–4 |
|
1110 |
0,848 |
1,225∙10–4 |
|
1410 |
0,821 |
1,215∙10–4 |
|
1710 |
0,79 |
1,249∙10–4 |
|
2010 |
0,768 |
1,218∙10–4 |
|
2310 |
0,745 |
1,250∙10–4 |
Зависимость k набл (с–1) от концентрации фосфазена (I) представлена на рис. 1.
Прямая в координатах k набл – [I] исходит из начала координат, что соответствует первому порядку реакции по фосфазену. Первый порядок по фосфазену подтверждается и значением тангенса угла наклона в координатах lg k набл – lg [I].
Было установлено, что наблюдаемая константа скорости псевдопервого порядка также зависит и от концентрации воды. Эта зависимость также
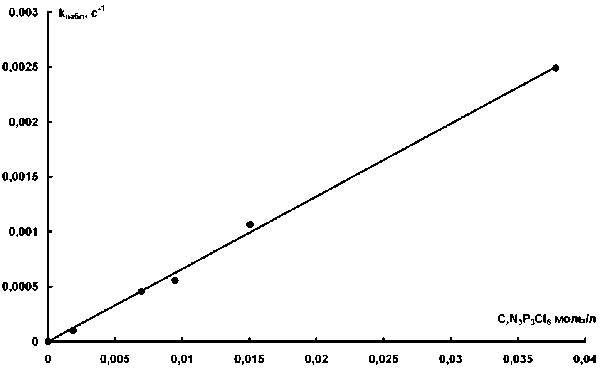
Рис. 1. Зависимость k набл (с–1) от концентрации фосфазена (I) в реакции с N-оксидом пиридина, r = 0,9987
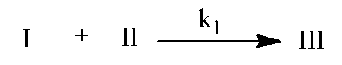
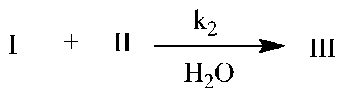
Скорость расходования N-оксида в некаталитической стадии (5) с учетом условий проведения реакции описывается уравнением:
d(II) dt
= k1[I] o [II] t .
Скорость каталитической стадии (7) определяется как:
^
линейна, однако прямая не исходит из начала координат, отсекая на ординате соответствующий отрезок (рис. 2).
dI) = к 1[Цо [П] , [Н20] о . dt
Общее расходование N-оксида в стадиях (5) и (7) равно:
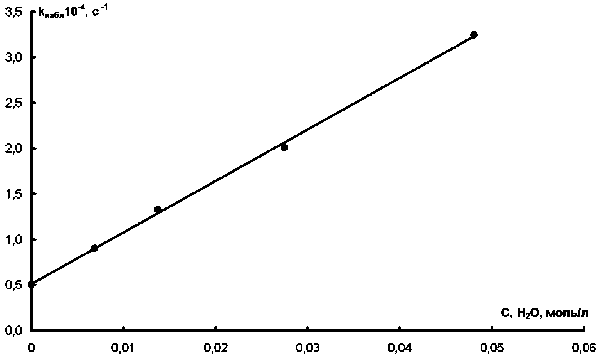
Рис. 2. Зависимость наблюдаемой константы (k набл ) от концентрации воды, r = 0,9992
При этом порядок по воде, определенный по зависимости lg kнабл – lg [H2O], меньше единицы и равен 0,72 ± 0,02.
Постоянство по ходу процесса наблюдаемой константы скорости реакции и в то же время ее зависимость от концентрации воды не могут быть связаны с возможным протеканием процесса гидролиза соли, образующейся на первой стадии (6):
.
Наблюдаемая константа скорости в этом случае определяется уравнением:
к набл = k i [I] o + k2[I] o [H20].
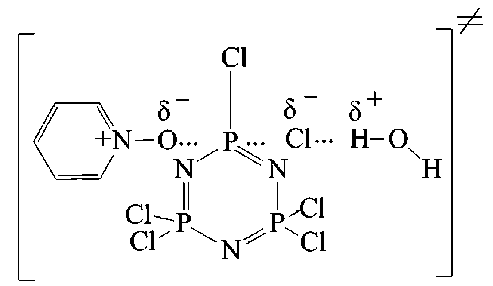
Представленные формально-кинетические закономерности получают объяснение в рамках предложенного механизма, в соответствии с которым наиболее вероятно предположить образование соли по механизму SN2 замещения. Каталитическая роль воды в процессе солеобразования может быть сведена к сольватации уходящей группы в переходном состоянии:
СГ \N^ XC1
Наиболее вероятно зависимость k наб. (c–1) от концентрации воды может быть объяснена протеканием реакции солеобразования по двум потокам – некаталитическому и при каталитическом участии воды:
Таким образом, на основании полученных экспериментальных данных можно считать, что «ониевая» соль фосфазена (I) с N-оксидом пиридина может выступать в роли интермедиата в процессах замещения галогена в фосфазене (I). Этот процесс может осуществляться при каталитическом действии воды. Роль воды может быть сведена к сольватации полярного переходного состояния и облегчению разрыва связи фосфора с уходящим галогеном.
* Статья подготовлена в рамках Программы стратегического развития ПетрГУ на 2012–2016 гг.
KINETIC CHARACTERISTICS OF HEXACHLOROCYCLOTRIPHOSPHAZATRIENE AND PYRIDINE N-OXIDE REACTION IN MIXED ORGANIC SOLVENTS IN PRESENCE OF WATER
Список литературы Кинетические закономерности реакции гексахлорциклотрифосфазатриена с N-оксидом пиридина в смеси органических растворителей в присутствии воды
- Вапиров В. В. Реакционная способность гексахлорциклотрифосфазатриена в реакциях нуклеофильного замещения: Автореф. дисс.. д-ра химич. наук. СПб.; Петрозаводск, 2000. 40 с.
- Вапиров В. В., Зайцев Д. О. Кинетические закономерности гидролиза гексахлорциклотрифосфазатриена в водном ацетонитриле в присутствии триэтиламина//Журнал общей химии. 2006. Т. 67. № 8. С. 1282-1285.
- Олкок Г. Фосфазотистые соединения. М.: Мир, 1976. 563 с.
- Терехов И. В., Филатов С. Н., Орлов А. И., Савельева А. В., Заузина Е. А. Синтез отвердителей фенолформальденидных смол на основе арилоксициклотрифосфазенов//Успехи в химии и химической технологии. 2013. Т. 27. № 3. С. 112-114.
- Терехов И. В., Чистяков Е. М., Филатов С. Н., Дерновая Е. С., Заузина Е. А. Синтез арилоксициклотрифосфазенов с амино-и гидроксогруппами//Успехи в химии и химической технологии. 2012. Т. 26. № 4. C. 106-109.
- Тупиков А. С., Чистяков Е. М., Киреев В. В. Синтез ß-дикетона на основе гекса-параметилкарбоксифеноксициклотрифосфазена//Успехи в химии и химической технологии. 2012. Т. 26. № 4. С. 114-117.
- Шумейко А. Е., Тицкий Г. Д., Вапиров В. В., Курченко Л. П. Исследование кинетики взаимодействия гексахлорциклотрифосфазатриена с 4-метилпиридин-Ы-оксидом//Журнал общей химии. 1987. Т. 57. № 5. С. 1051-1054.
- Allcock H. R., Hartle T. J., Taylor J. P., Sunderland N. J. Organic polymers with cyclophosphazene side groups: influence of the phosphazene on physical properties and thermolysis//Macromolecules. 2001. Vol. 34. № 12. P. 3896-3904.
- Huang Woei-Kae, Yeh Jen-Taut, Chen Kwei-Ju, Chen Kan-Nan. Flame retardation improvement of aqueous-based polyurethane with aziridinyl phosphazene curing system//J. Appl. Polym. Sci. 2001. Vol. 79. № 4. P. 662-673.
- Vaugeois Y., Mazzah A., De Jaeger R., Habimana J. Cyclic phosphonitrilic compounds bearing -N=PCl3 group as homogenous catalyst towards the silanol condensation//Phosph., Sulfur and Silicon and Relat. Elem. 2004. Vol. 179. № 9. P. 1819-1840.


