Кинетика образования твердых растворов в системе TiO2 (рутил) - Cr2O3
Бесплатный доступ
Рентгеновский и электронномикроскопический анализ применен для исследования фазообразования и кинетики взаимодействия в системе TiO2 -Сr2О3. Показано, что фазовый состав механических смесей из оксидов титана и хрома с содержанием хрома до 10 мас.% определяется временем и температурой термообработки. Уточнены границы растворимости Сr2О3 в ТO2, установлены кинетические параметры образования твердых растворов на основе рутила.
Короткий адрес: https://sciup.org/147158495
IDR: 147158495 | УДК: 540.145
Текст краткого сообщения Кинетика образования твердых растворов в системе TiO2 (рутил) - Cr2O3
Единственной термодинамически равновесной фазой системы ТЮ2 - Сг2О3 с содержанием ТЮ2 более 90 мас.% является твердый раствор Сг20з, в ТЮ2, представляющих интерес для технологии получения полупроводниковой керамики, огнеупорных изделий, а также как составная часть многокомпонентных систем. В системе ТЮ2 - Сг2О3 с содержанием ТЮ2 менее 90 мас.% образуются ряд соединений типа фаз Магнели состава Cr2Tin_2O2„_i. Оксид хрома образует в рутиле твердые растворы до содержания 6,5-7,4 мас.% Сг2О3 [1]. Однако, кинетика образования твердых растворов и механизм растворения неизоморфных оксидов в различных степенях окисления катионов, таких как Сг2О3 и ТЮ2 изучен не достаточно, что затрудняет построение конкретной физико-химической модели образования твердых растворов в подобных системах.
Цель данной работы - изучение кинетики и механизма образования твердых растворов в системе ТЮ2 - Сг2О3.
Экспериментальная часть
Исходные механические смеси получали путем тщательного смешения оксидов титана(1У) и хрома(Ш) квалификации «х.ч.» в агатовой ступке до получения порошков однородного цвета. Оксид титана (TV) (непигментный) рутильной модификации получали прокаливанием гидролизного оксида титана (ГДГ) при 1200 °C в течении 2-х часов. Технология получения непигментного оксида титана (IV) достаточно подробно изложена в [2-4]. Количественный и качественный фазовый анализ образцов проводили на дифрактрометре ДРОН-ЗМ с Кц-излучением кобальта. Параметры решетки рассчитывали методом наименьших квадратов. Точность определения межплоскостных расстояний не превышала 24 (Г3 А. Электронно-микроскопические исследования образцов до и после прокаливания проводили на электронном микроскопе ПЭМ-100 по стандартным методикам.
Смеси оксидов, с содержанием Сг2О3 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10 мас.% прокаливали в интервале температур 850-1200 °C в течении 1 часа. Кинетику твердофазного взаимодействия исследовали в изотермических условиях при 850, 900, 950, 1000, 1200 °C на образце состава 95 мас.% ТЮ2 и 5 мас.% Сг2О3. Колебания температуры в печи в зоне реакции не превышали 10 °C. Количественный рентгеновский фазовый анализ проводили методом внутреннего эталона. Ошибка при определении степени превращения продуктов твердофазных реакций не превышала ±5 %.
Обсуждение результатов
Смеси с содержанием Сг2О3 до 6 мас.% включительно, представлены только твердыми растворами оксида хрома(Ш) в оксиде титана(1У), которые образуются за 5 мин при 1200 °C, что согласуется с литературными данными [1, 5]. Исходные механические смеси имеют характерный светло-зеленый цвет, тогда как все прокаленные - темно-коричневые. Смеси с содержанием Сг2О3 более 7 мас.% представляют собой фазы Магнели. Параметры решетки твердого раствора состава 95 мас.% ТЮ2 и 5 мас.% Сг2О3 совпадают с параметрами решетки рутила, что связано невидимому, с близостью ионных радиусов Т14+и Сг3‘ (по Белову-Бокию).
Электронно-микроскопические исследования показали, что в исходных механических смесях частицы ТЮ2 и Сг2О3 определяются своей морфологией и микродифракцией. После нагревания
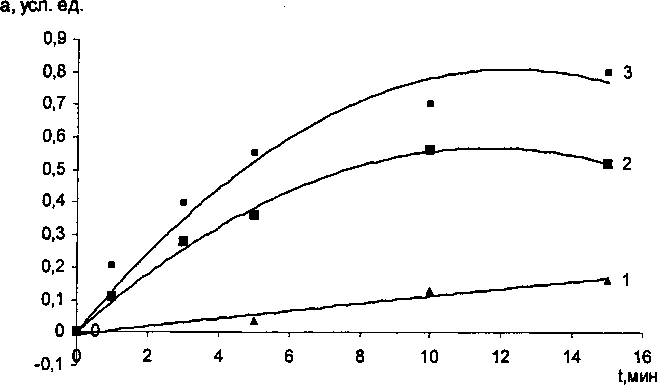
Кинетические кривые зависимости степени превращения от времени:
1 - 850 °C; 2 - 900 °C; 3 -1000 °C частицы Сг20з по морфологическим признакам и микродифракцией электронов не обнаруживаются, что указывает на образование твердого раствора на основе рутила. Отсутствие заметного смещения дифракционных колец после прохождения твердофазной реакции может быть связанно с тем, что дифракция электронов характеризуется очень малым углом. Поэтому основное внимание уделялось рентгеноструктурному анализу.
На рисунке представлены кинетические кривые зависимости степени превращения от времени. Значения констант скорости к, степени превращения а и коэффициенты корреляции R сведены в таблице.
Линеаризацию экспериментально наблюдаемых зависимостей степени превращения а от времени изотермической выдержки т при температурах 850, 900, 950 и 1000 °C в системе ТЮ2 -Сг20з, с оксидом титана (IV) рутильной модификации, проводили по уравнениям вида:
Да)=кт,
Да)=к In т, где а - степень превращения, т - время изотермической выдержки
Время выдержки отсчитывали с момента введения образца в зону реакции. Проверку на адекватность описания экспериментально наблюдаемых кинетических зависимостей проводили по величине коэффициента корреляции R. При анализе экспериментальных результатов использовали следующие кинетические уравнения:
-
1) уравнения, полученные на основании диффузионных моделей, лимитирующей стадии которых является объемная диффузия одного из компонентов (титана или хрома) через слой образующегося твердого раствора: уравнения Лидера 7i=(l-(l-a)1/3)2 = kt, уравнение Гистлинга 72=1-2а/3-(1-а)2/3 = кт, уравнение Журавлева 73 = ((1+а)1/3-1)2 = кт, уравнение анти-Гистлинга Ц = 1+2 а/3-(1+а)2/3 = кг,
-
2) уравнения реакций, лимитируемые поверхностными процессами на границе раздела фаз для цилиндрических частиц 15 =1-(1-а),/2 = кт;
-
3) уравнения, полученные на основании диффузионных моделей, лимитируемые объемной диффузией компонентов, находящихся в активном состоянии с высокой концентрацией неравноместных дефектов. В этом случае кроме уравнения Таммана 16 = 1-(1-а)1/3 = к In т, использовали уравнения 1т, 1% отличающиеся от соответствующих 72, 1\ только правой частью I = к In т [6].
Для набора данных при расчете среднестатистических величин зависимости а от времени изотермической выдержки т воспроизводили не менее 3 раз для каждой смеси.
Статистическая обработка кинетических данных показала, что коэффициент корреляции при аппроксимации экспериментально наблюдаемых кинетических зависимостей а от времени изотермической выдержки т уравнениями 7(a) существенно различен (см. таблицу). Наибольший ко-
Белая Е.А., Викторов В.В.
Кинетика образования твердых растворов в системе ТЮг (рутил) - Сг20з эффициент корреляции соответствует уравнению Яндера, поэтому можно предположить, что в системе протекает односторонняя диффузия ионов хрома через слой образующегося твердого раствора.
Кажущаяся энергия активации образования твердого раствора, найденная из кинетических данных, составила 91±5 кДж/моль, что совпадает с найденной ранее энергией активации в системе А120з-Сг20з , при односторонней диффузии ионов хрома, с образованием твердого раствора [7, 8]. Найденная величина значительно ниже энергии активации самодиффузии катионов С?+ в а-Сг20з (419 кДж/моль). Таким образом, проведенные кинетические исследования и их математическая обработка позволяют сделать вывод, что по всей вероятности, при нагревании смесей рутила и оксида хрома (Ш) происходит диффузия ионов хрома с поверхности в объем кристалликов рутила.
Значения констант скорости, степени превращения реакции взаимодействия оксидов Сг20з и ТЮ2 с массовым соотношением 5 и 95 % соответственно
|
т, мин |
a |
71 |
/2 |
74 |
75 |
76 |
h |
||
|
Смесь, прокаленная при 850 °C |
|||||||||
|
5 |
0,0369 |
0,0002 |
0,0002 |
0,2300 |
0,0494 |
0,0186 |
0,0125 |
0,0002 |
0,0002 |
|
10 |
0,1292 |
0,0020 |
0,0019 |
0,3458 |
0,1743 |
0,0669 |
0,0451 |
0,0019 |
0,0020 |
|
15 |
0,1600 |
0,0032 |
0,0031 |
0,3702 |
0,2164 |
0,0834 |
0,0565 |
0,0031 |
0,0032 |
|
30 |
0,1754 |
0,0039 |
0,0037 |
0,3811 |
0,2376 |
0,0919 |
0,0623 |
0,0037 |
0,0039 |
|
к |
0,0001 |
0,0001 |
0,0172 |
0,0099 |
0,0038 |
0,0194 |
0,0011 |
0,0011 |
|
|
R |
0,9298 |
0,9283 |
0,7633 |
0,8794 |
0,8815 |
0,8931 |
0,9095 |
0,9104 |
|
|
Смесь, прокаленная при 900 °C |
|||||||||
|
1 |
0,1711 |
0,0037 |
0,0035 |
0,3781 |
0,2317 |
0,8959 |
0,0607 |
0,0035 |
0,0036 |
|
3 |
0,2665 |
0,0096 |
0,009 |
0,4343 |
0,3643 |
0,1435 |
0,0982 |
0,0090 |
0,0096 |
|
5 |
0,4621 |
0,0349 |
0,0305 |
0,513 |
0,6467 |
0,2665 |
0,1867 |
0,0305 |
0,0348 |
|
10 |
0,5257 |
0,0485 |
0,0413 |
0,5328 |
0,7422 |
0,3112 |
0,2201 |
0,0413 |
0,0484 |
|
к |
0,0051 |
0,0044 |
0,0709 |
0,0887 |
0,0368 |
0,1006 |
0,0169 |
0,0196 |
|
|
R |
0,9638 |
0,9618 |
0,7311 |
0,9237 |
0,9322 |
0,9306 |
0,9472 |
0,9508 |
|
|
Смесь, прокаленная при 950 °C |
|||||||||
|
1 |
0,2692 |
0,0098 |
0,0092 |
0,4356 |
0,3682 |
0,1451 |
0,0992 |
0,0092 |
0,0098 |
|
3 |
0,2774 |
0,0105 |
0,0098 |
0,4397 |
0,3797 |
0,1499 |
0,1027 |
0,0098 |
0,0105 |
|
5 |
0,3590 |
0,0189 |
0,0172 |
0,4757 |
0,4958 |
0,1994 |
0,1377 |
0,0172 |
0,0189 |
|
10 |
0,5627 |
0,0581 |
0,0488 |
0,5434 |
0,7991 |
0,3387 |
0,2409 |
0,0487 |
0,0581 |
|
к |
0,0053 |
0,0045 |
0,0709 |
0,0887 |
0,0369 |
0,0977 |
0,0165 |
0,0193 |
|
|
R |
0,9685 |
0,9724 |
0,6911 |
0,9265 |
0,9403 |
0,8408 |
0,8143 |
0,8086 |
|
|
Смесь, прокаленная при 1000 °C |
|||||||||
|
1 |
0,36 |
0,0191 |
0,0173 |
0,0116 |
0,0125 |
0,2000 |
0,1382 |
0,0173 |
0,0191 |
|
3 |
0,40 |
0,0245 |
0,0219 |
0,0141 |
0,0152 |
0,2254 |
0,1565 |
0,0219 |
0,0245 |
|
5 |
0,55 |
0,0546 |
0,0461 |
0,0247 |
0,0273 |
0,3292 |
0,2336 |
0,0461 |
0,0546 |
|
10 |
0,70 |
0,1092 |
0,0851 |
0,0374 |
0,0422 |
0,4522 |
0,3305 |
0,0851 |
0,1092 |
|
15 |
0,80 |
0,1723 |
0,1246 |
0,0468 |
0,0536 |
0,5527 |
0,4152 |
0,1246 |
0,1723 |
|
к |
0,0112 |
0,0084 |
0,0035 |
0,0039 |
0,0426 |
0,1481 |
0,0385 |
0,0507 |
|
|
R |
0,9960 |
0,9962 |
0,9751 |
0,9793 |
0,9435 |
0,9347 |
0,9119 |
0,8974 |
|
Выводы
-
1. Исследовано образование твердых растворов в системе ТЮ2 (рутил) - Сг2О3. Уточнена граница растворимости Сг2О3 в рутиле, которая составляет порядка б мас.%.
-
2. Показано, что кинетика образования твердых растворов описывается уравнением Яндера, которое предполагает одностороннюю диффузию ионов хрома с поверхности через слой образующегося твердого раствора в объем кристалликов TiO2.
Химия
Работа выполнена при финансовой поддержке гранта Губернатора Челябинской области Ур. Чел. №04-03-960-72.
Список литературы Кинетика образования твердых растворов в системе TiO2 (рутил) - Cr2O3
- Бережной А.С. Многокомпонентные системы окислов. -Киев: Наукова думка, 1970. -С. 141-143.
- Беленький Е.Ф., Рискин И.В. Химия и технология пигментов. -Л.: Химия, 1974. -656 с.
- Хазин Л.Г. Двуокись титана. -Л.: Химия, 1970. -176 с.
- Горощенко Я.Г. Химия титана. -Киев: Наукова думка, 1970. -415 с.
- Gibb R.M., Anderson J.S. The system Ti02 -Cr2O3: Electron Microscopy of Solid Solutions and Cristallographic Shear Structures//Journal of Solid State Chemistry. -1972. -V. 4. -№ 3. -P. 379-390.
- Третьяков Ю.Д. Твердофазные реакции. -М.: Химия, 1978. -С. 164-183.
- Викторов В.В., Евдокимов И.В., Ковель М.С. Кинетика образования твердых растворов в системе А12O3-Сr2O3//Журнал физической химии. -1990. -Т. 64. -№ 7. -С. 1820-1824.
- Особенности образования твердых растворов (Crx Al1-x)2O3 при совместном прокаливании гидроксидов А1 и Сr/Н.С. Ковель, В.В. Викторов, И.В. Евдокимов, А.А. Фотиев//Изв. АН СССР. Неорганические материалы. -1989. -Т. 25. -№ 7. -С. 1160-1164.


