Кислотно-основные свойства поверхности гидрогелей оксигидроксидов железа (III), циркония (IV) и хрома (III)
Бесплатный доступ
Изучено влияние сорбированных анионов НРO42- и H2AsO4- на кислотно-основные свойства поверхности оксигидроксидов Fe(III), Cr(III) и Zr(IV) с рН осаждения 9. Кислотно-основные свойства поверхности характеризовали величиной рН точки нулевого заряда (рНТНЗ). рНТНЗ определяли потенциометрическим титрованием по методу Паркса. Установлено, что сорбция НРО42- -иона приводит к повышению рНтнз, а сорбция H2AsO4- - напротив, к значительному ее понижению. Нагревание в растворах NaCl и Na2SO4 воздействует на оксигидроксиды с сорбированными анионами слабее, чем просто на свежеосажденные гидрогели.
Короткий адрес: https://sciup.org/147158501
IDR: 147158501 | УДК: 541.183.57:546.3
Текст краткого сообщения Кислотно-основные свойства поверхности гидрогелей оксигидроксидов железа (III), циркония (IV) и хрома (III)
Эксперимент. Исходные гели готовили, как описано ранее [3, 4]. Использовали только одно значение pH осаждения - 9. Это значение ранее широко использовалось нами в сорбционных исследованиях и в то же время близко к необходимому для получения образцов с рНтнз, близким к истинному, т.е. не зависящему от концентрации электролита в растворе [3]. Для получения образ цов для титрования с сорбированным анионом проводили сорбцию фосфат (НРО42Д- и арсенат-(Н2А8О4") ионов, с последующей троекратной отмывкой геля от маточного раствора с помощью центрифуги. Величина сорбции как арсената, так и фосфата составляла ~1,1 ммоль/г геля. Полученные таким образом гидрогели репульпировали в воде и разбавляли в мерной колбе до 50 мл. Образцы либо сразу же титровали, либо предварительно подвергали старению в течение 18 часов при температуре 96 °C в 1М растворе NaCI или в 0,5М растворе Na2SO4 с последующей троекратной отмывкой от маточного раствора с помощью центрифуги (одинаково для всех образцов). Дополнительными опытами было установлено, что при старении десорбции анионов сорбата с поверхности гелей не происходит. Для этого в течение старения из системы отбирали пробы и анализировали на содержания фосфат- или арсенат-ионов.
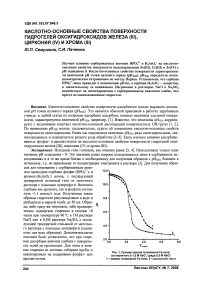
Рис. 1. Пример кривой титрования Ре-геля, состаренного в 1,0 М NaCI, среда 0,5 М NaCI: 1 - кривая титрования Ре-геля; 2 -«холостой» опыт
Точку нулевого заряда определяли по методу Паркса [6]. Для потенциометрического титрования использовали кварцевую ячейку полуоткрытого типа и иономер И-160М со стеклянным электродом ЭСЛ-43-07СР и вспомогательным электродом ЭСр-10103, погруженными в реакционную смесь. Для приготовления раствора фонового электролита брали соответствующие аликвоты раствора NaCl (4 М), чтобы в конечном объеме (200 мл) получить концентрацию 0,5 и 1,0 М. Гель и раствор электролита синхронно продували аргоном для удаления растворенного СО2 до установления постоянного значения pH. Затем суспензию вносили в раствор электролита. Для установления первоначального значения pH добавляли строго определенное и во всех случаях для данной серии образцов одинаковое количество раствора безкарбонатной щелочи (1 или 2 мл 0,1-0,25 N NaOH) и титровали суспензию соляной кислотой (0,1 N), с интервалом 0.1 мл/2 мин. Каждому эксперименту по титрованию образца геля соответствовал «холостой» опыт титрования раствора электролита в тех же условиях. Величину рНТНз находили графическим путем, как точку пересечения графиков зависимости рНсуСП vs Утитранта и рНзл vs Утич,анта. Полученные результаты представлены в табл. 1, 2; примеры кривых титрования - на рис. 1-4. Для сравнения приведены соответствующие данные для гидрогелей без сорбированных анионов.
Результаты. Из приведенных таблиц видно, что сорбция анионов и выдержка свежеосаж-денных гидрогелей в растворах хлорида и сульфата натрия приводит для каждого изученного гидрогеля к несколько отличным результатам.
Таблица 1 рНтнз гидрогелей с pH осаждения 9, фон 0,5 М NaCl
|
Условия получения геля |
Разновидность гидрогеля |
||
|
Ре-гель |
Zr-гель |
Сг-гель |
|
|
Без сорбированного аниона |
|||
|
Свежеосажденный |
9,00 |
8,10 |
9,05 |
|
Состарен в NaCl |
9,30 |
4,20 |
8,75 |
|
Состарен в Na2SO4 |
9,80 |
6,45 |
8,95 |
|
С сорбированным фосфат-ионом |
|||
|
Свежеосажденный |
9,68 |
8,85 |
10,25 |
|
Состарен в NaCl |
8,65 |
8,55 |
9,75 |
|
Состарен в Na2SO4 |
9,50 |
8,65 |
10,28 |
|
С сорбированным арсенат-ионом |
|||
|
Свежеосажденный |
6,85 |
5,35 |
8,15 |
|
Состарен в NaCl |
6,85 |
6,35 |
8,35 |
|
Состарен в Na2SO4 |
6,55 |
6,10 |
7,85 |
Таблица 2 рНтнз гидрогелей с pH осаждения 9, фон 1,0 М NaCl
|
Условия получения геля |
Разновидность гидрогеля |
|
|
Ре-гель |
Zr-гель |
|
|
Без сорбированного аниона |
||
|
Свежеосажденный |
8,65 |
9,00 |
|
Состарен в NaCl |
9,20 |
6,40 |
|
Состарен в Na2SO4 |
10,00 |
6,30 |
|
С сорбированным фосфат ионом |
||
|
Свежеосажденный |
9,05 |
8,40 |
|
Состарен в NaCl |
7,64 |
8,10 |
|
Состарен в Na2SO4 |
8,90 |
8,00 |
|
С сорбированным арсенат-ионом |
||
|
Свежеосажденный |
6,40 |
4,90 |
|
Состарен в NaCl |
8,68 |
5,80 |
|
Состарен в Na2SO4 |
8,39 |
5,70 |
Сорбция гидрофосфат-ионов приводит в случае всех трех гелей к существенному повышению рНтнз в среде 0,5 М NaCl и к относительно небольшим изменениям в среде 1,0 М NaCl (см.
Химия
табл. 1, 2), а сорбция дигидроарсенат-ионов, напротив, к существенному снижению рНтнз- Следует отметить, что сорбированные НРО42" и H2ASO4- анионы занимают около 60 % и 30 % имеющихся на поверхности гидрогелей монодентатных сорбционных центров, содержание которых
было оценено нами в 3,0-ьЗ,5 ммоль-центров/г [7], и
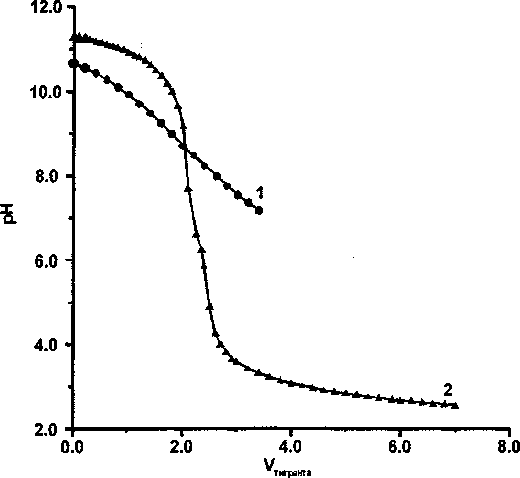
Рис. 2. Пример кривой титрования Ре-геля с сорбированным фосфат-ионом, состаренного в 1,0 М NaCI, среда 0.5 М NaCI:
1 - кривая титрования Ре-геля; 2 - «холостой» опыт
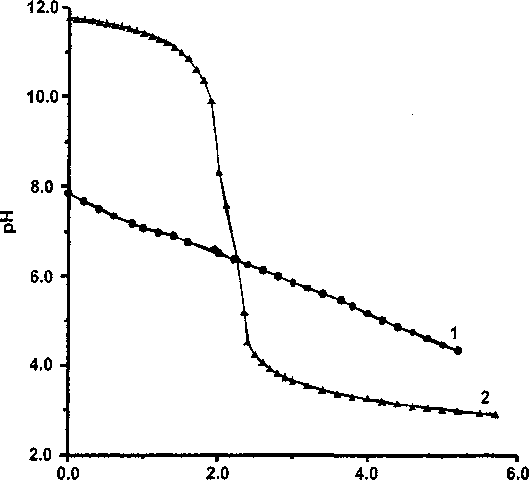
’титранта
Рис. 3. Пример кривой титрования Zr-геля с сорбированным арсенат-ионом, состаренного в 1,0 М NaCI, среда 0,5 М NaCI:
1 - кривая титрования Zr-геля; 2 - «холостой» опыт
каждый анион НРО42* занимает 2 центра, а H2AsO4~ - соответственно один центр. Итак, в результате сорбции фосфат-ионов свежеосажденными гелями их рНТнз возрастает на 0,7 - 1 ед. pH, т.е. область положительного заряда образцов расширяется, поскольку фосфат-ионы вносят дополнительный отрицательный заряд, что увеличивает способность поверхности сорбировать протоны. Несмотря на то, что фосфат- и арсенат-ионы являются очень близкими аналогами, они по-разному влияют на свойства поверхности. Вероятно, имеет большое значение то, что мы имели дело с дигидроарсенатом, но с гидрофосфатом. Дигидроарсенат вносит на поверхность значительно меньший отрицательный заряд, и сам менее склонен присоединять протоны, чем гидрофосфат, а возможно, даже склонен диссоциировать с отщеплением протонов, в результате чего сорбированный дигидроарсенат подкисляет поверхность.
Выдержка в среде электролита при нагревании приводит для гелей с сорбированным гидрофосфат-ионом к незначительному снижению рНтнз при обеих концентрациях фонового электролита. Для гелей с сорбированным дигидроар-сенат-ионом аналогичная выдержка, в подавляющем большинстве случаев, приводит к некоторому повышению рНтнз-
Ранее мы показали [8], что такая обработка для цирконогеля приводит к потере молекулы воды, образованию цирконила и полимерных форм, что, естественно, приводит к ослаблению основных и усилению кислотных свойств оксигидроксида. Для хромогеля, который при той же обработке сохраняет состав Сг(ОН)з [9], кислотно-основные свойства почти не изменяются. В дальнейшем у хромо- и феррогелей имеет место однотипное поведение, а поведение цирконогеля значительно отличается.
Обработка раствором хлорида натрия при нагревании приводит к более сильному снижению рНтнз феррогеля, чем обработка раствором сульфата натрия. Хромогель, как и в других случаях, реагирует на обработку слабо, но так же слабо реагирует на нее и цирконогель, его кислотно-основные свойства
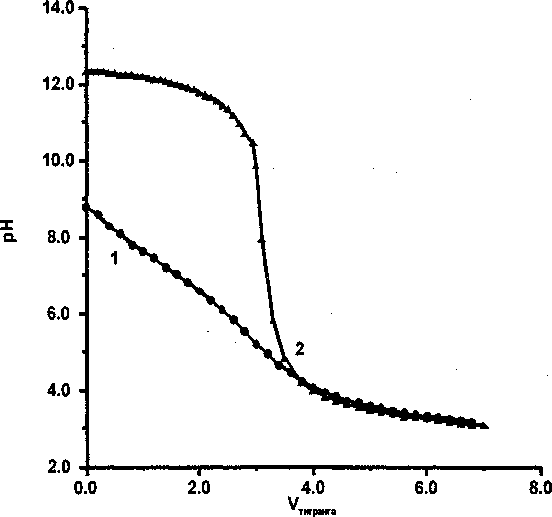
Рис. 4. Пример кривой титрования Zr-геля состаренного в 1,0 М NaCl, среда 0,5 М NaCl:
1 - кривая титрования Zr-гепя; 2 - «холостой» опыт
как бы стабилизируются. Возможно, имеет место образование слоя фосфата циркония на поверхности. Видно (см. рис. 1), что в результате старения кривая титрования феррогеля без сорбированного фосфата очень похожа на кривые титрования кристаллических оксигидроксидов, Действительно, ранее [9] было показано, что феррогель в этих условиях в значительной степени кристаллизуется с образованием гематита. Феррогель же с сорбированным фосфатом, состаренный в тех же условиях, дает кривую титрования, типичную для гелей (см. рис. 2).
У всех трех оксигидроксидов рНтнз за счет сорбции H2AsO4- образцы затем почти не реагируют на дальнейшую обработку электролитами при титрование в 0,5 М растворе NaCl. При титрование в 1,0 М NaCl, напротив, в результате обработки растворами NaCl и Na2SO4 рНтнз возрастает для феррогелей примерно на 2 ед. pH, а для цирко-ногелей - 0,8-0,9 ед. pH. Сорбированный дигидроарсенат как бы оказывает защитное действие на оксигидроксиды (см. табл. 1, 2).
На рис. 3 видно, что, хотя рНтнз цирконогеля в результате старения сильно понизился, но вид кривой титрования типичен для гелей, тогда как цирконогель без сорбированного арсената, состаренный таким же образом, имеет кривую титрования, близкую к кривым титрования кристаллических оксигидроксидов (рис. 4).
Следует заметить также, что старение всех описанных образцов в сульфатном электролите приводит к гораздо меньшим изменениям, чем старение в присутствие хлорид-ионов.
Выводы. Итак, сорбированные гидрофосфат-ионы несколько повышают рНтнз гидрогелей оксигидроксидов железа (III), хрома (III) и циркония (IV) (на 0,7-1,2 ед. pH в среде 0.5 М NaCl). Сорбированные дигидроарсенат-ионы, напротив, снижают рНтнз (на 2,0-4,0 ед. pH). И те и другие сорбированные анионы делают величины рНтнз более стабильными по отношению к концентрации электролита и старению в растворе электролита при нагревании.
Список литературы Кислотно-основные свойства поверхности гидрогелей оксигидроксидов железа (III), циркония (IV) и хрома (III)
- Hiemstra Т., van Riemsdijk W.H.//J. Colloid and Interface Sci. -1996. -V. 179. -P. 488-508.
- Печенюк С.И.//Успехи химии. -1992. -Т. 61. -№ 4. -С. 711-733.
- Печенюк С.И.//Изв. АН. Серия хим. -1999. -№ 2. -С. 229.
- Печенюк С.И., Матвеенко С.И.//Изв. АН. Серия хим. -2000. -№ 8. -С. 1329-1332.
- Печенюк С.И. Сорбционно-гидролитическое осаждение платиновых металлов на поверхности неорганических сорбентов. -Л.: Наука, 1991. -246 с.
- Parks G.A., de Bryun P.L.//J. Phys. Chem. -1962. -V. 66. -P. 967.
- Печенюк С.И., Семушина Ю.П., Кузьмич Л.Ф.//Изв. АН. Серия хим. -2005. -№ 8. -С. 1736.
- Печенюк С.И., Кузьмич Л.Ф., Михайлова Н.Л.//Журн. неорган. химии. -2003. -Т. 48. -№9. -С. 1420-1425.
- Печенюк С.И., Кузьмич Л.Ф., Макарова Т.И., Михайлова Н.Л.//Журн. неорган. химии. -2003 -Т. 48. -№ 8. -С. 1255-1265.