Клеточные механизмы хронического нейровоспаления
Автор: Сергеева Татьяна Николаевна, Сергеев Валерий Георгиевич, Чучков Виктор Михайлович
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 4 т.22, 2014 года.
Бесплатный доступ
Нейровоспаление, которое рассматривается как ключевое звено патогенеза нейродегенеративных заболеваний, как правило, развивается задолго до гибели нейронов. Для выявления молекулярных и клеточных механизмов, обеспечивающих персистирование нейровоспаления, предшествующее нейродегенерации, мы исследовали отсроченные эффекты однократного введения бактериального эндотоксина (липополисахарида) в область черной субстанции мозга крыс. Через 8 недель, в области введения наблюдалось увеличение количества микроглиоцитов с высокой экспрессией MHC II, и астроцитов, интенсифицирующих экспрессию глиального фибриллярного кислого белка. Ярко выраженная сосудистая реакция сопровождалась индукцией синтеза в клетках стенки кровеносных сосудов фактора некроза опухоли-а, и миграцией лимфоцитов в паренхиму мозга. Полученные результаты обсуждаются с точки зрения системной организации сетевых взаимодействий между описанными клетками.
Нейровоспаление, нейродегенерация, микроглиоциты, астроциты, лимфоциты, перициты
Короткий адрес: https://sciup.org/143177009
IDR: 143177009
Текст научной статьи Клеточные механизмы хронического нейровоспаления
Введение. Нейровоспаление – ключевое звено патогенеза нейродегенеративных заболеваний [1, 2]. Ведущую роль в процессах нейровоспаления играют активированные микроглиоциты [3-7]. Секретируемые ими провоспалительные факторы, такие как цитокины (интерлейкин-1, фактор некроза опухоли-α), монооксид азота, простагландины, специфические протеазы и свободнорадикальные производные кислорода, [8,9] индуцируют окислительный стресс в нейронах, который ведет к их повреждению и гибели.
Экспериментальные и клинические наблюдения свидетельствуют о том, что манифестации многих нейродегенеративных заболеваний, предшествует длительный этап хронического нейровоспаления [10,11] Остается открытым вопрос о молекулярных и клеточных механизмах, обеспечивающих персистирование нейровоспаления в нервной ткани в течение длительного времени. С учетом данных о том, что в процесс нейровоспаления могут быть вовлечены, помимо микроглиоцитов, и другие клетки: астроциты, эндотелио-циты и перициты кровеносных сосудов, а также лимфоциты, мигрирующие в нервную ткань [1214], логично полагать, что в основе хронического нейровоспаления лежат самоподдерживающиеся патофизиологические циклы, обусловленные взаимодействием этих клеток.
Для выявления паттерна активирующихся при хроническом нейровоспалении клеток, и идентификации возможных молекулярных механизмов, лежащих в основе такого рода активации, мы исследовали отсроченные эффекты однократного введения бактериального эндотоксина в область черной субстанции (ЧС) мозга крыс. Выбор этой области представляет интерес с точки зрения исследования патофизиологических процессов, лежащих в основе гибели дофаминергических нейронов и развития болезни Паркинсона.
Цель исследования - выяснить молекулярные и клеточные механизмы персистирующего нейровоспаления в головном мозге крыс.
Материал и методы исследования. Эксперименты проведены на 16 самцах крыс линии Вистар, весом 220 - 300 г., которые содержались в стандартных условиях Все экспериментальные манипуляции осуществлялись в соответствии с международными нормами этического обращения с животными. Крыс наркотизировали диэтиловым эфиром, освобождали поверхность черепа от мягких тканей, и при помощи бормашины высверливали отверстие по координатам: 5,2 мм каудальней брегмы и 2 мм латеральней осевого шва. При помощи стереотаксического аппарата вводили стеклянную микроканюлю с диаметром кончика 100 мкм на глубину 7,2 мм вентральней уровня твердой мозговой оболочки. Инъецировали 2 мкл липополисахарида Escherichia Coli (Sigma, USA) в концентрации 0,01мкг/мкл (8 животных) или 2 мкл стерильного физиологического раствора (8 животных). Через 8 недель животных наркотизировали диэтиловым эфиром, перфузировали через восходящую аорту физиологическим раствором на фосфатном буфере, затем 4% парафармальдегидом, приготовленном на забуференном физиологическом растворе (рН 7,2-7,4). Извлекали мозг, переносили на сутки в 25% раствор сахарозы и замараживали на сухом льду. При помощи криотома (Shandon Cryotom E; Eng) получали серийные срезы мозга толщиной 14 мкм и монтировали их на предметных стеклах Superfrost Plus (Fisher Scientific, USA).
О провоспалительных реакциях нервной ткани судили по результатам рутинного окрашивания срезов крезиловым фиолетовым и иммуногистохимического окрашивания с использованием первичных антител к тирозингидроксилазе (мышинные IgG, 1:2000; SantaCruz), молекулам главного комплекса гистосовместимости второго класса (мышиные IgG, 1:1000; Abcam), глиальному фибриллярному кислому белку (мышиные IgG, 1:1000; SantaCruz), кластеру дифференцировки лимфоцитов (мышиные IgG, 1:1000; Abcam), транскрипционному фактору FoxP3 (мышиные IgG, 1:1000; Abcam), фактору некроза опухоли - α (мышиные IgG, 1:1000; Abcam). Подсчет количества меченых клеток в ЧС производили при помощи флуоресцентного микроскопа Nikon Eclipse E200, совмещенного с цифровой камерой MicroPublisher 3,0 (USA), и компьютерной программы ImagePro Insight 8.0 (Media Сybernetics, USA). Результаты исследований проверяли на нормальность распределения значений с помощью W-теста Шапиро-Вилкоксона. Сравнение выборок проводили с помощью t- критерия Стьюдента. Различия считали достоверными при уровне статистической значимости P < 0,05. Результаты представляли, как M±m (среднее ± стандартное отклонение). Статистический анализ проводили в компьютерной программе Statistiсa 10.0.
Результаты исследования и их обсуждение. Через 8 недель после однократной инъекции ЛПС в область ЧС мы не обнаруживали в ней па- дения количества дофаминергических нейронов, но наблюдали целый ряд морфофункциональных изменений, свидетельствующих о наличии нейровоспалительного процесса. На срезах, окрашенных крезиловым фиолетовым, область введения ЛПС отличалась выраженной сосудистой реакцией (рис.1) и цитозом, наблюдаемым как в ретикулярной (ЧСр), так и компактной (ЧСк) части черной субстанции. Кровеносные сосуды имели увеличенный диаметр; в просвете сосудов и в непосредственной близости от них локализовались в большом количестве небольшие клетки с округлым ядром и узким ободком цитоплазмы, фенотип которых был схож с лимфоцитарным.
Иммуногистохимическое исследование срезов с использованием антител против молекул МНС II продемонстрировало увеличение в ЧС количества микроглиоцитов, интенсивно экспрессирующих этот маркер (+178,2±24,2%), относительно животных, которым в ЧС вводился стерильный физраствор. Введение ЛПС приводило также к значительному увеличению количества клеток, интенсивно экспрессирующих глиальный фибриллярный кислый белок (+255,2±43,2%), что свидетельствовало о реактивном астроглиозе, сохраняющемся в нервной ткани через 8 недель после однократной инъекции бактериального эндотоксина.
В клетках стенки кровеносных сосудов и периваскулярной области ЧС экспериментальных животных выявлялись клетки, интенсивно синтезирующие фактор некроза опухоли (ФНО-α). Иммунореактивные клетки в стенке сосудов имели вытянутую форму с отростками, преимущественно ориентированными по окружности сосуда. Такая форма и тот факт, что они не контактировали с внутренним просветом сосуда, позволили предположить, что данные клетки могли быть перицитами. Известно, что перициты в ответ на инфицирование, стимуляцию ЛПС и цитокинами способны синтезировать хемокины и провоспалительные цитокины, в том числе ФНО-α [15, 16].
Особенно интересным представляется обнаружение вокруг сосудов клеток с высокой экспрессией ФНО-α, фенотип которых был схож с микроглиоцитарным. Как известно, активированные микроглиоциты, способны синтезировать наряду с другими провоспалительными цитокинами и ФНО-α [17]. Расположение в непосредственной близости друг от друга вышеописанных клеток позволяет говорить о наличии взаимных стимулирующих влияний, опосредуемых прово-спалительными цитокинами.
Сосудистая реакция, индукция синтеза ФНО-α клетками стенки кровеносных сосудов, и значительное усиление интенсивности свечения иммунореактивного глиального фибриллярного
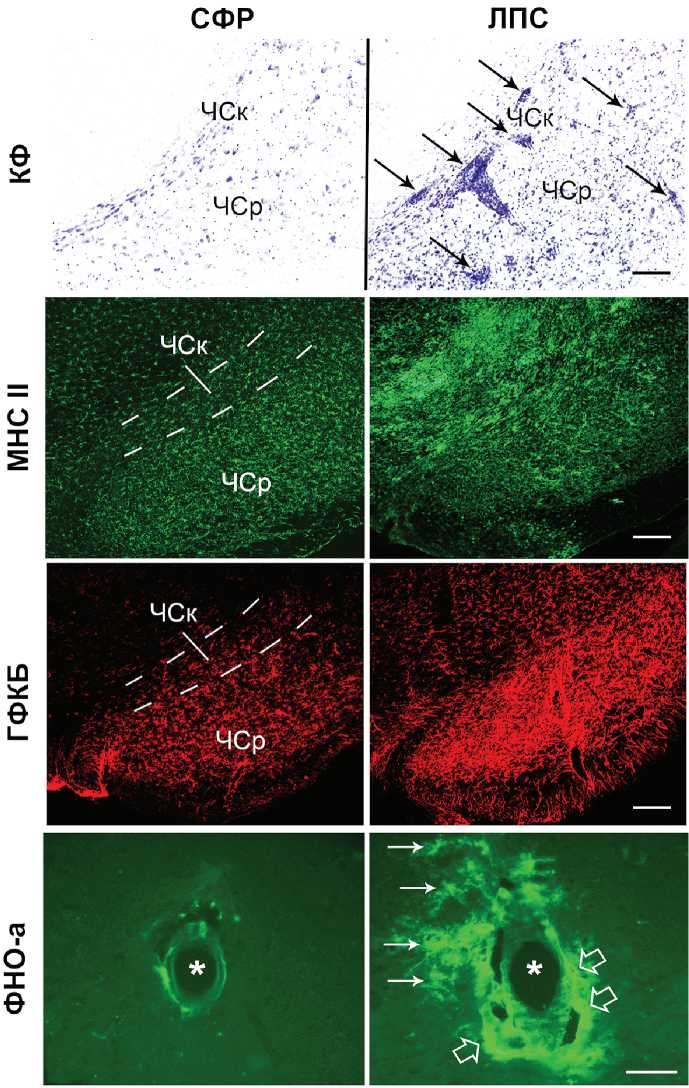
Рис. 1. Морфофункциональные изменения черной субстанции головного мозга крыс через 8 недель после введения в нее стерильного физиологического раствора (СФР) и липополисахарида (ЛПС). На срезах, окрашенных крезиловым фиолетовым (КФ), стрелками выделены расширенные сосуды, содержащие большое количество клеток с лимфоцитарным фенотипом. Иммуногистохимическое мечение свидетельствует об увеличении количества и интенсивности экспрессии иммунопозитив-ного сигнала в клетах, иммунореактивных к молекулам главного комплекса гистосовместимости (МНС II) и глиальному фибриллярному кислому белку (ГФКБ) после введения ЛПС. Эндотоксин индуцирует синтез фактора некроза опухоли-α (ФНО-α) в клетках микроглиоцитарного (тонкие стрелки) и перицитарного (контурные крупные стрелки) фенотипа. Обозначения: ЧСк – компактная часть черной субстанции; ЧСр – ретикулярная часть черной субстанции; звездочки – просвет кровеносных сосудов. Длина линии для КФ = 200 мкм; для МНС II и ГФКБ = 220 мкм; для ФНО-α = 100 мкм.
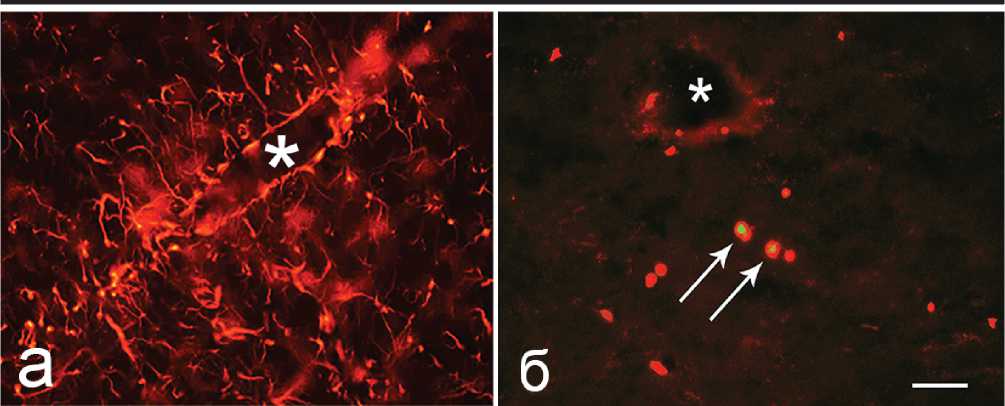
Рис. 2. Экспрессия иммунореактивного глиального фибриллярного кислого белка в астроцитарных отростках, контактирующих с кровеносными сосудами (а), и двойное иммуногистохимическое мечение клеток, экспрессирующих лимфоцитарный маркер CD3 (красное окрашивание) и FoxP3 (зеленое окрашивание) в черной субстанции через 8 недель после введения ЛПС. Стрелками обозначены клетки с двойной меткой. звездочками - просветы сосудов. Длина линии = 100 мкм.
кислого белка в отростках астроглиоцитов, образующих своеобразную муфту вокруг сосудов (рис. 2а), позволило предположить, что в описываемых экспериментальных условиях повышается проницаемость гематоэнцефалического барьера. В пользу этого свидетельствовало наличие клеток, экспрессирующих лимфоцитарный маркер (CD3) не только в просвете сосудов, но и паренхиме нервной ткани (Рис. 2б). Ранее исследователями было показано, что микроглиальная активация в повреждаемых областях мозга ведет к локальному повышению пропускной способности ГЭБ и инфильтрации в эти области лимфоцитов [18]. Недавние исследования показали, что, в свою очередь, инфильтрирующие нервную ткань T-лимфоциты оказывают стимулирующее воздействие на микроглиоциты, усиливая нейровоспаление и нейродегенерацию [19].
Вместе с тем, двойное иммуногистохимическое мечение позволило нам выявить в ядрах части лимфоцитов, мигрировавших в нервную ткань, транскрипционный фактор FoxP3 (Рис.2б), являющийся маркером регуляторной популяции лимфоцитов (Трег), активность которых, как свидетельствуют данные литературы, направлена на ингибирование воспалительного процесса. Ранее было показано, что Трег способны мигрировать в область повреждения и через прямое взаимодействие с локальной глией, снижать нейровоспаление и, таким образом, оказывать нейропротекцию. В частности, Трег могут супрессировать опосредованное микроглиоцитами нейровоспаление посредством снижения производства в них ре- активных форм кислорода и активности NF-κB, а также индуцировать Fas-FasL-опосредованный апоптоз активированных микроглиоцитов [20].
Таким образом, полученные результаты позволяют сделать вывод о том, что однократное введение ЛПС в ЧС, индуцирует в этой области персистирующее нейровоспаление, в которое вовлекаются перициты, микроглиоциты, астроциты и, мигрирующие в нервную ткань лимфоциты. Наличие описанных в литературе прямых межклеточных контактов и дистантной паракринной регуляции между ними, позволяет рассматривать совокупность клеток, участвующих в реакциях на действие повреждающего фактора как функциональную систему (которую мы предлагаем обозначить как нейроглиоваскулярная единица). Активность такой микросистемы изначально направлена на обеспечение защиты нейронов в условиях угрозы их повреждения и гибели. Однако наличие большого количества петель обратной связи между элементами нейроглиоваскуляр-ной единицы (рис. 3) ведет к персистированию воспалительного процесса в ней, даже после однократной стимуляции. Такое провоспалителное состояние может служить предрасполагающим фактором для инициации гибели нейронов при дополнительном воздействии внешних повреждающих факторов. Становится очевидным, что поиск новых подходов к терапии нейродегенеративных заболеваний должен базироватся на рассмотрении в качестве терапевтической мишени не отдельных клеток, а интегральной нейроглиова-скулярной системы.
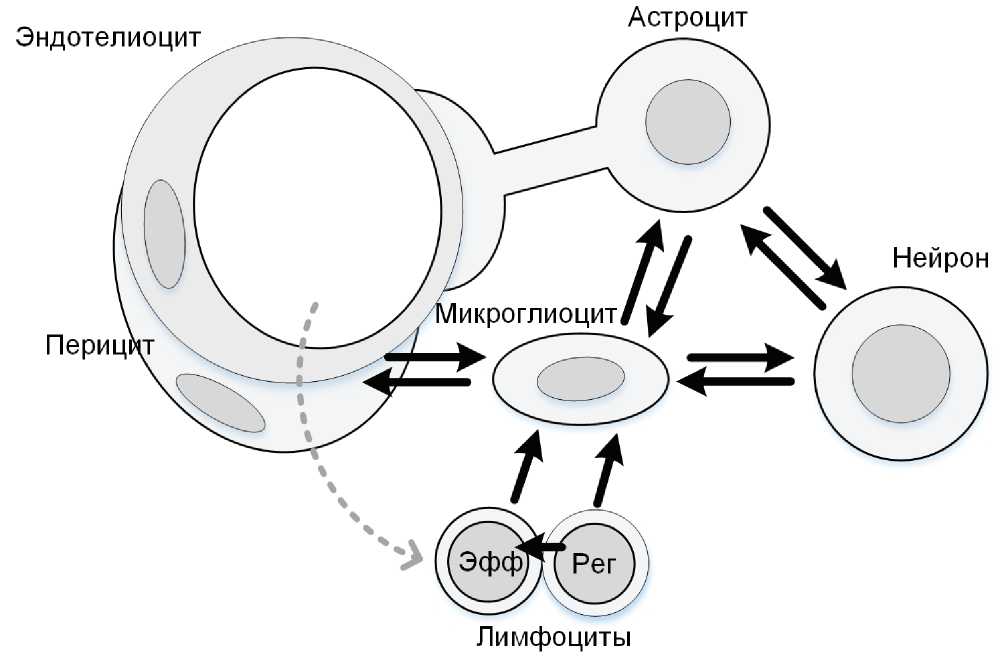
Рис. 3. Схема взаимодействий клеток, формирующих нейроглиоваскулярную единицу.
Заключение. Через 8 недель после однократного введения ЛПС в ЧС, в ней отсутствуют признаки выраженной нейродегенерации, но обнаруживаются признаки нейровоспаления: астро-цитоз и микроглиоцитоз, повышенная экспрессия этими клетками, соответственно, молекул МHC II и глиального фибриллярного кислого белка, индукция синтеза в стенке кровеносных сосудов фактора некроза опухоли - α, и интенсивная миграция в нервную ткань лимфоцитов. Хронический характер нейровоспаления, вызванный однократной инъекцией ЛПС, свидетельствует о наличии в изучаемой области мозга самоподдерживающе-гося патофизиологического механизма активации, основанного на взаимодействии этих клеток.
Список литературы Клеточные механизмы хронического нейровоспаления
- Vivekanantham S., Shah S., Dewji R., Dewji A., Khatri C., Ologunde R. Neuroinflamation in Parkinson's disease: role in neurodegeneration and tissue repair //Int J Neurosci. 2014. Vol.3. P. 1-17.
- Ellwardt E., Zipp F. Molecular mechanisms linking neuroinflammation and neurodegeneration in MS// Exp Neurol. 2014. Vol.262. P.8-17
- Orr C.F., Rowe D.B., Halliday G.M. An inflammatory review of Parkinson 's disease // Prog Neurobiol. 2002. Vol. 68, №5. Р.325-340.
- McGeer P.L., McGeer E.G. Glial reactions in Parkinson's disease // Mov Disord. 2008. Vol.23, №4. P. 474-483.
- Gao H.M., Hong J.S. Why neurodegenerative diseases are progressive: uncontrolled inflammation drives disease progression // Trends Immunol. 2008. Vol.29, №8. Р.357-365.
- Hirsch E.C., Hunot S. Neuroinflammation in Parkinson's disease: a target for neuroprotection? // Lancet Neurol. 2009. Vol. 8, №4. Р.382-397.
- Griffin W.S. Inflammation and neurodegenerative diseases // Am J Clin Nutr. 2006. Vol.83, №2. P. 470-474.
- Jha M.K., Suk K. Management of glia-mediated neuroinflammation and related patents // Recent Pat Inflamm Allergy Drug Discov. 2014. Vol.8, №2. P. 118-124.
- Suk K. Glial proteins and peptides: implications in neuroinflammation // Curr Protein Pept Sci. 2013. Vol.14, №1. P.2-10.
- Majde J.A. Neuroinflammation resulting from covert brain invasion by common viruses - a potential role in local and global neurodegeneration // Med Hypotheses. 2010. Vol.75,№2. P.204-213.
- Lyman M., Lloyd D.G., Ji X., Vizcaychipi M.P., Ma D. Neuroinflammation: the role and consequences // Neurosci Res. 2014. Vol.79. P. 1-12.
- Niranjan R. The role of inflammatory and oxidative stress mechanisms in the pathogenesis of Parkinson's disease: focus on astrocytes //Mol Neurobiol. 2014. Vol.49,№1. P.28-38.
- Monahan A.J., Warren M., Carvey P.M. Neuroinflammation and peripheral immune infiltration in Parkinson's disease: an autoimmune hypothesis // Cell Transplant. 2008. Vol.17,№4. P.363-372.
- Winkler E.A., Bell R.D., Zlokovic B.V. Central nervous system pericytes in health and disease // Nat Neurosci. 2011. Vol.11, P. 1398-1405.
- Alcendor D.J., Charest A.M., Zhu W.Q., Vigil H.E., Knobel S.M Infection and upregulation of proinflammatory cytokines in human brain vascular pericytes by human cytomegalovirus // J Neuroinflammation. 2012. Vol.9, P.95-104.
- Jansson D., Rustenhoven J., Feng S., Hurley D., Oldfield R.L., Bergin P.S., Mee E.W., Faull R.L., Dragunow M. A role for human brain pericytes in neuroinflammation // J Neuroinflammation. 2014. Vol.11, P.104-112.
- Gayle D.A., Ling Z., Tong C., Landers T., Lipton J.W., Carvey P.M. Lipopolysaccharide (LPS)-induced dopamine cell loss in culture: roles of tumor necrosis factor-alpha, interleukin-1beta, and nitric oxide // Brain Res Dev Brain Res. 2002. Vol.133, №1. P. 27-35.
- Racke M.K., Ratts R.B., Arredondo L., Perrin P.J., Lovett-Racke A. The role of costimulation in autoimmune demyelination//J Neuroimmunol. 2000. Vol.107, №2. P. 205-215.
- Brochard V., Combadiere B., Prigent A., Laouar Y., Perrin A., Beray-Berthat V., Bonduelle O., Alvarez-Fischer D., Callebert J., Launay J.M., Duyckaerts C., Flavell R.A., Hirsch E.C., Hunot S. Infiltration of CD4 lymphocytes into the brain contributes to neurodegeneration in a mouse model of Parkinson disease // J Clin Invest. 2009. Vol.119, P. 182-192.
- Reynolds A. D., Banerjee R., Liu J., Gendelman H.E., Mosley R.L. Neuroprotective activities of CD4 CD25 regulatory T cells in an animal model of Parkinson's disease// J Leukoc Biol. 2007. Vol. 82, №5. P. 1083-1094.


