Клиническая и электромиографическая характеристики нейромышечного статуса у недоношенных детей
Автор: Зарипова Юлия Рафаэльевна, Мейгал Александр Юрьевич
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Медицинские науки
Статья в выпуске: 8 (129) т.2, 2012 года.
Бесплатный доступ
При помощи клинических и электромиографических критериев охарактеризован нейромышечный статус у недоношенных детей в течение первых 6 недель жизни. В ходе клинического осмотра выявлена положительная динамика неврологического статуса. Установлено, что у недоношенных детей в первые 6 недель постнатального периода интерференционная электромиограмма (иЭМГ) имеет сходство с иЭМГ доношенного новорожденного первых дней жизни и характеризуется «упрощенной» временной структурой, низкой амплитудой и частотой, замедленной динамикой параметров ЭМГ.
Недоношенные дети, нейромышечный статус, электромиография, нелинейные и линейные параметры
Короткий адрес: https://sciup.org/14750289
IDR: 14750289 | УДК: 612.741.16:612.65+612.648
Текст научной статьи Клиническая и электромиографическая характеристики нейромышечного статуса у недоношенных детей
Достижения неонатальной медицины в последние десятилетия привели к значительному повышению выживаемости недоношенных детей с очень низкой (ОНМТ) и экстремально низкой массой тела (ЭНМТ). Кроме того, в связи с переходом РФ с 01.01.2012 на новые критерии живорождения, рекомендованные ВОЗ (срок гестации более 22 недель, масса тела ≥ 500 г), количество недоношенных детей будет неуклонно расти [4].
Выхаживание новорожденных, особенно не-доношеных детей, послужило стимулом для развития новых направлений в различных областях медицины (нутрициологии, фармакологии, дальнейшее совершенствование офтальмологии, кардиологии, хирургии, сурдологии и т. д.). С другой стороны, наряду с совершенствованием различных направлений неотложной неонатальной помощи активно развиваются мультидисципли-нарные службы, направленные на реабилитацию и абилитацию недоношенных детей и их семей.
Особенностями недоношенного ребенка являются: диффузная мышечная гипотония («поза лягушки»), быстрая «истощаемость» рефлексов, низкая мышечная масса, малоподвижность и лабильность температуры тела вследствие относительной пойкилотермности [5]. Однако основные показатели моторного развития новорожденного ребенка имеют существенные временные колебания. Очевидно, что имеет место большое различие между морфологическими и физиологическими показателями нервной системы у детей разного гестационного возраста.
Вследствие этого клиницист должен владеть не только различными методиками неврологического осмотра новорожденных детей [8], [10], но и иметь углубленные знания по эволюционной неврологии.
Развитие технологий выхаживания преждевременно родившихся детей позволяет повышать их выживание и улучшать качество жизни. Однако, несмотря на создание для недоношенного ребенка оптимальных условий выхаживания, полностью ограничить его от воздействия внешних факторов невозможно, и поэтому темпы его развития будут, вероятнее всего, быстрее по сравнению с его сверстниками, находящимися еще в утробе матери. Вследствие этого при постнатальной оценке психомоторного и физического развития ребенка, родившегося преждевременно, обычно учитывается не биологический возраст после рождения, как у доношенных детей, а его постконцептуальный (ПКВ), или постменструальный, возраст, то есть возраст с момента зачатия [7], [10], [11].
Настоящая работа посвящена оценке неврологического статуса недоношенного ребенка на различных сроках постконцептуального развития с позиции онтогенетической адаптации.
Из экспериментальных исследований H. F. R. Prechtl известно, что двигательная активность является первичной по отношению к другим формам неврологической деятельности плода и младенца [3], [6]. Таким образом, именно клиническая и нейрофизиологическая оценка моторной функции младенца явилась приоритетной в данном исследовании.
Цель работы – исследовать нейромышечный статус недоношенных детей с помощью схем неврологического осмотра недоношенного ребенка: схема качественной и количественной оценки недоношенных детей в соответствии с их ПКВ (Пальчик А. Б., 2008) и новых параметров иЭМГ.
МЕТОДИКА
В группу недоношенных вошли 10 детей обоего пола низкой степени риска с гестационным возрастом 31/32 недели, средняя масса при рождении составила 1650 ± 105 г, средняя оценка по шкале Апгар – 6/7 баллов. Под низкой степенью риска подразумевается отсутствие серьезных отклонений в соматическом и неврологическом статусе ребенка. Их обследование проводилось в динамике на 2, 4 и 6-й неделе жизни (фактически в 33, 35, 37 недель посконцептуального возраста, то есть количество недель беременности + возраст после рождения в неделях). Группу контроля составили 10 доношенных детей обоего пола, родившихся в срок (38/39 недель гестации) с нормальной оценкой по шкале Апгар (8/9 баллов), средней массой тела 3430 ± 90 г, обследованных также в возрасте 2, 4 и 6 недель после рождения. Общий дизайн исследования представлен на рис. 1.
Доношенные дети (n=10) Р/38-39
0 40 42 44

Недоношенные 0 2 4 6
Постнатальный возраст

0 33 35 37
Р/31-32
Постконцептуальный возраст
Рис. 1. Общий дизайн исследования и группы обследованных детей: Р – срок рождения (гестационный возраст в неделях), черные стрелки указывают соответствие постнатального возраста у доношенных и недоношенных детей;
0 – концепция. Пунктиром обозначен неисследованный возраст у недоношенных детей
Дети обследовались в ГБУЗ «Детская республиканская больница» (Петрозаводск), с информированного согласия мамы ребенка, с разрешения Этического комитета при Минздравсоцразвития РК.
Для объективизации полученных данных клинический неврологический осмотр проводился с помощью схем неврологического осмотра недоношенного ребенка в 33 и 35 недель ПКВ, предложенных А. Б. Пальчиком в 2008 году [3]. Общая сводная схема включает в себя 40 показателей: рефлекторный ответ на прикосновение, вздрагивание (страртл-реакция), генерализованные движения (generalized movements), изолированные движения руки и ноги, ретрофлексия голо- вы, поворот головы, нерегулярные дыхательные движения и т. д. [3]. Оценка детей в 33 недели ПКВ проводилась по 36 показателям, в 35 и 37 недель – по всем 40 показателям (дополнительно проводилась оценка шагового рефлекса, рефлекса опоры, рефлекса Бабинского, асимметричного шейно-тонического рефлекса). Каждому показателю присваивался балл от 0 до 1,0. Интерпретация теста проводилась по сумме баллов: максимальный показатель (100 %) – 35,5 балла в 33 недели ПКВ и 37,5 балла в 35, 37 недель ПКВ, оптимальный показатель (> 90 %) – ≥ 32 балла в 33 недели и ≥ 34 балла в 35, 37 недель ПКВ, нормальный показатель (> 75 %) – ≥ 26,5 балла в 33 недели и ≥ 28 балла в 35, 37 недель ПКВ. Доношенные дети обследовались неврологически по общепринятой в отечественной неонатологической практике схеме [6]. Исследование проводилось стандартизированно с учетом окружающих условий (температурный режим), состояния обследуемого ребенка, времени после кормления.
Для регистрации иЭМГ использовали поверхностные биполярные электроды фирмы «Нейрософт» (Иваново, Россия). Усиление миоэлектрического сигнала проводили с помощью электромиографов Нейро-МВП-4 и Нейро-МВП-Микро (ООО «Нейрософт», Иваново, Россия). Запись электромиограммы производили последовательно с 4 мышц верхних и нижних конечностей (трехглавой мышцы плеча и двуглавой мышцы плеча справа; икроножной мышцы и передней большеберцовой мышцы слева) на жесткий диск для последующей обработки. Частота опроса аналого-цифрового преобразователя (АЦП) – 20 КГц, полоса пропускания сигнала – 2–1000 Гц.
С учетом того что в практику электромиографии включаются нелинейные методы обработки сигнала [9], [12], [14], нами использованы традиционные линейные и новые нелинейные методы обработки иЭМГ.
Нелинейный анализ иЭМГ (FRACTAN 4.4 ©) включал в себя измерение таких параметров, как: 1) фрактальная размерность ( D ), 2) корреляционная размерность ( Dc ), 3) корреляционная энтропия ( K2 ).
В линейном анализе иЭМГ использованы средняя амплитуда (A, мкВ) и средняя частота (MNF, Гц) [2].
Исследование детей проводилось между кормлениями, во время спонтанной двигательной активности и со строгим соблюдением теплового режима. Дети в 33 недели ПКВ обследовались непосредственно в боксе в условиях кувеза (температура воздуха 32 ºС, влажность 40 %). Наложение электродов и регистрация спонтанной или вызванной двигательной активности производились через окошки и дверцы инкубатора. Температура тела контролировалась с помощью накожного датчика сервоконтроля.
В 35 и 37 недель гестационного возраста дети обследовались на пеленальном столике на фоне частичного распеленания, при температуре воздуха 24–25 ºС и низкой постоянной скорости движения воздуха (0,1 м/с). Доношенные новорожденные дети обследованы в кабинете электрофизиологической диагностики на кушетке после предварительного распеленания или раздевания (1–2-минутная адаптация ребенка в развернутом виде), при температуре воздуха 24–25 ºС и постоянной скорости движения воздуха (0.1 м/с).
Статистическая обработка проведена с использованием программы Excel 2003 и SPSS 12.0™ и Statgraphics Centurion 15.0. Для определения межгрупповых различий (возрастных групп и разных групп детей) использовали W-критерий (Крускалла – Уоллиса) и U-критерий (Манна – Уитни).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Клиническая оценка недоношенных детей по схеме неврологического осмотра выявила следующие особенности. В 33 недели ПКВ оптимальный показатель развития (≥ 32 баллов) был у 2 (20 %) детей, нормальный показатель развития (≥ 26,5 балла) – у 8 (80 %) (рис. 2). Очаговая симптоматика не отмечена. Асимметрия мышечного тонуса верхних конечностей отмечена у одного ребенка (10 %), нижних конечностей – у 3 (30 %) детей.
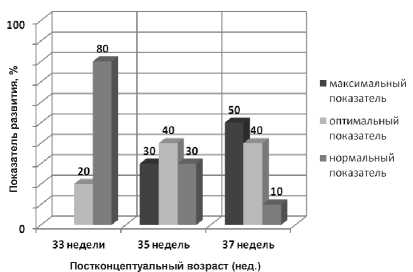
Рис. 2. Показатель неврологического развития у недоношенных детей в 33, 35, 37 недель постконцептуального развития: максимальный показатель – 100 % баллов, оптимальный – > 90 % баллов, нормальный – > 75 % баллов
В 35 недель ПКВ получен максимальный показатель развития у 3 (30 %) детей, оптимальный – у 4 (40 %), нормальный – у 3 (30 %) новорожденных (рис. 2). Очаговая симптоматика отсутствовала. Асимметрия мышечного тонуса в ногах была выявлена у одного ребенка (10 %).
В 37 недель ПКВ максимальный показатель развития был у 5 (50 %) детей, оптимальный – у 4 (40 %), нормальный – у одного (10 %) ребенка (рис. 2). Очаговая симптоматика отсутствовала. Асимметрия мышечного тонуса в ногах была выявлена у одного ребенка (10 %).
Неврологический статус в группе контроля не выявил существенных особенностей в динамике. Необходимо отметить, что в возрасте 2 не- дель у 3 детей (30 %) была отмечена асимметрия мышечного тонуса верхних конечностей, в 4 недели – у 2 (20 %).
Полученные клинические данные у недоношенных детей свидетельствуют об улучшении показателей неврологического развития по мере созревания ребенка. Подобная онтогенетическая динамика очевидна именно у недоношенных детей по сравнению со своими доношенными сверстниками, что свидетельствует о большей уязвимости данной категории детей и потребности в максимально адаптированных к материнской утробе условиях выхаживания постнатально.
Результаты поверхностной ЭМГ были следующими.
У недоношенных детей в возрасте 33 недель фрактальная размерность ( D ) иЭМГ варьировала от 1,5 до 1,64, корреляционная размерность ( Dc ) и корреляционная энтропия ( K2 ) – от 4,0 до 5,0 в мышцах как верхних, так и нижних конечностей (табл. 1). Эти значения были достоверно меньше по сравнению с аналогичными параметрами у доношенных детей, у которых D была в пределах от 1,74 до 1,85, а Dc и K2 достигали значений от 6,4 до 9,9.
Средняя частота спектра иЭМГ составила у 2-недельных недоношенных детей от 166 до 185 Гц, а максимальная средняя амплитуда – от 130 до 173 мкВ (табл. 2). У здоровых доношенных новорожденных данные показатели были значительно выше: от 184 до 238 Гц и от 181 до 230 мкВ (табл. 2).
У недоношенных детей в течение всех 4 недель обследования нелинейные параметры характеризовались медленным увеличением к 37-й неделе гестационного возраста (то есть к 6-й неделе жизни) (табл. 1). У доношенных детей подобной динамики не наблюдалось и значения всех нелинейных параметров оставались высокими на протяжении всего периода обследования (табл. 1).
У недоношенных детей в течение первых 6 недель жизни амплитуда и частота иЭМГ практически не изменялись, за исключением средней максимальной амплитуды в m. triceps brachii dextra , для которой было характерно повышение до 160–300 мкВ (табл. 2).
В нашем исследовании более низкие значения всех нелинейных параметров, которые были отмечены для недоношенных детей, характеризуют их электромиографический сигнал как «менее сложный», «более регулярный» и «более предсказуемый». Это означает, что сигнал иЭМГ генерируется меньшим количеством уравнений, то есть меньшим количеством нейронных ансамблей [5]. Вследствие недостаточной интерференции меньшего количества генераторов на иЭМГ возникают ритмы (кластеризация иЭМГ), которые визуально не всегда заметны. Появление этих ритмов и приводит к упрощению иЭМГ и ее большей предсказуемости.
Таблица 1
Показатели корреляционной размерности ( Dc ), корреляционной энтропии ( K2 ) и фрактальной размерности ( D ) в зависимости от гестационного и постнатального возраста в разных мышцах новорожденного ребенка
|
Мышца |
Недоношенные дети, постконцептуальный возраст (нед.) |
Доношенные дети, постнатальный возраст (нед.) |
||||
|
33 |
35 |
37 |
2 |
4 |
6 |
|
Корреляционная размерность (Dc)
|
m. triceps br. |
4,86 ± 0,51 |
5,12 ± 0,28 |
5,3 ± 0,28* |
6,45 ± 2,52 |
7,46 ± 2,12* |
6,42 ± 1,4 |
|
m. biceps br. |
4,42 ± 0,37 |
5,26 ± 0,56 |
5,27 ± 0,33* |
7,63 ± 1,82*** |
7,08 ± 1,13** |
6,26 ± 2,16** |
|
m. gastrocnemius |
5,09 ± 0,75 |
4,67 ± 0,18 |
4,84 ± 0,23 |
7,52 ± 0,64 |
7,51 ± 2,96*** |
8,37 ± 1,34* |
|
m.tibialis ant. |
4,96 ± 0,33 |
5,08 ± 0,33 |
4,93 ± 0,33* |
7,41 ± 1,86 |
7,03 ± 0,45*** |
7,4 ± 0,61* |
Корреляционная энтропия (К2)
|
m. triceps br. |
4,35 ± 0,21 |
4,26 ± 0,14 |
4,19 ± 0,27 |
9,96 ± 1,04*** |
9,49 ± 0,55 |
9,12 ± 0,19* |
|
m. biceps br. |
4,77 ± 0,33 |
4,5 ± 0,05 |
4,78 ± 1,00 |
9,81 ± 1,02*** |
7,01 ± 0,96 |
7,47 ± 1,65 |
|
m. gastrocnemius |
4,46 ± 0,16 |
4,82 ± 0,65* |
4,71 ± 0,49* |
9,99 ± 1,71*** |
9,03 ± 0,73*** |
9,67 ± 0,38** |
|
m. tibialis ant. |
4,21 ± 0,57 |
3,85 ± 0,3 |
3,87 ± 0,33 |
9,37 ± 1,82** |
9,22 ± 0,61** |
9,01 ± 1,58** |
Фрактальная размерность (D)
|
m. triceps br. |
1,59 ± 0,51 |
1,54 ± 0,09 |
1,66 ± 0,08 |
1,85 ± 0,1 |
1,74 ± 0,09 |
1,81 ± 0,14* |
|
m. biceps br. |
1,64 ± 0,09 |
1,62 ± 0,09 |
1,63 ± 0,09 |
1,74 ± 0,05*** |
1,79 ± 0,03 |
1,80 ± 0,04* |
|
m. gastrocnemius |
1,49 ± 0,07 |
1,49 ± 0,07 |
1,56 ± 0,07*** |
1,74 ± 0,11*** |
1,81 ± 0,07*** |
1,78 ± 0,07* |
|
m. tibialis ant. |
1,49 ± 0,05 |
1,51 ± 0,06 |
1,87 ± 1,09 |
1,81 ± 0,16*** |
1,79 ± 0,03 |
1,72 ± 0,15 |
Примечание. * – р < 0,05, ** – p < 0,01, *** – p < 0,001 при сравнении детей с 33 неделями гестационного возраста с детьми 35, 37 недель постменструального возраста и 2, 4, 6-недельными доношенными детьми.
Таблица 2
Средняя частота спектра и средняя максимальная амплитуда (мкВ) иЭМГ в зависимости от постнатального возраста в разных мышцах ребенка в первые 6 недель жизни (M ± SD, недели)
|
Мышца |
Недоношенные дети (нед.) |
Доношенные дети (нед.) |
||||
|
2 |
4 |
6 |
2 |
4 |
6 |
|
Средняя частота спектра
|
m. biceps br. |
166,35 ± 32,68 |
180,63 ± 45,03 |
163,88 ± 29,63 |
218,4 ± 90,99 |
177,08 ± 48,03 |
202,57 ± 73,71 |
|
m. triceps br. |
185,35 ± 27,29 |
179,74 ± 34,54# |
153,8 ± 41,4# |
226,02 ± 48,47** |
211,24 ± 78,05### |
265,84 ± 73,71### |
|
m. gastrocnem. |
182,32 ± 21,05 |
188,39 ± 48,46 |
183,87 ± 45,82 |
237,55 ± 39,99 |
217,43 ± 28,32*** |
261,21 ± 71,78***# |
|
m. tibialis ant. |
171,12 ± 31,19 |
163,46 ± 47,15 |
150,41 ± 25,27# |
184,39 ± 50,14*** |
195,78 ± 36,51 |
262,9 ± 124,9*** |
Средняя максимальная амплитуда, мкВ
|
m. biceps br. |
153,67 ± 53,1 |
162,0 ± 49,0 |
144,67 ± 11,9 |
180,75 ± 22,49*** |
205,0 ± 23,4*** |
195,25 ± 43,51 |
|
m. triceps br. |
146,67 ± 30 |
169,93 ± 18,0 |
233,0 ± 76,13# |
187,75 ± 35,4*** |
315,67 ± 131,4** |
213,75 ± 51,6*** |
|
m. gastrocnem. |
129,67 ± 29,57 |
133,33 ± 4,04 |
134,0 ± 9,0 |
190,5 ± 42,1*** |
216,0 ± 80,85 |
157,75 ± 16,8***### |
|
m. tibialis ant. |
173,0 ± 96,17 |
179,33 ± 48,0 |
176 ± 19,69 |
230,5 ± 69,59** |
220,33 ± 74,07*** |
226,0 ± 41,53*** |
Примечание. * – р < 0,05, ** – p < 0,01, *** – p < 0,001 при межгрупповом сравнении с детьми 2 недель жизни; # – р < 0,05, ## – p < 0,01, ### – p < 0,001 при внутригрупповом сравнении с детьми 2 недель жизни.
На протяжении 6-недельного постнатального периода иЭМГ недоношенного ребенка имеет сходство с таковой доношенного новорожденного первых дней жизни и характеризуется «упрощенной» временной структурой и низкой амплитудой и частотой спектра. В отличие от доношенного новорожденного, у недоношенного ребенка динамика параметров иЭМГ замедлена. С точки зрения динамики систем это может быть следствием меньшего по сравнению со «сложным» сигналом количества нервных центров или уровней, участвующих в генерации сигнала, а также снижения количества связей между центрами (индекса кластеризации) [13]. Известно, что при увеличении числа генераторов их работа в основном асинхронна, и как следствие этого – система производит более сложный сигнал. Таким образом, у недоношенных детей начиная с 2-недельного возраста, вероятно, меньше связей между элементами нервной системы на уровнях ЦНС и большая синхронизация активности двигательных единиц.
Значения всех нелинейных параметров в группе контроля (доношенные дети) достаточно большие уже к концу 2-й недели ( D ≈ 1,80, Dc и K2 ~ 6,0–9,0) и далее практически не изменяются. Это свидетельствует о том, что у 2-недельного доношенного ребенка формируется иЭМГ, уже вполне «зрелая» с точки зрения временной организации нейронного генератора, сопоставимая с иЭМГ взрослого человека.
Мы предполагаем, что резкое увеличение значений нелинейных параметров иЭМГ у доношенных детей в течение первых 2 недель после рождения является следствием перехода из внутриутробной во внеутробную среду. Основ- ными факторами новой среды являются резкое исчезновение иммерсии, которая, как показано, может являться аналогом микрогравитации [1], и более низкая температура.
Очевидно, что из-за более короткого пребывания во внутриутробном состоянии двигательная система недоношенного ребенка менее зрелая и подготовленная к внеутробной жизни. Поэтому названные выше новые факторы среды для недоношенных детей являются даже более агрессивными. Это свидетельствует о том, что при работе с недоношенными детьми нужно особое внимание уделять именно вопросам выхаживания.
Полученные нами данные могут быть использованы для прогнозирования состояния двигательной системы недоношенного ребенка в будущем, в том числе в отдаленном (через несколько лет), как это делается по методу Prechtle с помощью видеомониторинга движений [3].
ВЫВОДЫ
В настоящей работе апробирована схема неврологического осмотра недоношенного ребенка с разным ПКВ (А. Б. Пальчик, 2008). Полученные клинические данные позволили качественно и количественно оценить психомоторный статус обследуемых детей. Результаты ЭМГ исследования нейромышечного статуса свидетельствуют о чувствительности метода у детей различного гестационного возраста и позволяют объективизировать и дополнить данные клинического осмотра.
Нам представляется перспективным обследовать детей с еще меньшей массой тела при рождении, а также в течение двух недель после рождения.
* Работа выполнена при поддержке Программы стратегического развития (ПСР) ПетрГУ в рамках реализации комплекса мероприятий по развитию научно-исследовательской деятельности на 2012–2016 гг.
Список литературы Клиническая и электромиографическая характеристики нейромышечного статуса у недоношенных детей
- Мейгал А. Ю. Онтогенетическая модель гравитации и невесомости: теоретические и практические аспекты//Физиология человека. 2011. Т. 37. № 6. С. 130-138.
- Меклер А. А. Применение аппарата нелинейного анализа динамических систем для обработки сигналов ЭЭГ//Вестник новых медицинских технологий. 2007. Т. 14. № 1. С. 73.
- Пальчик А. Б., Федорова Л. А., Понятишин А. Е. Неврология недоношенных детей. М.: МЕДпресс-информ, 2010. 352 с.
- Приказ Минздравсоцразвития России № 1687н от 27 декабря 2011 г.
- Федер Е. Фракталы: Пер. с англ. М.: Мир, 1991. 254 с.
- Шабалов Н. П. Неонатология. Т. II. СПб.: Специальная литература, 2004. 608 с.
- Bollard J. L., Kazmaier K., Driver M. A. A simplified assessment of gestational age//Pediatr. Res. 1977. Vol. 11. P. 374.
- Dubowitz L. M. S., Dubowitz V., Mercuri E. The neurological assessment of the pre-term and full-term infant. Clinics in Developmental Medicine, № 148. London: MacKeith Press, 1999. 155 p.
- Farina D., Merletti R., Enoka R. M. The extraction of neural strategies from the surface EMG//J. Appl. Physiol. 2003. Vol. 96. P. 1486-1495.
- Gosselin J., Amiel-Tison C. Evaluation neurologique de la naissance à 6 ans. Presses de l’Hôpital Sainte-Justine. Montréal; Paris: Masson, 2007.
- Grenier A. La motricité libérée du nouveau-né. Paris: Médecine et enfance, 2000.
- Meigal A., Rissanen S., Tarvainen M. et al. Linear and nonlinear tremor acceleration characteristics in patients with Parkinson’s disease//Physiol. Measur. 2012. Vol. 33. P. 395-412.
- Stam C. J. Nonlinear dynamical analysis of EEG and MEG: Review of an emerging field//Clinical Neurophysiology. 2005. Vol. 116. P. 226-2301.
- Sung P. S., Zurcher U., Kaufman M. Comparison of spectral and entropic measures for surface electromyography time series: a pilot study//J. Rehabil. Res. and Dev. 2007. Vol. 44. P. 599-610.


