Клиническая эффективность сопроводительной иммунотерапии активированными лимфоцитами у больной меланомой (случай из практики)
Автор: Абакушина Елена Вячеславовна, Пасова Ирина Алексеевна, Маризина Юлия Витальевна, Кудрявцев Дмитрий Владимирович, Кудрявцева Галина Терентьевна, Фомина Eкатерина Cергеевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 5 т.15, 2016 года.
Бесплатный доступ
Совершенствование методов лечения онкологических заболеваний, увеличение их эффективности и безопасности являются актуальной задачей. Помимо радикальных методов лечения, большое значение имеет иммунотерапия. Описан опыт применения адоптивной иммунотерапии цитокин-индуцированными киллерами (ЦИК) у больной меланомой IIIB стадии с метастазами после комплексного лечения. Для активации мононуклеарные клетки выделяли из периферической крови и культивировали в среде X-Vivo20 на протяжении 10-14 дней с добавлением ИЛ-2 (250 МЕ/мл) и ИЛ-15 (50 нг/мл). С января 2015го в течение года проводился непрерывный курс лечения ЦИК лимфоцитами в количестве 34,5 млн и клеточным продуктом 39 введений внутрикожно паравертебрально в 2-4 точки каждые 1-2 нед. Через 3 мес от начала лечения ЦИК цитофлуориметрический анализ лимфоцитов периферической крови пациента показал снижение количества NK-клеток с 18 до 12 % и CD314+NK-клеток - с 16 до 6 %. Отмечено увеличение содержания активированных CD38+ лимфоцитов с 53 до 66 %, а CD38+Т-лимфоцитов - с 24 до 51 %, HLA-DR+ лимфоцитов - с 21 до 28 %, на HLA-DR+Т-лимфоцитов - с 9 до 20 %, а CD25+ лимфоцитов - с 19 до 29 %. На этом фоне наблюдались появление реактивно изменённых лимфоузлов и стабилизация болезни. Через 9 мес от начала проведения адоптивной иммунотерапии произошла полная регрессия метастаза на левом плече ниже послеоперационного рубца. Через 11 мес после начала АИТ была выявлена частичная регрессия метастаза на правом предплечье. С момента постановки пациентке диагноза до момента наблюдения прошло 36 мес и 12 мес от начала АИТ. Данный результат показывает увеличение продолжительности безрецидивной выживаемости. Оценка эффективности сопроводительной иммунотерапии у больной меланомой показала положительный эффект адоптивной иммунотерапии при длительном применении ЦИК в низких концентрациях.
Меланома, адоптивная иммунотерапия, цитокин-индуцированные киллеры, маркеры активации лимфоцитов
Короткий адрес: https://sciup.org/140254075
IDR: 140254075 | УДК: 616.5-006.81-085:612.112.94-08 | DOI: 10.21294/1814-4861-2016-15-5-89-94
Текст научной статьи Клиническая эффективность сопроводительной иммунотерапии активированными лимфоцитами у больной меланомой (случай из практики)
В настоящее время неотъемлемую часть лечения онкологических заболеваний составляют биологические методы. Различные методики клеточной иммунотерапии внедряются в клиническую практику, поскольку злокачественные новообразования являются хорошей мишенью для адоптивной иммунотерапии [1]. Клеточному звену иммунитета, представленному в организме человека рядом эффекторных клеток, принадлежит ключевая роль в защите организма от злокачественных образований [2–4], а комплексные подходы с использованием культивируемых in vitro цитотоксических лимфоцитов приобретают все большее значение в терапии онкологических заболеваний [5–7].
Эффективность адоптивной клеточной терапии при лечении меланомы и некоторых видов рака демонстрируют клинические исследования последних лет. К перспективным зарубежным исследованиям последних лет относятся подходы лечения злокачественных новообразований, основанные на применении клеточной иммунотерапии с использованием цитокин-индуцированных киллеров (ЦИК) или активированных in vitro цитотоксических лимфоцитов [8–10]. Анализ базы данных клинических испытаний II/III фазы применения ЦИК клеток обнаружил существенное увеличение полугодовой, годичной и двухлетней выживаемости, а также безрецидивной выживаемости и
среднего времени до прогрессирования. Однако в данных исследованиях не было отмечено полного ответа на терапию [10].
Развитие данного направления представляет собой задачу, решение которой может способствовать снижению риска метастазирования и рецидива опухолевого роста. Последние исследования и клинические испытания показали, что адоптивная иммунотерапия (АИТ) может быть перспективным методом лечения онкологических больных.
Цель исследования – оценить эффективность сопроводительной иммунотерапии цитокин-индуцированными киллерами (ЦИК) при комплексном лечении больной меланомой с неблагоприятным прогнозом.
Представлен результат лечения больной метастатической меланомой с использованием адоптивной иммунотерапии ЦИК. Исследование было одобрено этическим комитетом МРНЦ им. А.Ф. Цыба.
Пациентка С., 1962 г. р., с диагнозом: Меланома кожи левого плеча рT3bN1bM0 (IIIB). Метастазы в лимфоузлы подмышечной области слева. В июле 2013 г. проведён предоперационный курс лучевой терапии СОД 50 Гр на опухоль левого плеча, оперативное лечение. В августе 2013 г. – предоперационный курс лучевой терапии на подмышечные лимфоузлы слева и лимфаденэктомия. С июля по декабрь 2013 г. ежемесячно проведено 8 курсов химиотерапии (дакарбазин). На фоне химиотерапии больная отмечала ухудшение настроения, слабость, изменение аппетита, тошноту, расстройства стула, быструю утомляемость и тревожность. По данным лабораторных обследований наблюдалась незначительная тромбоцитопения и лейкопения. В декабре 2014 г. зафиксировано прогрессирование заболевания. Обнаружены метастазы в мягкие ткани правого предплечья, левого плеча, правой молочной железы. В январе 2015 г. проведены паллиативный курс БФК-рентгенотерапии СОД 32 Гр и химиотерапия (мюстофоран). Объективного изменения в размерах метастатических образований по данным УЗИ выявлено не было. Параллельно с этим пациентке был проведен первый курс сопроводительной АИТ аутологичными активированными ЦИК. Первые четыре раза вводились активированные лимфоциты в количестве от 2 до 5 млн за одно введение на 3, 5, 7 и 9-й день активации МНК, далее сопроводительную иммунотерапию продолжали клеточным продуктом (супернатантом) в объеме 1,5–2 мл 1–2 раза в неделю в течение 5 мес. В сентябре 2015 г. забор крови повторили и продолжили АИТ по описанной выше схеме. В течение 16 мес, с января 2015 г. по май 2016 г., лечение ЦИК лимфоцитами проводилось непрерывно с небольшими перерывами в 4 и 2 нед. За это время пациентке было введено 44 млн ЦИК внутрикожно паравертебрально в 2–4 точки и
43 введения клеточного продукта. ЦИК получали из мононуклеаров периферической крови, инкубируя 10–14 дней в присутствии ИЛ-2 и ИЛ-15, как описано ранее [11].
После начала сопроводительной АИТ на фоне химиотерапии мюстофораном пациентка отмечала улучшение настроения, общего самочувствия, увеличение двигательной активности и работоспособности. Не было замечено нарушений со стороны желудочно-кишечного тракта и психоэмоциональных расстройств. Показатели периферической крови оставались в норме, чего не было достигнуто во время химиотерапии без сопроводительной АИТ на фоне лечения дакарбазином.
Перед АИТ и на этапах АИТ каждые 3 мес проводился иммуномониторинг, основанный на оценке фенотипа В-, Т-, NKT-, NK-лимфоцитов периферической крови и маркеров активации (HLA-DR, CD38, CD69, CD314, CD25). Цитофлуориметрию проводили на проточном цитометре FACScan (Becton Dickinson, США), как описано ранее [5].
С февраля по апрель 2015 г. АИТ ЦИК лимфоцитами проводилась в монорежиме. Через 3 мес от начала проведения АИТ ЦИК в периферической крови пациента было отмечено снижение количества NK-клеток с 18 до 12 % и экспрессии активирующего рецептора NKG2D на всех лимфоцитах с 48 до 23 %, а на NK-клетках – с 16 до 6 %. Возможно, данные изменения произошли за счет миграции эффекторных клеток в лимфатические узлы, которые объективно по данным УЗИ увеличились в размерах в этот период. Через 3 мес от начала АИТ отмечено повышение экспрессии раннего маркера активации CD38 на всех лимфоцитах с 53 до 66 %, а на Т-лимфоцитах – с 24 до 51 %. Поверхностная экспрессия позднего маркера активации HLA-DR на всех лимфоцитах увеличилась с 21 до 28 %, а CD25 – с 19 до 29 %. На Т-лимфоцитах экспрессия HLA-DR возросла с 9 до 20 %. Данные иммунофенотипирования лимфоцитов подтверждают системный эффект проведенной АИТ и полученные нами ранее данные на большой группе пациентов [5].
На фоне изменения субпопуляционного состава лимфоцитов и увеличения доли активированных лимфоцитов в периферической крови наблюдалось появление реактивно изменённых лимфоузлов и стабилизация процесса, о чем свидетельствует заключение УЗИ. УЗИ лимфатических узлов выявило увеличение размеров до 8×7 мм за счет гиперреактивности в ответ на введение ЦИК, что было подтверждено морфологически.
Положительные изменения в иммунограмме сохранялись в течение последующих 3 мес. Таким образом, наблюдалась длительная активация противоопухолевого звена иммунитета на фоне сопроводительной иммунотерапии. Объективно через 6 мес после проведения лечения активированными цитотоксическими лимфоцитами у паци-
А
Б
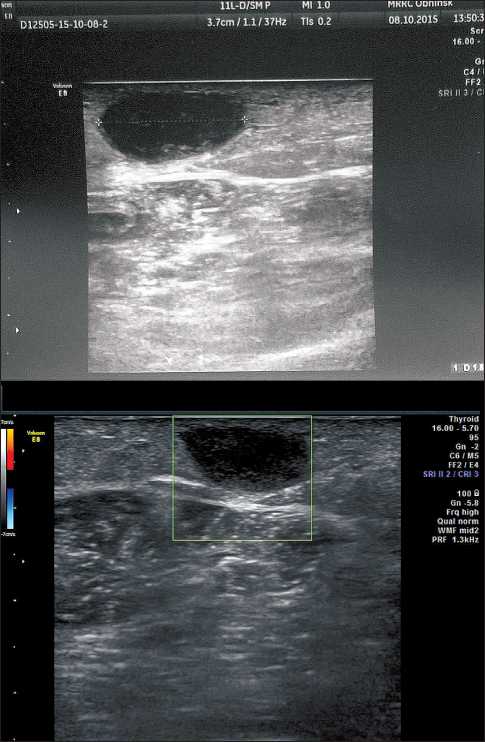
Рис. 1. УЗИ метастаза на правом предплечье:
А. Частичная регрессия метастаза до 15×8×19 мм на правом предплечье через 9 мес после начала иммунотерапии (ранее был размером 21×10×19 мм);
Б. Частичная регрессия метастаза до 14×7×13 мм на правом предплечье через 11 мес после начала иммунотерапии
А
Б
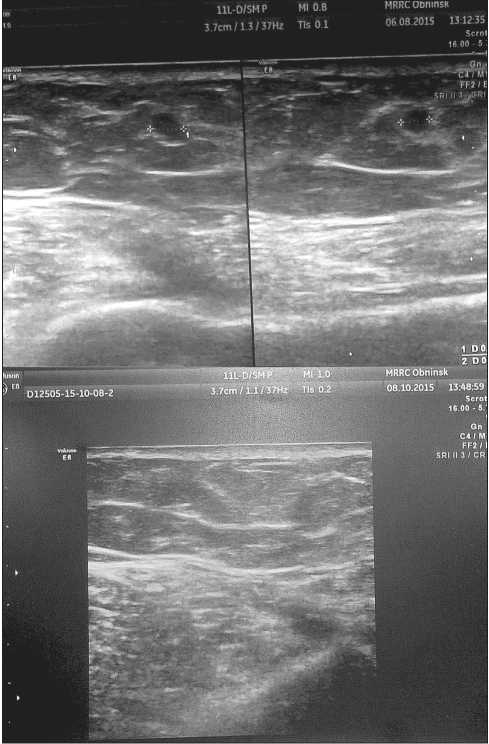
Рис. 2. УЗИ метастаза на левом плече ниже послеоперационного рубца:
А. Через 6 мес от начала иммунотерапии размером 4×3×3 мм;
Б. Полная регрессия метастаза через 9 мес после начала иммунотерапии
ентки нормализовался стул, повысился аппетит, увеличилась работоспособность и улучшилось настроение, несмотря на проведенную химиотерапию. Возможно, данные изменения в качестве жизни связаны с увеличением в организме больной биологически активных веществ, выделяемых активированными лимфоцитами. Данное клиническое наблюдение характеризует восстановление взаимосвязи между иммунной, эндокринной и нервной системой.
Через 5 мес от начала ИТ в мае 2015 г. у пациентки несколько уменьшились размеры лимфоузлов. Лимфоузел правой надключичной области стал 7×6 мм (был 8×7 мм), лимфоузел левой надключичной области стал 7×5 мм (был 10×7 мм). Также отмечено увеличение количества реактивных лимфоузлов. Данные изменения подтверждают положительный эффект иммунотерапии ЦИК.
Размер метастаза в области рубца на левом плече не изменился, а на правом – увеличился с 18×11×18 мм до 22×11×18 мм. После перерыва в мае 2015 г. сроком на один месяц больной с июня по июль проведен повторный курс сопроводительной иммунотерапии клеточным продуктом. В конце июля с помощью УЗИ было установлено, что метастаз в области рубца на правом плече уменьшился на 5 мм до размеров 17×11×17 мм, а на левом плече уменьшился до размеров 5×4 мм. В августе после перерыва в проведении адоптивной иммунотерапии размер метастаза на правом предплечье снова несколько увеличился – до 21×10×19 мм. После возобновления адоптивной иммунотерапии ЦИК в монорежиме наблюдалась тенденция к уменьшению его размеров через 9 мес до 15×8×19 мм (рис. 1А), через 11 мес – до 14×7×13 мм (рис. 1Б). Метастаз на левом плече ниже послеоперационного рубца продолжал уменьшаться (рис. 2А), и через 9 ме. от начала проведения адоптивной иммунотерапи произошла полная его регрессия (рис. 2Б). Также по данным УЗИ определялся реактивный подключичный лимфоузел слева размерами 12×7 мм, в верхней зоне шеи с двух сторон – реактивные паравазальные лимфоузлы до 13×5 мм, надключичные лимфоузлы не определялись.
Средняя продолжительность жизни больных меланомой IIIB стадии с наличием метастазов составляет около 4–6 мес. С момента постановки пациентке диагноза на момент наблюдения прошло 36 мес и 16 мес от начала АИТ. Полученные результаты показывают увеличение продолжительности безрецидивной выживаемости.
Таким образом, проведенная оценка клинической эффективности адоптивной иммунотерапии ЦИК больной меланомой позволила диагностировать полную и частичную регрессию метастатических образований и появление реактивных лимфоузлов после проведения иммунотерапии активированными лимфоцитами в монорежиме. В настоящее время у пациентки наблюдается стабилизация процесса, она продолжает получать АИТ в монорежиме.
Заключение
Метод сопроводительной иммунотерапии ЦИК лимфоцитами после комплексного лечения сопровождался уменьшением побочных эффектов
Список литературы Клиническая эффективность сопроводительной иммунотерапии активированными лимфоцитами у больной меланомой (случай из практики)
- Li Y., Huang Q., Zhong Y., Wang A., Sun J., Zhou J. Prospects in adoptive cell transfer therapy for сancer. J Immunol Clin Res. 2013; 1: 1008
- Бережной А.Е., Гнучев Н.В., Георгиев Г.П., Козлов А.М., Ларин С.С. Молекулярные механизмы взаимодействия опухоли и иммунной системы. Вопросы онкологии. 2008; Т. 54, № 6: 669-683
- Бережной А.Е., Чернышева А.Д., Закеева И.Р., Данилова А.Б., Данилов А.О., Моисеенко В.М., Geraghty D., Гнучев Н.В., Георгиев Г.П., Кибардин А.В., Ларин С.С. Индукция экспрессии молекулы HLA-E на поверхности опухолевых клеток интерфероном-гамма приводит к защите опухолевых клеток от цитотоксического действия лимфоцитов. Вопросы онкологии. 2009. Т. 55, № 2: 224-229
- Cheng M., Chen Y., Xiao W., Sun R, Tian Z. NK cell-based immunotherapy for malignant diseases. Cell Mol Immunol. 2013 May; 10 (3): 230-52. DOI: 10.1038/cmi.2013.10
- Абакушина Е.В., Маризина Ю.В., Неприна Г.С., Кудрявцев Д.В., Пасова И.А., Селиванова Н.В. Особенности субпопуляционного состава лимфоцитов у онкологических больных при комбинированном лечении с включением адоптивной иммунотерапии. Сибирский онкологический журнал. 2015; 1: 45-50


