Клиническая оценка эффективности применения метода трансмиокардиальной лазерной реваскуляризации в сочетании с имплантацией мононуклеарной фракции аутологичного костного мозга при лечении хронической ишемической болезни сердца
Автор: Чернявский А.М., Ларионов П.М., Бондарь В.Ю., Фомичев А.В., Чернявский М.А., Терехов И.Н.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Ишемическая болезнь сердца
Статья в выпуске: 3 т.12, 2008 года.
Бесплатный доступ
Статья посвящена клинической оценке эффективности трансмиокардиальной лазерной реваскуляризации (ТМЛР) в сочетании с имплантацией мононуклеарной фракции аутологичного костного мозга у 35 больных с диффузным, преимущественно дистальным поражением коронарного русла. Данные ультразвуковой кардиографии использовали для анализа клинического состояния больных, динамики сократимости миокарда и локальной сократимости левого желудочка, а данные перфузионной сцинтиграфии - для изучения перфузии миокарда. Емкость капиллярного русла миокарда определяли путем подсчета количества потребляемого миокардом кислорода. Оценивались как ближайшие результаты (через 2 недели после операции), так и отдаленные (через 6-8 месяцев после операции). По результатам исследования в отдаленном периоде отмечалось улучшение как общей перфузии, так и перфузии в зоне непрямой реваскуляризации. Выявлено некоторое улучшение глобальной сократимости миокарда и увеличение емкости капиллярного русла миокарда. При оценке сегментарной сократимости выявлено достоверное уменьшение количества акинетичных сегментов, тогда как количество гипокинетических сегментов, по-видимому, осталось прежним.
Реваскуляризация, лазер, стволовые клетки
Короткий адрес: https://sciup.org/142233473
IDR: 142233473
Текст научной статьи Клиническая оценка эффективности применения метода трансмиокардиальной лазерной реваскуляризации в сочетании с имплантацией мононуклеарной фракции аутологичного костного мозга при лечении хронической ишемической болезни сердца
Ишемическая болезнь сердца (ИБС) и сердечная недостаточность остаются наиболее значимыми проблемами системы здравоохранения в Западных странах. Только в США живут около 7,1 млн людей после инфаркта миокарда и 4,9 млн людей с сердечной недостаточностью. Несмотря на явный прогресс в медикаментозном и хирургическом лечении сердечной недостаточности, показатели заболеваемости, госпитализации и смертности продолжают расти. После установления диагноза сердечной недостаточности один из пяти пациентов погибает в течение 12 месяцев [11].
На современном этапе развития хирургии ИБС большое внимание уделяется развитию альтернативных методов реваскуляризации, в т.ч. с использованием лазерных и клеточных технологий. Однако на данный момент не существует единого мнения о значимости того или иного метода, об их вкладе в процессы ангио- и васкулогенеза.
Цель исследования - клинико-функциональная оценка метода трансмиокардиальной лазерной реваскуляризации (ТМЛР) в сочетании с имплантацией стволовых клеток (СК) в хирургии ИБС с диффузным и дистальным поражением коронарного русла.
МАТЕРИАЛ И МЕТОДЫ
С 29.03.2006 по 05.11.2007 в центре хирургии аорты, коронарных и периферических артерий ФГУ «ННИИПК им. акад. Е.Н. Мешалкина» 35 больным ИБС во время операции аортокоронарного шунтирования (АКШ) выполнена процедура ТМЛР в сочетании с имплантацией мононуклеарной фракции аутологичного костного мозга. Средний возраст больных составил 58,5±7,3 года; 97,14% больных мужчины, преимущественно (60%) в возрасте от 50 до 60 лет.
Диагноз ИБС был поставлен всем больным при поступлении в клинико-диагностическое отделение на основании анамнеза, клиники стенокардии напряжения и/или покоя, объективных дополнительных методов обследования.
С целью определения функционального класса (ФК) стенокардии использована классификация CCS. В распределении ФК стенокардии, согласно классификации CCS большинство больных (51,42%) находилось в III ФК (табл.).
У 3 из 35 (8,57%) больных при поступлении имелась клиника нестабильной стенокардии. Этим больным проводилась интенсивная анти-ангинальная терапия с целью стабилизации состояния, после чего было выполнено оперативное вмешательство. У одного пациента зарегистрирована безболевая ишемия миокарда.
По данным анамнеза, 30 больных перенесли инфаркт миокарда в разные сроки до операции (85,7% больных), подтвержденный клинико-
Распределение больных в зависимости от ФК стенокардии
При обследовании у 6 (17,14%) пациентов помимо измененных коронарных артерий (КА) имелось атеросклеротическое поражение еще одного сосудистого бассейна, у одного пациента (2,85%) - признаки мультифокального атеросклероза. У 6 больных (17,14%) отмечено поражение брахиоцефальных артерий, у одного (2,85%) - синдром Лериша и поражение сосудов нижних конечностей. Кроме этого из сопутствующей патологии у 30 больных (85,7%) отмечена артериальная гипертензия, у двоих больных (5,7%) - сахарный диабет различной степени тяжести. У троих больных (8,57%) отмечены нарушения мозгового кровообращения, у одного - явления дисциркуляторной энцефалопатии. У 3 больных (8,57%) имелась желудочковая экстрасистолия, у одного - суправентрикулярная экстрасистолия, и у одного -фибрилляция предсердий.
Показаниями к операции служили: 1) выраженная клиника стенокардии, рефрактерная к обычной антиангинальной терапии; 2) диффузное поражение коронарных артерий, поражение дистального русла или наличие мелких, нешун-табельных КА; 3) наличие в области операции жизнеспособного (гибернированного) миокарда. У многих пациентов выполнялась эндартерэктомия пораженной артерии с последующим АКШ (17 больных - 48,57%), затем проводилась непрямая реваскуляризация бассейна пораженной артерии. Эндартерэктомия из одной коронарной артерии выполнялась у 12 пациентов (34,28%), из 2 коронарных артерий - у троих больных (8,57%), из 3 артерий - у двоих пациентов (5,7%). При невозможности выполнения АКШ какой-либо артерии в этом бассейне выполнялась только ТМЛР в сочетании с имплантацией стволовых клеток (у 5 пациентов -14,28%). Следует отметить, что наиболее часто имело место сочетание нескольких видов поражения КА, которые не позволяли выполнить прямую реваскуляризацию миокарда.
Одним из основных условий операции является наличие жизнеспособного миокарда в зоне вмешательства. Для изучения обратимости изменений в миокарде сегодня широко используется стресс-ЭхоКГ, перфузионная сцинтиграфия, однофотонная эмиссионная томография (ОФЭКТ) и позитронно-эмиссионная томография (ПЭТ). В связи с этим у всех больных проанализированы данные планарной СЦМ с Тс-99 у больных ИБС в плане возможности дооперационной дифференциации жизнеспособного миокарда, для оценки эффективности непрямой реваскуляризации.
Состояние миокарда оценивали по 5-балльной шкале: 4 - норма, 3 - ишемия (гиберниро-ванный миокард), 2 - мелкоочаговые рубцовые изменения, 1 - рубец, 0 - аневризма.
Исследование выполнялось в два этапа -в покое и нагрузке. Для нагрузочной пробы использовался аденозин. Основными параметрами явились стабильный дефект перфузии (СДП), преходящий дефект перфузии (ПДП), общий дефект перфузии (ОДП), стабильный дефект перфузии в области воздействия (СДПОВ), преходящий дефект перфузии в области воздействия (ПДПОВ).
Одним из основных инструментальных методов исследования была ЭхоКГ. В рамках этого метода внимание уделялось сократительной функции левого желудочка, наличию или отсутствию нарушений локальной сократимости.
Также в нашем исследовании мы использовали метод определения величины объёма капиллярного русла, основанный на величине потребления кислорода миокардом. Число капилляров в миокарде определяется по формуле:
N„ = Р M, H
VT где PH - плотность сердца (кг/м3), Мн - масса сердца (кг), Vt - объем ткани в тканевом цилиндре (м3).
Статистическая обработка результатов проводилась с использованием программ «STATISTICA 6.0», «Microsoft Excel».
Вследствие небольшого количества наблюдений в выборке для анализа данных применялись непараметрические критерии. Для определения достоверности различий парных сравнений применяли T-критерий Вилкоксона. При сравнении нескольких зависимых выборок (результат лечения в разные сроки) применялся критерий Friedman ANOVA. Значение p < 0,05 считали статистически достоверным.
Процедура выполнялась параллельно АКШ. На этапе анестезиологической подготовки к операции выполняется забор аспирата костного мозга посредством пункции задней ости подвздошной кости. Объём получаемого аспирата - 50-80 мл. Для забора использовались разовые шприцы. Аспират забирали в стерильный флакон с гепаринизированным физиологическим раствором в соотношении - аспират: фи-
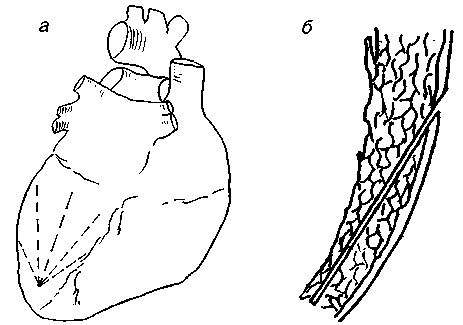
Рис. 1. Процедура формирования лазерных каналов: а - схема формирования радиальных лазерных каналов; б - лазерный канал на поперечном срезе стенки левого желудочка.
зиологический раствор 1:3 с конечной концентрацией гепарина 50 единиц в 1 мл. Во время выполнения основного этапа операции (АКШ) производилась подготовка мононуклеарной фракции аутологичного костного мозга, сепарированной на пластике в специализированной лаборатории. Принцип метода выделения СК был основан на различии в плотности форменных элементов крови. Смесь полисахарида фи-колла и рентгеноконтрастного вещества изопак или верографин создавала градиент с плотностью, позволяющей при центрифугировании разделить клетки костного мозга на мононук-леарную фракцию, в которую входят лимфоциты, субпопуляция моноцитов, бластные гемопоэтические клетки от фракции, содержащей грануло- и эритроциты.
После наложения дистальных анастомозов выполнялось формирование 4-5 радиально расположенных слепых лазерных каналов (рис. 1). Режим лазерного излучения был импульсным, длительность импульса - 500 мс, интервал между импульсами - 1000 мс. Мощность излучения - 8-10 Вт. Длина каналов определялась размером реваскуляризируемой области. Далее с целью создания замкнутой полости на устье каналов накладывался П-образный шов, производится введение взвеси стволовых клеток, после чего П-образный шов завязывался.
РЕЗУЛЬТАТЫ
Процедура забора аспирата костного мозга переносилась хорошо, постпункционных кровотечений и гематом выявлено не было.
Во время имплантации клеток не выявлено появления злокачественных аритмий (желу дочковая экстрасистолия высоких градаций, желудочковая тахикардия, фибрилляция желудочков), других нарушений сердечного ритма и проводимости. На завершающем этапе операции после прекращения окклюзии аорты у всех пациентов отмечалось самостоятельное восстановление сердечной деятельности с исходом в синусовый ритм. В условиях реанимации также не выявлено каких-либо злокачественных аритмий, нарушений сердечного ритма и проводимости.
По данным клинического обследования, среднее значение ФК сердечной недостаточности по NYHA в группе ТМЛР в сочетании с имплантацией СК достоверно уменьшилось с 2,57± ±0,61 до операции до 1,77±0,66 через 6-8 мес. после операции. По результатам исследования в отдаленном периоде выявлено достоверное уменьшение ФК стенокардии с 2,8±0,7 до 0,23±70,4.
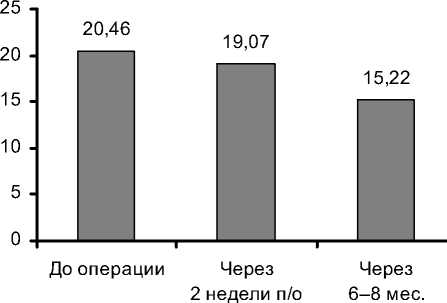
Динамика стабильного дефекта перфузии, характеризующая необратимые рубцовые изменения миокарда и частично гибернирующего миокарда, выглядит следующим образом. Отмечается небольшое уменьшение СДП в ближайшем послеоперационном периоде, более выраженное уменьшение СДП в отдаленном периоде. Среднее значение СДП до операции составило 20,46±10,75%, через 2 нед. после операции - 19,07±9,69%, через 6-8 мес. -15,22±9,49%, согласно критерию Friedman ANOVA, р=0,00537. Различия статистически достоверны. Подобная динамика указывает на более выраженный эффект непрямой реваскуляризации, который наступает именно в отдаленном периоде (рис. 2). Подобное уменьшение стресс-дефекта говорит об увеличении микро-циркуляторного резерва миокарда. При оценке сегментарной перфузии в области воздействия выявлено уменьшение стабильных и преходящих дефектов перфузии как в ближайшем, так и в отдаленном периоде (рис. 3).
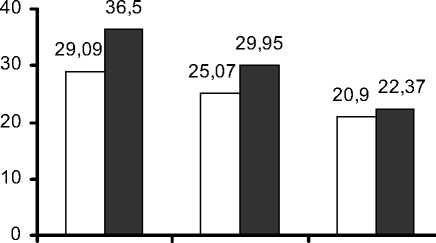
Среднее значение СДПОВ до операции составило 29,09±17,66%, через 2 недели после операции - 25,07±17,59%, в отдаленном периоде - 20,9±16,6%. Различия внутри группы статистически достоверны (р=0,00043, согласно критерию Friedman ANOVA).
Среднее значение ПДПОВ до операции -7,43±8,86%, через 2 недели после операции -5,99±6,98%, в отдаленном периоде - 3,38±5,87%. Различия внутри группы достоверны, согласно критерию Friedman ANOVA, р=0,00073.
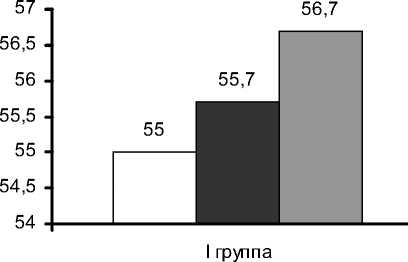
При оценке глобальной сократимости выявлено не значительное, но достоверное улучше- ние ФВ ЛЖ. Среднее значение ФВ ЛЖ до операции составило 55±10,4%, через 2 нед. после операции - 55,7±9,3%, в отдаленном периоде - 56,7±10% (рис. 4). Согласно критерию Friedman ANOVA, р<0,00742.
□ СДП осн.
Среднее значение количества акинетичных сегментов до операции и в ближайшем послеоперационном периоде составило 2,52±2,19, через 6-8 мес. после операции - 2±2,13. Различие внутри группы статистически достоверно (р<0,01, согласно критерию Friedman ANOVA).
Среднее значение количества сегментов гипокинеза до операции и в ближайшем послеоперационном периоде составило 0,47±1,1, через 6-8 мес. после операции - 0,97±2,27. Уровень статистической значимости различий внутри группы, согласно критерию Friedman ANOVA: р=0,76. Различия недостоверны.
Рис. 2. Динамика стабильного дефекта перфузии, %.
До операции Через Через
2 недели п/о 6-8 мес. п/о
Капиллярная емкость миокарда до операции составляла, в среднем, 3012,57±135,2/мм2, через 6-8 мес. - 3041,4±127,4/мм2. Различия достоверны.
ОБСУЖДЕНИЕ
Период 1960-х годов ознаменовался бурным развитием аортокоронарного шунтирования, однако, достигнув огромных успехов в лечении больных ИБС, хирурги вновь столкнулись с неокончательно разрешенной проблемой реваскуляризации миокарда. Оказалось, что приблизительно в 25-30% случаев размер коронарных сосудов недостаточен для эффективного шунтирования [1]. Более того, часть сосудов подвержена диффузным изменениям, и они также являются нешунтабельными [1]. Не менее сложна и проблема эффективной помощи больным, перенесшим две и более операций коронарного шунтирования и множественные анги-опластические процедуры [1]. Таким образом, существует значительная группа больных, для которых выбор традиционных методов прямой реваскуляризации ограничен. Именно эти предпосылки определили развитие альтернативных методов реваскуляризации миокарда.
□ СДПОВ ПОДПОВ
Рис. 3. Динамика показателей сегментарной перфузии.
□ До операции
□ Через 2 нед. п/о
□ Через 6-8 мес п/о
Использование лазерных технологий для выполнения процедуры непрямой реваскуляризации миокарда широко распространено в настоящее время. Как показали первые экспериментальные исследования [2], каналы, создаваемые с помощью лазера, остаются открытыми и могут перфузировать миокард, защищая от ишемии. Первые гистологические данные о проходимости каналов представил M. Mirhoseini [13-17]. Он и его коллеги сообщили об оставшихся откры-
Рис. 4. Динамика фракции выброса ЛЖ, %.
тыми в течение двух лет после операции каналах. Позднее M. Okada et al. [18] также известили о сохранении проходимости каналов
через несколько лет после операции. Наши результаты показали, что к 3-му месяцу после операции отмечено формирование соединитель-но-тканного рубца в местах лазерного воздействия, в составе которого встречаются крупные сосудистые образования, размерами более 1 000 мкм, тонкостенные, эритросодержащие, а также крупные тонкостенные синусоидального типа сосудистые образования меньших размеров. Эти сосуды не имеют аналогов в интактном миокарде. Что это, многоствольный, синусоидальный канал? И насколько целесообразно обсуждение, «открытый» или «закрытый» канал, если известно, что эффективную гемоциркуляцию миокарда могут обеспечивать только сосуды бассейна микроциркуляции (до 40 и 300 мкм).
Вопрос о стимулированном неоангиогенезе, по данным литературы, не имеет единого решения. Наши данные согласуются с данными R. Malekan et al. [12] о неспецифической тканевой реакции миокарда на повреждение, так, наши результаты показали, что при сопоставлении мест трансмиокардиальной лазерной реваскуляризации по уровню васкуляризации миокарда с моделью ИБС определяется одинаковый уровень плотности сечения сосудов размерами как до 40, так и до 300 мкм.
В течение последних лет изучение СК является предметом исследований ученых всего мира. Многочисленные авторские работы [3-10] подтверждают компетентность региональных СК в восстановлении микроциркуляторного русла ишемизированного миокарда и, вероятно, в замещении, в той или иной степени, дефекта миокарда на функционирующие кардиомиоциты, что в свою очередь приводит к снижению класса стенокардии и частичному восстановлению сердечной сократимости. В нашей работе мы не исследовали возможности СК к трансдифференциации в кардиомиоциты, акцент сделан на способность СК к неоваскуляризации в ишемизированном миокарде или, если быть точным в терминологии, к васкулогенезу, когда формируются сосуды «de novo», без участия камбиальных элементов предсуществующей сосудистой сети.
В доступной литературе мы не встретили метода комбинированной реваскуляризации, нет данных как о самом методе, так и о влиянии последнего на васкулогенез и микроцир-куляторный кровоток. В литературе имеются противоречивые данные относительно влияния индуцированного ангиогенеза на кровоток, сократительную функцию миокарда. Большинство из этих исследований оценивало перфузию в достаточно короткий промежуток после трансмиокардиальной лазерной реваскуляризации, когда новообразованных сосудов много, но они еще незрелые и не способны адекватно повлиять на изменение перфузии миокарда. Большинство исследователей оценивало количество новообразованных сосудов путем простого подсчета их в определенном объеме, без учета их удельного объема. Наше исследование показывает, что при оценке степени ангиогенеза необходимо ориентироваться на показатели удельного сосудистого объема, которые определяют функциональную зрелость новообразованных сосудов. Считаем, что полученные результаты позволяют сделать вывод о кумулятивном реваскуляризирующем эффекте лазерной реваскуляризации и клеточной терапии.
ВЫВОДЫ
Метод ТМЛР в сочетании с имплантацией СК является абсолютно безопасным и эффективным методом для улучшения перфузии и сократительной способности миокарда при хирургическом лечении ИБС.
Список литературы Клиническая оценка эффективности применения метода трансмиокардиальной лазерной реваскуляризации в сочетании с имплантацией мононуклеарной фракции аутологичного костного мозга при лечении хронической ишемической болезни сердца
- Бураковский В.И. Первые шаги. Записки кардиохирурга. М.: Медицина, 1988. С. 34.
- EDN: SKLMIP
- Скобелкин O.K., Бредикис Ю.Ю., Брехов В.И. и др. // Хирургия. 1984. № 10. С. 99-102.
- Verheul H.A., МоиН]п A.C., Hondema S. et al. // Amer.J. Cardiol. 1991. Vol. 67. P. 24-30.
- Asahara N., Masuda H., Takahashi T. et al. // Circ. Res. 1999. Vol. 85. P. 221-228.
- Bianco P., Riminucci M., Gronthos S. // Stem. Cell. 2001. Vol. 19. P. 180-192.
- EDN: LXHGKR


