Клинические аспекты лечения пациентов с длительно персистирующей формой фибрилляции предсердий и декомпенсированной хронической сердечной недостаточностью с помощью метода РЧА и кардиоресинхронизирующей терапии
Автор: Кочарян Армен Артурович, Желяков Евгений Геннадьевич, Гусейнова Рузанна Рафиковна, Конев Алексей Васильевич, Ардашев Андрей Вячеславович
Журнал: Клиническая практика @clinpractice
Рубрика: Случай из практики
Статья в выпуске: 3 (15), 2013 года.
Бесплатный доступ
В статье описывается клинический случай 64-летнего пациента с длительно существующей персистирующей формой фибрилляции предсердий с прогрессирующим течением хронической сердечной недостаточности, которому успешно проведена операция имплантации кардиоресинхронизирующего устройства и хирургическая коррекция нарушения ритма сердца методом радиочастотной абляции. Динамическое наблюдение за пациентом на протяжении 12 месяцев подтвердило успех комбинированного лечения – отсутствие эпизодов аритмии и уменьшение проявлений хронической сердечной недостаточности.
Длительно персистирующая форма фибрилляции предсердий, радиочастотная катетерная абляция, хроническая сердечная недостаточность
Короткий адрес: https://sciup.org/14338463
IDR: 14338463
Текст научной статьи Клинические аспекты лечения пациентов с длительно персистирующей формой фибрилляции предсердий и декомпенсированной хронической сердечной недостаточностью с помощью метода РЧА и кардиоресинхронизирующей терапии
Фибрилляция предсердий (ФП) – это разновидность наджелудочковых тахиаритмий, характеризующаяся некоординированной электрической активностью предсердий с ухудшени- ем их сократительной функции. ФП ассоциируется с прогрессированием хронической сердечной недостаточности (ХСН), высоким риском развития тромбоэмболических осложнений, снижением качества жизни [1, 2]. ХСН и ФП являются взаимообусловленными и взаимоотя-гощающими эпидемиями в рубрике сердечнососудистых заболеваний, ответственными за лидирующие позиции сердечно-сосудистой патологии в структуре общей летальности [3]. Смертность среди пациентов с ФП примерно в два раза выше, чем у больных с синусовым ритмом [3]. Одним из основных клинических проявлений ФП является сердечная недостаточность, которая развивается вследствие систолической дисфункции сердца, с комплексом характерных симптомов (одышка, утомляемость, снижение физической активности, отеки и др.). Наличие ФП у пациентов с уже существующей ХСН является одним из неблагоприятных прогностических факторов течения заболевания. Современные рекомендации по диагностике и лечению ФП у пациентов с выраженными проявлениями ХСН подразумевают сдержанную тактику, заключающуюся в контроле ЧСС на фоне ФП, профилактике тромбоэмболических осложнений и базовой терапии ХСН.
Клинический случай
-
1 этап. Больной Т., 64 лет, обратился в ФГБУ ФНКЦ ФМБА России с жалобами на одышку при незначительной физической нагрузке, ощущение перебоев в работе сердца, отеки нижних конечностей, общую слабость, быструю утомляемость.
Из анамнеза заболевания известно, что с
2009 г. страдает персистирующей формой ФП, по поводу которой получал: кордарон, конкор, варфарин, омакор.
В январе 2010 г. стал отмечать ухудшение состояния в виде прогрессирования одышки, появления отеков нижних конечностей, нарастания общей слабости. На ЭКГ регистрировалась ФП с частотой сокращения желудочков 110 ударов в минуту (рис. 1). Предпринимались две попытки электро-импульсной терапии по месту жительства – без эффекта.
В мае 2010 г. пациент был госпитализирован в нашу клинику. При поступлении состояние расценено как декомпенсация ХСН на фоне та-хисистолической формы фибрилляции предсердий, индекс EHRA – IV, ХСН – III-IV ФК по NYHA.
При объективном осмотре: акроцианоз, визуализируется пульсация шейных вен. Пульс на обеих лучевых артериях одинаковый, неритмичный – 99 ударов в минуту, дефицит пульса – 20 в минуту. При аускультации сердца: во всех аускультативных точках выслушиваются 2 тона, тоны сердца ослаблены, систолический шум в области верхушечного толчка. При аускультации легких: над всеми симметричными областями грудной клетки справа и слева выслушивается бронхиальное дыхание, мелкопузырчатые хрипы, преимущественно в нижних отделах. ЧД – 20 в мин. При пальпации: живот мягкий, безболезненный. При осмотре левого под-
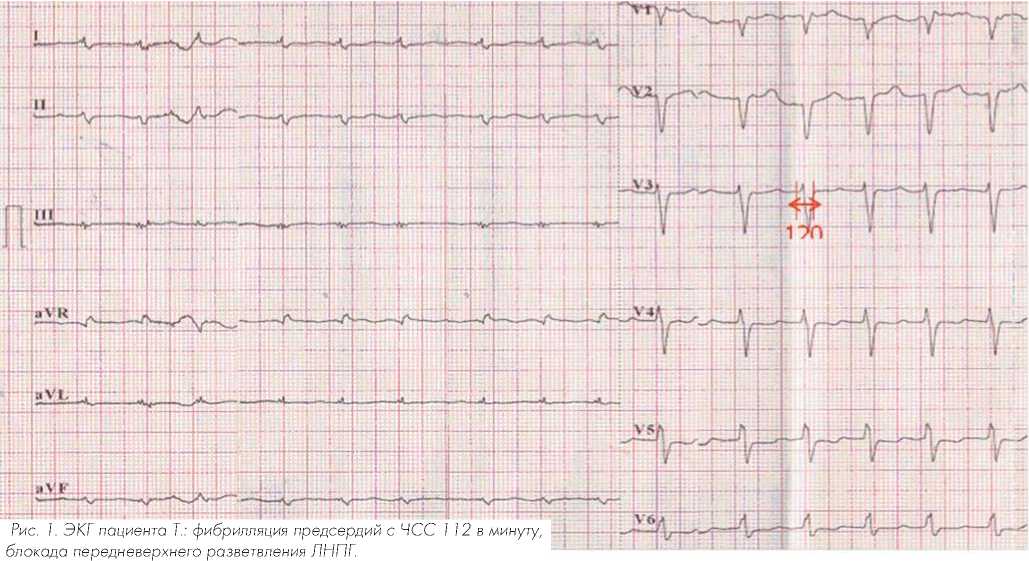
реберья видимых изменений не выявлено, нижний край селезенки пальпаторно не определяется, область правого подреберья – печень на 4 см выступает из под края реберной дуги. Отеки нижних конечностей – 2/3 голеней и стоп.
В биохимическом анализе крови отмечалось повышение уровня креатинина до 126 мкмоль/л, BNP – до 1031 пг/мл.
По данным ЭХО-КГ отмечалась выраженная дилатация всех камер сердца (КДРлж – 5,7 см, объем ЛП – 120 мл, КДРпж – 3,7 см, объем ПП – 152 мл), митральная регургитация III-IV степени, трикуспидальная регургитация III степени, систолическое давление в легочной артерии – 48 мм рт.ст., фракция выброса ЛЖ – 15%. По данным коронароангиографии окклю-зионно-стенотических изменений коронарных артерий не выявлено.
В течение 10 дней пациенту проводилась терапия, включавшая назначение: лазикс – 100 мг/сут. внутривенно, индапамид – МВ 1,5 мг/сут., верошпирон – 50 мг/сут., кордарон – 400 мг/сут., дигоксин – 0,5мг/сут. внутривенно капельно, конкор – 2,5 мг/сут., ренитек – 10 мг/сут., варфарин – 5 мг/сут., теветен – 600 мг/сут., омакор – 1 капсула вечером.
На фоне проведенного лечения отмечалось уменьшение проявлений ХСН. По данным ЭКГ – снизилась степень тахисистолии на фоне фибрилляции предсердий до 90 (средняя ЧСС). По ЭХО-КГ – уменьшение показателей объемов предсердий (ЛП – до 113 мл, ПП до – 144 мл).
-
2 этап. В июне 2011 г. пациенту была имплантирована система бивентрикулярной ЭКС (рис. 2).
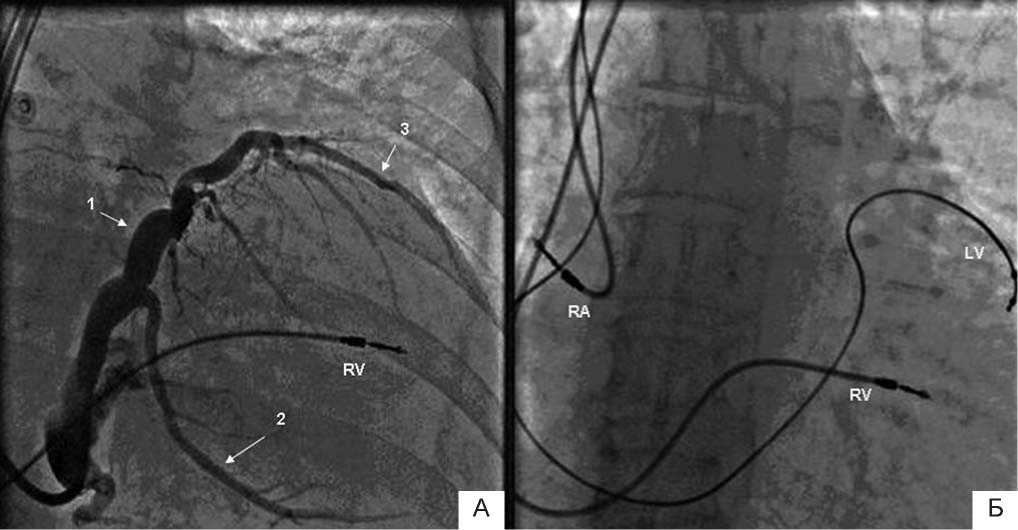
Рис. 2. Контрастирование вен сердца и позиционирование электродов в ходе имплантации КРСУ:
Панель А – рентгеновский стоп-кадр в правой косой проекции (RAO 30), зарегистрированный во время контрастирования коронарного синуса и латеральной вены сердца.
Панель Б – рентгеновский стоп-кадр в прямой проекции, иллюстрирующий положение электродов в камерах сердца. Примечание: LV – левожелудочковый электрод, RV – правожелудочковый электрод, RA – правопредсердный электрод. 1 – коронарный синус, 2 – задняя вена сердца, 3 – латеральная вена сердца.
Установлен режим стимуляции VVI BIV - 80 (рис. 3).
Через две недели после имплантации кар-диоресинхронизирующего устройства отмечалось уменьшение отечного синдрома, одышки, повышение толерантности к физической нагрузке, функциональный класс ХСН по NYHA снизился с III до II.
В биохимическом анализе крови отмечалось снижение уровня креатинина до 116 мкмоль/л (исходно 126 мкмоль/л) и BNP – до 988,7 пг/мл (исходно 1031 пг/мл). На ЭКГ – бивентрику-лярная электрокардиостимуляция в режиме VVI-BIV-80 на фоне ФП.
По данным ЭхоКГ: уменьшение размеров ЛЖ, снижение митральной и трикуспидальной
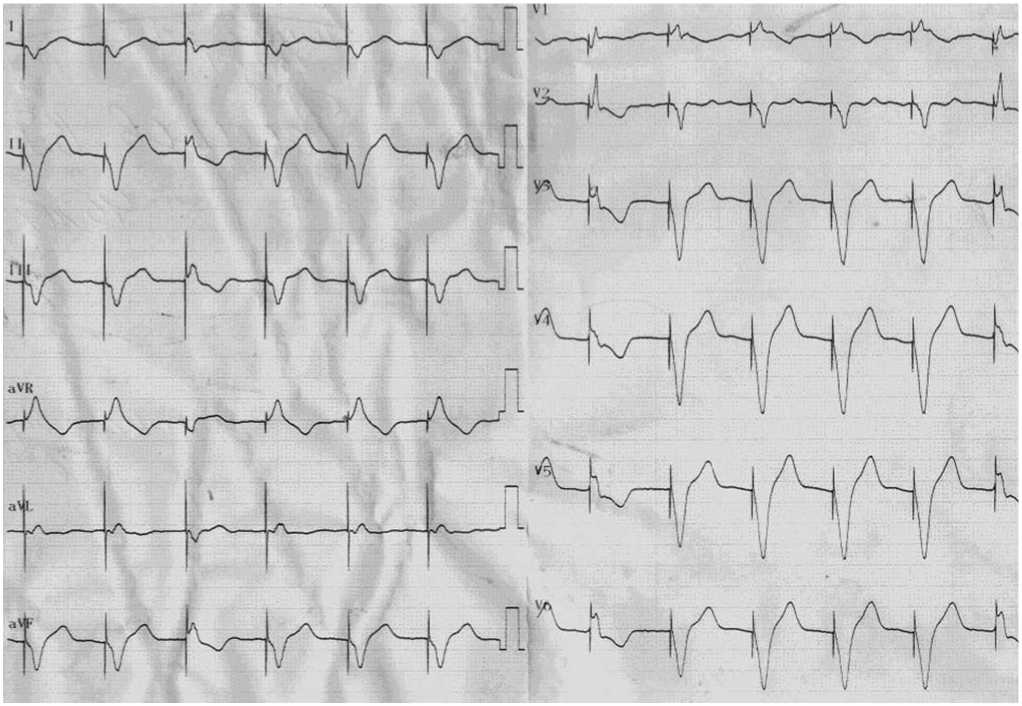
Рис. 3. 12 отведений ЭКГ, иллюстрирующих бивентрикулярную электрокардиостимуляцию (VVI-BIV-80).
регургитации до II степени, увеличение ФВ до 30% (исходно 15%).
Пациент продолжал получать медикаментозную терапию: арифон ретард – 1,5 мг/сут., ве-рошпирон – 50 мг/сут., кордарон – 200 мг/сут., конкор – 2,5 мг/сут., ренитек – 2,5 мг/сут., вар-фарин – 5 мг/сут., теветен – 600 мг/сут., омакор – 1 капсула вечером; и был выписан на седьмые сутки.
-
3 этап. В период с июля по ноябрь 2011 года состояние пациента оставалось стабильным. В ноябре 2011 года пациенту выполнена радиочастотная катетерная абляция (РЧА) фибрилляции предсердий, методом электроимпульс-ной терапии был восстановлен синусовый ритм, установлена предсердно-желудочковая ЭКС в режиме DDD-BIV-60 (Рис. 4).
Послеоперационный период протекал без особенностей. Пациент был выписан на третьи сутки после РЧА с рекомендациями приема арифона ретард – 1,5 мг/сут., верошпирона – 25 мг/сут., кордарона – 200 мг/сут., ренитека – 2,5 мг/сут., конкора – 2,5 мг/сут., теветена –
600 мг/сут., варфарина – 5 мг/сут., омакора – 1 капсула вечером.
В мае 2012 года в ходе контрольного планового обследования в нашей клинике пациент жалоб не предъявлял.
Объективно: состояние удовлетворительное. Дыхание везикулярное, хрипов нет. ЧД – 16 в мин. Тоны сердца приглушены, ритмичны, ЧСС – 60 ударов в минуту. Дефицита пульса нет. АД – 120/80 мм рт.ст. Печень не увеличена. Периферических отеков нет. Отмечалось снижение индекса EHRA до I, ХСН – до I ФК.
Лабораторно: уровень креатинина снизился до 95 мкмоль/л, показатель BNP уменьшился до 643,9 пг/мл.
На ЭКГ – предсердно-желудочковая бивен-трикулярная ЭКС (рис. 5).
По данным ЭХО-КГ – умеренное уменьшение объемов предсердий (ЛП – 93 мл, ПП – 82 мл). Митральная регургитация 2 степени. Трикуспидальная регургитация 1 степени. Легочная регургитация 1 степени. Легочная гипертензия 1 степени. ФВ увеличилась до 46% (табл).
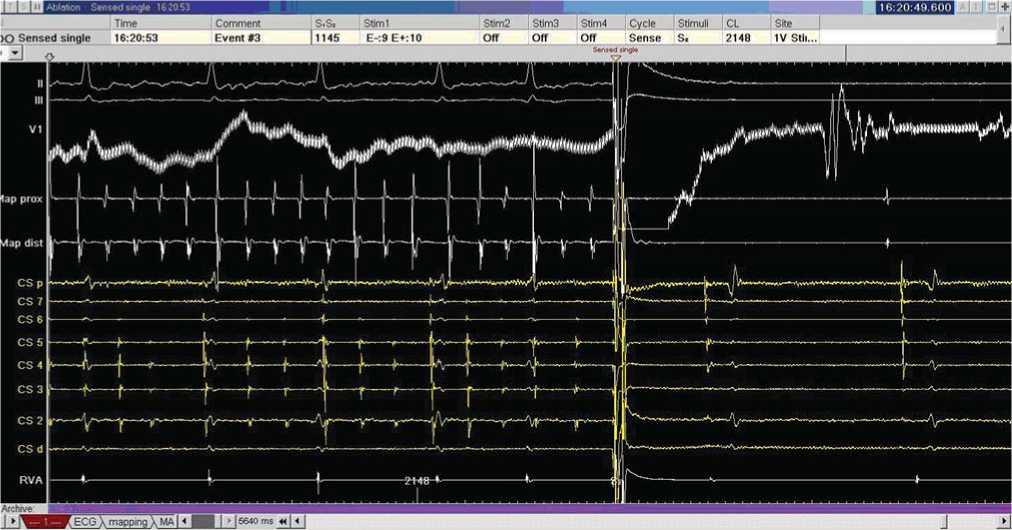
Рис. 4. Восстановление синусового ритма методом ЭИТ в ходе проведения РЧА ФП.
Сверху вниз представлены II и III отведения поверхностной ЭКГ, каналы внутрисердечной регистрации с картирующего электрода (Map prox., dist.), коронарного синуса (CSp - CSd), верхушки правого предсердия (RVA).
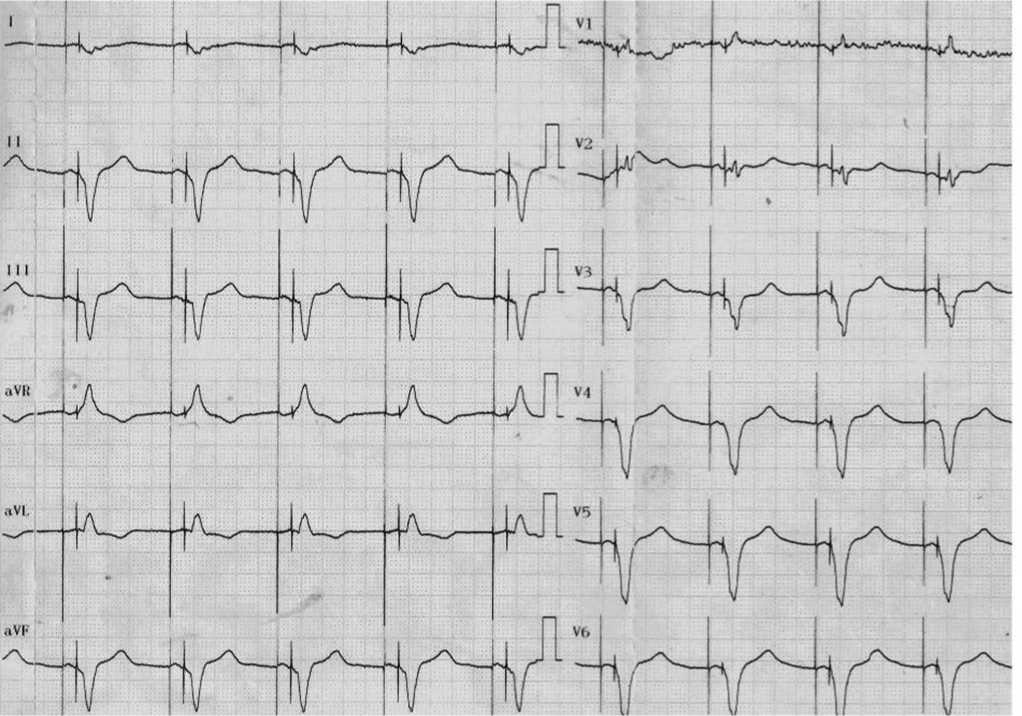
Рис. 5. 12 отведений ЭКГ пациента Т., на фоне предсердно-желудочковой бивентрикулярной ЭКС, иллюстрирующие сердечный ритм в режиме DDD-BIV-60.
Таблица
Показатели ЭХО-КГ через 6 месяцев после проведения РЧА
|
ФВ |
ЛП |
ДЛА |
МР |
|
|
Исходно |
15 % |
120 мл |
48 мм рт.ст. |
III - IV ст. |
|
После имплантации КРСУ |
30 % |
109 мл |
42 мм рт.ст. |
II ст. |
|
После РЧА |
46 % |
93 мл |
35 мм рт.ст. |
II ст. |
В таблице представлены данные ЭХО-КГ: исходно, после имплантации КРСУ и после РЧА ФП.
ФВ – фракция выброса, ЛП – левое предсердие, ДЛА – давление в легочной артерии, МР – митральная регургитация.
В настоящее время пациент получает терапию: конкор – 1,25 мг/сут., варфарин – 5 мг/сут., теве-тен – 600 мг/сут., омакор – 1 капсула вечером.
Обсуждение
Фибрилляция предсердий – одна из самых распространенных аритмий. Этим заболеванием страдают 1-2 % общей популяции с постепенным увеличением [4]. По данным Фремин-геймского исследования, ХСН повышает риск ФП в 8,5 раза у мужчин и в 14 раз – у женщин. ХСН сопровождается развитием ФП в 37% случаев [5].
Стратегическими задачами терапии ХСН являются восстановление сократительной способности сердца, ликвидация порочного круга прогрессирования декомпенсации, который в случае повышения сердечного выброса может и исчезнуть. Несмотря на значительные успехи в лечении ХСН, последняя продолжает оставаться значимой проблемой. Ближайший и отдаленный клинический прогноз у пациентов с ФП и ХСН зависит от характера основного заболевания, тяжести его течения и адекватности проводимых лечебных мероприятий.
В данном случае, тактика, использованная нами, заключавшаяся в этапном лечении, позволила оценить степень эффективности каждого этапа интервенционного лечения (РЧА ФП). Назначение на первом этапе лечения базисной медикаментозной терапии позволило нам добиться регрессирования декомпесации ХСН до стадии субкомпенсации, таким образом, удалось снизить выраженность симптомов болезни и подготовить пациента к следующему этапу.
Проведение ресинхронизирующей электрокардиостимуляции у пациентов с ХСН дает возможность нормализовать фазовую структуру сердечного цикла, добиться обратного ремоделирования левого желудочка, тем самым, это позволило нам в еще большей степени компенсировать проявления сердечной недостаточности.
Согласно рекомендациям по лечению больных с длительно персистирующей формой ФП и декомпенсацией ХСН, имплантация кардио-ресинхронизирующего устройства относится ко II B классу показаний, а проведение РЧА ФП у этих пациентов вообще не обсуждается [6, 7]. Тем не менее, получив уже на этом этапе положительную динамику в компенсации ХСН с увеличением фракции выброса вдвое, нам показалось возможным достичь еще более значительных результатов путем выполнения операции РЧА ФП. Естественно не упускались из внимания возможные в ходе операции технические сложности и отсутствие в литературе описанных случаев такой тактики лечения. Однако, взвесив все «за» и «против», оценив прогнозируемый в конечном итоге результат и степень возможного риска, опираясь на наш собственный опыт, мы приняли решение в пользу проведения этой операции. Доказательством верно принятого решения послужили позитивные результаты от проведенного лечения, подтверждаемые данными лабораторных, инструментальных исследований и существенным улучшением качества жизни пациента.
Подводя итог, можно сказать, что предложенное комбинированное этапное интервенционное лечение, заключавшееся в:
-
1) оптимизации базовой медикаментозной терапии ХСН;
-
2) имплантации КРСУ;
-
3) радиочастотной абляции фибрилляции предсердий,
и назначенная в последующем сочетанная медикаментозная терапия позволило улучшить клиническое состояние и, мы надеемся, и отдаленный прогноз у нашего пациента с тяжелой хронической сердечной недостаточностью.
Список литературы Клинические аспекты лечения пациентов с длительно персистирующей формой фибрилляции предсердий и декомпенсированной хронической сердечной недостаточностью с помощью метода РЧА и кардиоресинхронизирующей терапии
- Heeringa J., van der Kuip D.A., Hofman A. et.al. Prevalence, incidence and lifetime risk of atrial fibrillation: the Rotterdam study. Eur heart J 2006; 27: 949-953.
- Stewart S., Hart C.L., Hole D.J., McMurray J.J. A population-based study of the long-term risks associated with the atrial fibrillation: 20-year follow-up of the Renfrew. Paisley study. Am J Med 2002; 113: 359-364.
- Lloyd-Jones D.M., Wang T.J., Leip E.P. et al. Lifetime risk for development of atrial fibrillation: Framingham Heart Study. Circulation 2004; 110: 1042-46.
- Friberg J., Buch P., Scharling H., Gadsbphioll N., Jensen G.B. Rising rates of hospital admissions for atrial. fibrillation. Epidemiology 2003; 14 (6): 666-72.
- Lloyd-Jones DM, Wang TJ, Leip EP, et al. (August 2004). Lifetime risk for development of atrial fibrillation: the Framingham Heart Study. Circulation 110 (9): 1042-6.
- European society of cardiology. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. 2012.
- European society of cardiology. 2012 HRS/EHRA/ECAS expert consensus statement on catheter and surgical ablation of atrial fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, end-points, and research trial design. 2012.


