Клинические испытания аутологичной вакцины на основе опухолевых клеток, модифицированных геном tag-7
Автор: Михайлова И.Н., Демидов Л.В., Барышников А.Ю., Бурова О.С., Харкевич Г.Ю., Палкина Т.Н., Козлов A.M., Морозова Л.Ф., Вайнсон А.А., Кадагидзе З.Г., Заботина Т.Н., Буркова А.А., Дорошенко М.Б., Хатырев С.А., Носов Д.А., Тюляндин С.А., Гарин A.M., Киселев С.Л., Ларин С.С., Георгиев Г.П.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 (13), 2005 года.
Бесплатный доступ
Вакцинотерапия злокачественных новообразований с помощью геномодифицированных опухолевых клеток представляет собой новое перспективное направление. Разработан метод лечения с помощью аутологичных опухолевых клеток, трансфецированных геном tag-7. Доклинические исследования продемонстрировали специфичность in vitro и in vivo и низкую токсичность данного метода. Клинические испытания по первой фазе, проведенные у 9 пациентов с диссеминированной меланомой и раком почки, побочных эффектов не выявили. Установлено активирующее влияние данной вакцины на иммунную систему.
Короткий адрес: https://sciup.org/14054187
IDR: 14054187
Текст научной статьи Клинические испытания аутологичной вакцины на основе опухолевых клеток, модифицированных геном tag-7
Вакцинотерапия злокачественных новообразований с помощью геномодифицированных опухолевых клеток представляет собой новое перспективное направление. Разработан метод лечения с помощью аутологичных опухолевых клеток, трансфецированных геном tag-7. Доклинические исследования продемонстрировали специфичность in vitro и in vivo и низкую токсичность данного метода. Клинические испытания по первой фазе, проведенные у 9 пациентов с диссеминированной меланомой и раком почки, побочных эффектов не выявили. Установлено активирующее влияние данной вакцины на иммунную систему.
CLINICAL TRIALS OF AUTOLOGOUS VACCINE ON THE BASE OF TUMOR CELLS MODIFIED BY TAG-7 GENE
-
I .N. Mikhailova1, L.V. Demidov1, A.Yu. Baryshnikov1, O.S. Burova',
G.Yu. Kharkevich1, T.N. Palkina1, A.M. Kozlov1, L.F. Morozova1, A.A. Vainson1, Z.G. Kadagidze1, T.N. Zabotina1, A.A.Burkova1, M.B. Doroshenko1, S.A. Khatyrev1, D.A. Nosov1, S.A. Tyulyandin1, A.M. Garin1, S.L. Kiselev2, S.S. Larin2, G.P. Georgiev2
N.N. Blokhin Cancer Research Center1, RAMS, Moscow
Institute of Gene Biology2, RAMS, Moscow
Vaccinotherapy with gene-modified tumor cells was shown to be a promising treatment method for malignant tumors. The treatment method using autologous tumor cells transferred by tag-7 gene was developed. Pre-clinical investigations demonstrated specificity in vitro and in vivo and low toxicity of this method. Phase I clinical trials performed on 9 patients with disseminated melanoma and kidney cancer detected no side effects. The activated influence of this vaccine on immune system was found.
Одним из вариантов биоиммунотерапии злокачественных новообразований является вакцинотерапия с помощью облученных опухолевых клеток, трансфецированных различными генами. Применение данного вида лечения наиболее целесообразно для тех злокачественных за-
Работа выполнена при финансовой поддержке Правительства г. Москвы в рамках научно-технической программы «Разработка и внедрение в медицинскую практику новых методов и средств диагностики и лечения онкологических и других заболеваний».
болеваний, которые являются иммуногенными, например меланома, рак почки, и в силу этого способны регрессировать под влиянием специфического воздействия иммунной системы. В свою очередь, генетическая модификация опухолевых клеток позволяет повысить их иммуногенность [3], что непосредственно способствует: 1) повышению эффективности презентации антигена для взаимодействия с Т-клетками; 2) усилению костимуляции (мембранно-связы-вающие лиганды В7) и 3) обеспечению местного синтеза цитокинов (IL-2 и др.). Трансфекция опухолевых клеток генами цитокинов IFN-0C или -у восстанавливает экспрессию главного комплекса гастосовместимости первого класса (МНС I класса) на этих клетках [5, 6, 7], что не дает опухоли «уклоняться» от иммунологического надзора хозяина. С учетом успешного проведения исследований in vitro и in vivo с использованием геномодифицированных опухолевых клеток данный метод находит широкое применение в клинике. Стимуляция противоопухолевого иммунитета наблюдается при терапии аутологичными мелаыомными клетками, трансфециро-ванными геном интерлейкина-12 [9], гранулоцитарно-макрофагального колониестимулирующего фактора [8], интерлейкина-2 или интерлейкина-4 [4] .
Ранее нами охарактеризован ген tag-7, усиливающий хемотаксис и способствующий созреванию дендритных клеток [1, 2]. Проведенные на животных доклинические исследования показали возникновение противоопухолевого ответа при использовании модифицированных геном tag-7 опухолевых клеток в качестве вакцинирующего агента. Предполагается, что специфическое действие вакцины на основе опухолевых клеток, генетически модифицированных геном tag-7, основано на том, что опухолевые клетки начинают секретировать белок tag7, который является хемоатрактантом для клеток иммунной системы. Клетки, привлеченные к месту введения вакцины, процессируют опухолевые антигены, а их активация до зрелых антигенпрезентирующих дендритных клеток контролируется белком tag7. Зрелые, нагруженные опухолевыми антигенами дендритные клетки по стандартной схеме мигрируют в лимфатические узлы, где активируют Т-клетки. В свою очередь, Т-клетки, «обученные» на модифицированных опухолевых клетках, могут распознавать специфические слабые опухолевые антигены и атаковать немодифицированные опухолевые клетки в отдаленных от введения вакцины местах.
Для изучения переносимости вакцины, приготовленной из аутологичных опухолевых клеток, трансфецированных геном tag-7, оценки влияния на иммунологические параметры организма, а также отработки доз и режимов введения была проведена первая фаза клинического исследования. Оценка побочных эффектов проводилась по критериям ВОЗ.
В исследование было включено 7 больных меланомой кожи и 2 больных раком почки, проходивших лечение в Российском онкологическом научном центре им. Н.Н. Блохина в 1999-2001 гг. Среди больных было три женщины и шесть мужчин в возрасте от 40 до 68 лет. Все больные имели диссеминированный опухолевый процесс. Больным с меланомой кожи проведено комплексное лечение, включавшее в себя хирургический, химиотерапевтический и иммунотерапевтический компоненты. Больным раком почки проведена паллиативная нефрэктомия, иммунотерапия и лучевая терапия. К началу вакцинотерапии методом введения аутологичных опухолевых клеток, модифицированных геном tag-7, у всех больных отмечено выраженное прогрессирование заболевания на фоне стандартных методов лечения. Для создания вакцины использован материал, полученный хирургическим путем при удалении метастазов меланомы кожи или во время нефрэктомии. Инъекции трансфецированных облученных опухолевых клеток проводили от 1 до 8 раз с интервалом в две недели. Клетки вводили внутрикожно и подкожно в четыре точки (паховую область и область плеча). Минимальная доза составляла 500 тыс. клеток; максимальная — 20 млн клеток.
До лечения, в процессе и после его окончания больным проводили полное обследование, включающее общий и биохимический анализы крови, исследование свертывающей системы крови, рентгенографию органов грудной клетки, а также ультразвуковое исследование, компьютерную томографию (по показаниям) и оценку иммунологического статуса. Иммунологический статус контролировали с использованием моноклональных антител серии ICO, полученных в РОНЦ. Субпопуляцию лимфоцитов крови анализировали на проточном цитофлю-ориметре FACSCalibur (Becton Dickinson). На лимфоцитах периферической крови исследовали уровень экспрессии следующих маркеров: CD3, CD4, CD8, CD16, CD95, CDllb и CD38.
Получение клеточных линий
Опухолевую ткань разделяли механически на фрагменты величиной 2—3 мм3 в среде RPMI-1640, затем, используя «Cell dissociation sieve-tissue kit» (Sigma), получали суспензию клеток. Количество жизнеспособных клеток определяли по стандартной методике в камере Горяева, используя 0,5% раствор трипанового синего в PBS. Клетки культивировали в среде RPMI - 1640, содержащей 10% телячьей эмбриональной сыворотки, 2 мМ L-глутамина, 1% HEPES, пенициллин (100 ед/мл), стрептомицин (100 мкг/мл) и комплекс аминокислот и витаминов (Flow Lab.) в культуральных флаконах (Costar). Через 15 пассажей были получены стабильно растущие клеточные линии.
Транзиторная трансфекция клеточных линий
ДЛЯ проведения трансфекции использовали препараты катионных липидов серии Unifectin-21, Unifectin-56, Unifectin-M. Выбор типа и количества липидов осуществляли в предварительных экспериментах по определению максимальной эффективности трансфекции для каждой индивидуальной клеточной линии. Накануне трансфекции клетки засевали в плотности 60— 80 % монослоя. В день трансфекции смешивали ДНК и липиды в необходимых для конкретной клеточной линии пропорциях и инкубировали 30 мин. Полученную трансфекционную смесь добавляли в культуральную среду клеток, подлежащих трансфекции, и инкубировали 24 ч. Затем трансфецированные клетки снимали с культуральной поверхности с использованием Версена и проводили анализ экспрессии введенных генов методом иммуноблотинга.
Облучение вакцины проводили в суспензии, содержащей 100 тыс. клеток в 0,2 мл среды, в стерильных ампулах, имеющих объем 2,0 мл. Облучение проводили на цезиевой гамма-установке «СтебельЗА» при мощности 5 Гр/мин, при которых клетки получали дозу в 100 Гр.
Результаты и обсуждение
Семи пациентам с диагнозом диссеминированная меланома кожи и двум пациентам с диагнозом диссеминированный рак почки проведена вакцинотерапия аутологичными, трансфеци-рованными геном tag-7, опухолевыми клетками, в виде одной — восьми в/к инъекций с интервалом в две недели.
У двух пациентов отмечено повышение температуры тела до 38°С спустя 24 ч после инъекции, сопровождавшееся ознобом. К концу первых суток температура самостоятельно нормализовалась. У нескольких пациентов в области введения вакцины отмечено покраснение, обусловленное реакцией гиперчувствительности замедленного типа. Повторные введения аутологичных клеток с постепенным увеличением дозы до 20 млн клеток не сопровождались побочными реакциями. Не отмечено влияния на основные показатели периферической крови. Исследование иммунологического статуса после трёх введений позволило выявить положительную динамику активационных маркеров, NK-клеток (рис. 1). У одного пациента с диссеминированной меланомой кожи отмечена стабилизация процесса. Ниже приводим описание клинического случая.
Клинический случай
Пациент П., 35 лет, по поводу диссеминированной меланомы кожи спины (метастазы в под
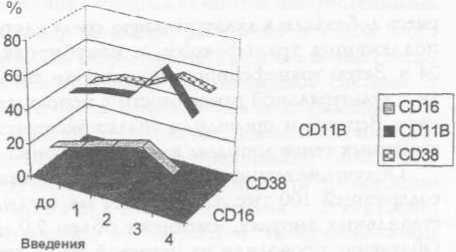
Рис. 1. Динамика экспрессии активационных маркеров на лимфоцитах периферической крови па фоне вакцинации
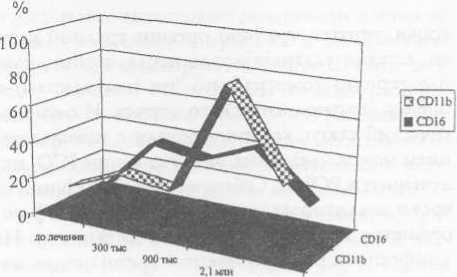
Рис. 2. Динамика экспрессии активационных маркеров на лимфоцитах периферической крови пациента П. на фоне вакцинации
мышечные, подключичные, подвздошные л/у слева; метастазы в легкие) получил многочисленные курсы химиотерапии в сочетании с иммунотерапией, без эффекта. Учитывая неэффективность стандартного лечения, пациент был включен в клинический протокол по исследованию безопасности вакцинотерапии аутологич-ными опухолевыми клетками, трансфецирован-ными геном tag-7. С этой целью произведено удаление метастатического лимфатического узла, из материала которого получена клеточная линия, характеризующаяся экспрессией диф-ференцировочного меланомного антигена (HMW— 60,4% антигенположительных клеток); экспрессией молекулы I класса главного комплекса гистосовместимости (HLA-A,B,C - 60,9% антигенположительных клеток), а также наличием экспрессии молекулы II класса главного комплекса гистосовместимости (HLA-DR —38,5% антигенположительных клеток). Клеточная линия была трансфецирована геном tag-7 и облучена. Уровень эксперессии tag-7 составил более 30%. Через месяц после последнего курса химиотерапии больному начата вакцинотерапия. Минимальная доза на введение составила 500 тыс., максимальная — 1 млн 200 тыс. клеток. Всего 6 инъекций. На протяжении трёх месяцев отмечена стабилизация процесса (отсутствие отрицательной динамики при ультразвуковом исследовании периферических лимфатических узлов и рентгенологическом исследовании легких). При исследовании иммунологического статуса выявлена активация NK-клеток, определяемых по экспрессии антигена CD16 и CDllb (рис. 2),
Заключение
Проведена I фаза клинического исследования вакцинотерапии с помощью инъекций аутологичных трансфецированных геном tag-7 и инактивированных клеток пациентам с диссеминированными формами рака (меланома кожи и рак почки). Установлена безвредность данного метода (отсутствие токсических проявлений при изучении клинических параметров). Выявлена положительная динамика активационных маркеров, NK-клеток.


