Клинические особенности течения колоректального рака у пациентов с мутациями генов EGFR-сигнального пути
Автор: Богомолова И.А., Антонеева И.И., Долгова Д.Р.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 1, 2019 года.
Бесплатный доступ
Наличие мутаций KRAS, NRAS, BRAF связывают с неблагоприятным прогнозом при колоректальном раке (КРР). В то же время отсутствует единая точка зрения на течение заболевания при проведении адъювантной химиотерапии (АХТ). Цель. Изучить мутации KRAS, NRAS и BRAF в опухоли и их влияние на клинические особенности течения колоректального рака. Материалы и методы. Материалом для исследования служили парафиновые блоки первичной опухоли КРР (n=37). С использованием геномной ДНК, выделенной из первичной опухоли, методом ПЦР в реальном времени определены наиболее часто встречающиеся мутации при КРР: ген KRAS (экзон 2, район кодонов 12-13), ген NRAS (экзон 3, район кодона 61), V600E гена BRAF. Результаты. Результаты генотипирования образцов ДНК, выделенных из парафиновых блоков первичной опухоли КРР, показали, что в 8,2 % случаев были выявлены мутации гена BRAF, в 5,4 % - гена NRAS, в 37,8 % - гена KRAS. Зависимости распределения мутаций от пола и возраста пациентов не выявлено. В аденокарциномах высокой и умеренной степени дифференцировки чаще встречались исследованные мутации. Безрецидивный период после АХТ у пациентов с выявленными мутациями в генах KRAS, NRAS, BRAF значительно меньше, чем при отсутствии мутаций. Заключение. Полученные данные позволяют предполагать, что наличие мутаций EGFR-сигнального пути (KRAS, NRAS и BRAF) повышает риск развития рецидива заболевания и является неблагоприятным прогностическим фактором.
Колоректальный рак, мутации nras, адъювантная химиотерапия
Короткий адрес: https://sciup.org/14116359
IDR: 14116359 | УДК: 616.34-006.6:616-08-059 | DOI: 10.34014/2227-1848-2019-1-60-67
Текст научной статьи Клинические особенности течения колоректального рака у пациентов с мутациями генов EGFR-сигнального пути
Введение. Колоректальный рак (КРР) является одной из наиболее распространенных злокачественных опухолей в России, а показатели заболеваемости им в мире и в России ежегодно увеличиваются. По данным за 2017 г., в Ульяновской области КРР выявляют с частотой 142,9 случая на 100 тыс. населения [1]. Продолжительность жизни больных КРР связана со степенью распространенности опухоли, наличием метастазов. При выявлении КРР на I стадии уровень пятилетней выживаемости составляет 93 %, а при прогрессировании заболевания наблюдается явное снижение выживаемости. При II стадии заболевания уровень пятилетней выживаемости снижается до 72 %, при III стадии выживаемость не превышает 45 %, при IV – 8 % [2].
Колоректальный рак представляет собой гетерогенную группу опухолей. Они отлича- ются по механизмам канцерогенеза, агрессивности течения опухолевого процесса, молекулярным изменениям, а следовательно, по чувствительности к противоопухолевому лечению и прогнозу течения болезни. Поэтому для выбора тактики лечения в настоящее время необходимо учитывать молекулярный профиль опухоли.
Ключевые изменения в процессе канцерогенеза КРР происходят в сигнальных каскадах клетки. Гены участников сигнальных каскадов являются протоонкогенами (KRAS, NRAS, BRAF, EGFR, HER2/neo, VEGFR) и антионкогенами (р53, BRCA1/2, ER, PR) [3]. Каскад, стимулируемый EGFR, является одним из основных. Он вовлечен в регуляцию роста, дифференцировки, пролиферации и апоптоза клетки. Постоянная активация EGFR-сигнального пути возникает чаще все- го в результате мутаций в генах нижележащих каскадов. Таким образом, происходит активация сигнального пути без участия EGFR.
Персонифицированная адъювантная химиотерапия (АХТ), основанная на результатах изучения мутационного статуса опухоли, была предложена в начале XXI в. Связано это с появлением препаратов, избирательно блокирующих EGFR-сигнальные пути на различных уровнях (цетуксимаб, бевацизумаб) [4]. Однако результаты ряда рандомизированных исследований не выявили значимого увеличения общей и безрецидивной выживаемости при добавлении к основной полихимиотерапии ингибиторов EGFR-сигнального пути [5, 6].
В исследовании CRYSTAL было показано, что у пациентов с «диким типом» KRAS добавление к стандартной АХТ цетуксимаба было значимо эффективнее по сравнению с группой пациентов с мутацией генов KRAS [7]. В настоящее время Ассоциация онкологов России рекомендует назначение двухкомпонентной АХТ пациентам с III стадией заболевания, а также со II стадией заболевания при сочетании с неблагоприятными факторами риска (менее 12 исследованных лимфоузлов, сосудистая и/или периневральная инвазия, низкая степень дифференцировки, кишечная непроходимость, рT4 стадия).
KRAS – это протоонкоген с собственной активностью фермента, гидролизирующего гуанозинтрифосфат (ГТФаза). Мутации в гене KRAS приводят к активации сигнального пути рецептора эпидермального фактора роста (EGFR). Активация EGFR запускает сигнальный каскад через RAS-RAF-MEK-MAPK- и PI3K-AKT-путь, тем самым приводя к стимуляции ангиогенеза и метастазирования, повышению в опухолевых клетках пролиферации [8]. Мутации в гене KRAS – это наиболее частые генетические изменения, возникающие на ранних этапах канцерогенеза КРР. Чаще всего они происходят в 12-м, 13-м кодонах гена KRAS и являются одним из возможных факторов химиорезистентности [9].
Мутации NRAS встречаются гораздо реже, примерно в 1–6 % случаев КРР. Наличие «дикого типа» NRAS вместе с «диким ти- пом» KRAS связано с хорошим ответом на анти-EGFR-терапию [10]. В работе А.В. Беляевой (2012) установлено, что риск метастазирования у больных с мутацией в гене KRAS выше, чем у больных с «диким типом». Чаще мутации в гене KRAS встречаются у пациентов с III стадией заболевания, реже – при II стадии [11].
BRAF – протоонкоген, являющийся членом семейства киназ RAF. Он, как и KRAS, участвует в сигнальном пути RAS-RAF-MEK-MAPK. Генетические повреждения BRAF приводят к его постоянной стимуляции, и BRAF начинает непрерывно передавать стимулы по RAF-MEK-MAPK-пути, запуская процессы клеточного деления [12]. Мутационный статус генов BRAF и KRAS находится в реципрокных взаимоотношениях. Таким образом, если при КРР обнаруживается активация KRAS, то нарушение в кодоне 600 гена BRAF практически исключено; если в опухоли наблюдается мутация KRAS, то статус BRAF почти всегда остаётся нормальным [13, 14]. В рамках исследований NSABP C07 и C08 при анализе результатов АХТ при КРР наихудший прогноз и низкая выживаемость были ассоциированы с мутацией в гене BRAF [15]. В настоящее время рекомендуется выполнять молекулярно-генетическое тестирование на мутации RAS и BRAF, если выявлены отдаленные метастазы аденокарциномы толстой кишки, так как это может повлиять на выбор таргетных препаратов в лечении метастатического процесса [16].
Цель исследования. Изучить мутации EGFR-сигнального пути в первичной опухоли и их влияние на клинические особенности течения колоректального рака.
Материалы и методы. В исследование включено 37 пациентов с верифицированным диагнозом «колоректальный рак» (характеристика больных представлена в табл. 1). Все они проходили лечение в Ульяновском областном клиническом онкологическом диспансере в период с 2014 по 2018 г. Критериями включения явились впервые диагностированный и верифицированный КРР IIA–IIIB стадии, гистологический тип – аденокарцинома толстой кишки, общее состояние больных по шкале Easten Cooperative Oncology Group –
0±1 балл, ожидаемая продолжительность жизни – более 12 мес. Исследование выполняли в соответствии с Хельсинкской декларацией 1964 г. (модифицированной в 1975 и 1983 гг.). Получено разрешение локального этического комитета ИМЭиФК ФГБОУ ВО «Ульяновский государственный университет» (протокол № 9 от 15.09.2017). Все пациенты подписали информированное согласие. После радикального оперативного вмешательства оптимальный объем адъювантной химиотерапии при II–III стадиях включал в себя комбинацию оксалиплатина с фторпиримидинами в течение 6 мес. – режимы FOLFOX или XELOX. Оценка клинико-морфологических параметров включала в себя определение уровня онкомаркеров РЭА и СА-19/9 в динамике лечения, степени дифференцировки, периода безрецидивной выживаемости (от последнего курса полихимиотерапии).
Таблица 1
Характеристика больных КРР, включенных в экспериментальную группу
|
Показатель |
Количество больных, чел. |
|
Пол: |
|
|
мужской |
18 |
|
женский |
19 |
|
Возраст, лет: |
|
|
25–44 |
5 |
|
45–59 |
20 |
|
60–75 |
12 |
|
Стадия заболевания: |
|
|
II |
11 |
|
III |
26 |
|
Локализация опухоли: |
|
|
слепая кишка |
2 |
|
сигмовидная кишка |
9 |
|
ободочная кишка |
17 |
|
прямая кишка |
9 |
|
Степень дифференцировки: |
|
|
низкодифференцированная |
3 |
|
умереннодифференцированная |
21 |
|
высокодифференцированная |
13 |
В качестве исследуемого материала использованы парафиновые блоки первичной опухоли КРР. Для последующего выделения ДНК были получены срезы опухоли участков, содержащих минимум 70–80 % опухолевых клеток, толщиной 10–15 мкм. Для выделения геномной ДНК, пригодной для дальнейшей ПЦР в реальном времени, использован набор ExtractDNA FFPE (ООО «Евроген», Россия). Качество и количество выделенной ДНК оценивали при помощи набора Quantum DNA: в 90 % образцов не выявлялись ингибиторы ПЦР, эффективная концентрация фрагментов ДНК находилась в диапазоне 1,5–23,5 нг/мкл. Для определения наиболее часто встречаю- щихся мутаций при КРР использованы наборы «Инсайдер KRAS-2», «Инсайдер NRAS-3» («НОМОТЕК», г. Москва, РФ) (ген KRAS – экзон 2, район кодонов 12–13, ген NRAS – экзон 3, район кодона 61) и наборы производства ЗАО «Синтол», (г. Москва) (V600E гена BRAF). Принцип метода – мутационноспецифическая ПЦР-РВ с использованием модифицированного зонда-блокатора, подавляющего амплификацию фрагментов ДНК без мутаций в области «горячих точек».
Во время и после прохождения АХТ пациенты с КРР находились под динамическим наблюдением (онкомаркеры РЭА и СА-19/9, УЗИ органов брюшной полости, забрюшин- ного пространства, рентгенография органов грудной клетки в двух проекциях, ФКС).
Различия между экспериментальными группами оценивали с применением непараметрического критерия Манна–Уитни (Stata 6.0).
Результаты и обсуждение. Изучение мутационного статуса первичной опухоли КРР показало, что в данной выборке пациентов в 51,4 % случаев (n=19) были выявлены мутации KRAS, NRAS, BRAF: в 8,2 % случаев – BRAF, в 5,4 % – NRAS, в 37,8 % – KRAS (рис. 1). Наши данные согласуются с данными экспериментальных работ по изучению конкордантности мутации генов между первичной опухолью и метастазами рака толстой кишки, свидетельствующими о том, что частота встречаемости мутаций при КРР для генов KRAS, NRAS составляет 35–50 %, для гена BRAF – 5–10 % [17].
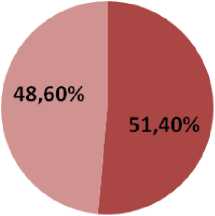
■ КРР с мутациями BRAF, nRAS, kRAS КРР без мутаций
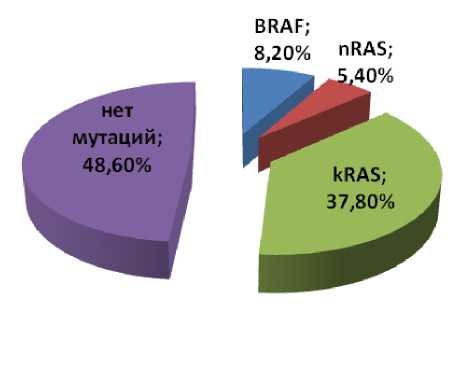
Рис. 1. Частота встречаемости мутаций KRAS, NRAS, BRAF у больных КРР
Зависимости распределения мутаций от пола пациента с КРР не выявлено. Возраст на момент постановки диагноза у пациентов с мутациями и без них также значимо не отличался и составлял 57,1±2,1 и 52,3±3,3 года соответственно.
При наличии любой из исследованных мутаций чаще всего встречалась высокодифференцированная (57,9 %) или умереннодифференцированная (42,1 %) аденокарцинома (рис. 2). В группе пациентов, в опухоли которых не выявлены исследованные мутации KRAS, NRAS, BRAF, чаще отмечалась умеренная степень дифференцировки (57,9 %).
Нами установлено, что наличие мутаций KRAS в опухоли не коррелировало со стадией заболевания. Мутация гена BRAF была выявлена на II стадии заболевания в 75 % случаев и на III стадии – в 25 %. Во всех случаях выявления мутаций в гене NRAS была диагностирована III стадия заболевания. При наличии любой из исследованных мутаций чаще всего возникали метастазы в легкие
(66,7 %), печень и забрюшинные лимфоузлы (33,3 %). У большинства пациентов при рецидиве с метастазами в легкие выявлена мутация гена KRAS, что соотносится с литературными данными [17].
Течение КРР при отсутствии мутаций EGFR-сигнального пути (wild type) характеризуется более длительным периодом безре-цидивной выживаемости. Метастазы в печени встречались в 50 % случаев, в забрюшинных лимфоузлах, лимфоузлах средостения – в 33,5 %, в легких – в 16,5 %.
В стандартах ведения пациентов с КРР указано, что во время АХТ необходим контроль процесса при помощи оценки уровня онкомаркеров – РЭА и СА-19/9. Установлено, что при наличии мутации KRAS, NRAS, BRAF изменения РЭА и СА-19/9 в динамике лечения минимальны (рис. 3). У пациентов с КРР без выявленных мутаций в процессе лечения наблюдалось значительное снижение уровня СА-19/9, уровень РЭА в середине ХТ выра-женно снижался, к концу лечения – возрастал.
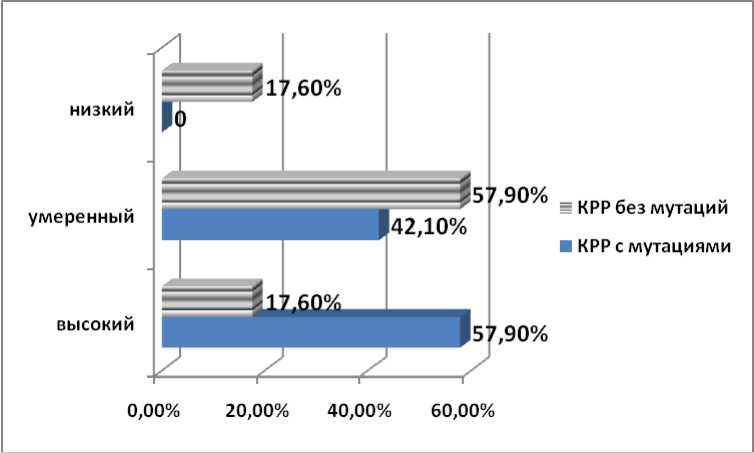
Рис. 2. Степень дифференцировки первичной опухоли при КРР в зависимости от наличия или отсутствия мутаций генов EGFR-сигнального пути
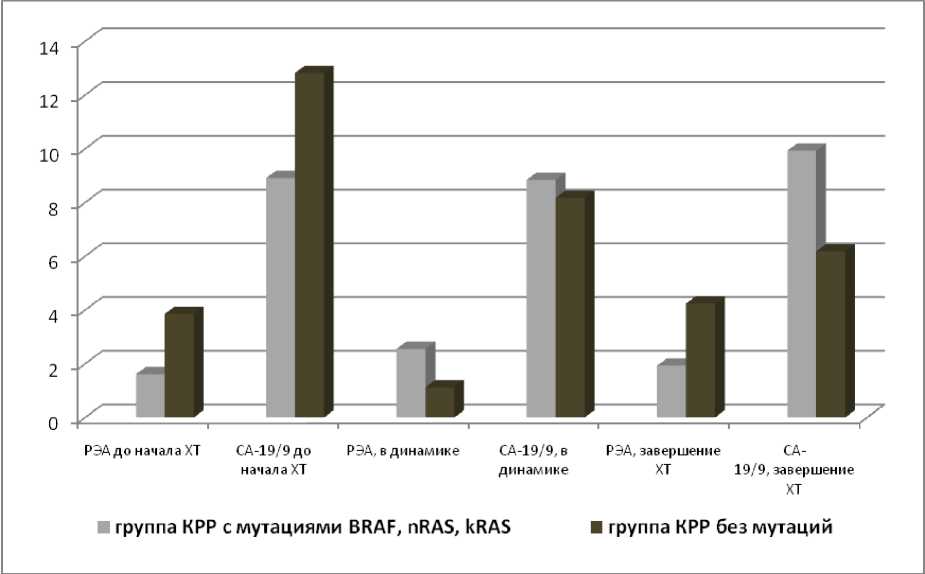
Рис. 3. Уровень онкомаркеров РЭА и СА-19/9 в сыворотке крови больных КРР при динамическом наблюдении в зависимости от наличия мутаций KRAS, NRAS, BRAF
Выявление мутаций KRAS, NRAS, BRAF при КРР связывают с неблагоприятным прогнозом, а также с устойчивостью к антителам против EGFR [18]. Нами показано, что безре-цидивный период после АХТ по схеме FOLFOX в группе пациентов с КРР с выявленными мутациями в генах KRAS, NRAS,
BRAF значительно меньше, чем при их отсутствии, – 11,5±3,2 против 20,4±11,1 мес.
Высокая частота мутаций генов EGFR-сигнального пути в опухолях толстой кишки говорит о потенциально низкой чувствительности и даже резистентности к стандартным схемам ПХТ (FOLFOX, XELOX). Таким об- разом, эмпирический подход к выбору противоопухолевого лечения, используемый в настоящее время, сводит пользу от АХТ к минимуму. Изучение мутационного статуса опухоли сможет индивидуализировать адъювантную терапию больных КРР и даст возможность использовать специфическую терапию на основе молекулярных маркеров для достижения максимального лечебного эффекта.
Заключение. Наличие мутаций EGFR-сигнального пути является неблагоприятным прогностическим фактором. Целесообразно раннее определение мутационного статуса опухоли до момента прогрессирования заболевания. Это позволит врачу-химиотерапевту сформировать группы риска пациентов, резистентных к ХТ по схемам FOLFOХ и XELOX.
Список литературы Клинические особенности течения колоректального рака у пациентов с мутациями генов EGFR-сигнального пути
- Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2017 году. М.: МНИОИ им. П.А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России; 2018. 236.
- Пророков В.В., Власов О.А., Тупицын Н.Н. Современное состояние проблемы лечения и прогноза колоректального рака. Вопросы онкологии. 2014; 60, 2 (114): 28-33.
- Benvenuti S., Sartore-Bianchi A., Di Nicolantonio F., Zanon C., Moroni M., Veronese S., Siena S., Bardelli A. Oncogenic activation of the RAS/RAF signaling pathway impairs the response of metastatic colorectal cancers to anti-epidermal growth factor receptor antibody therapies. Cancer Res. 2007; 67: 2643-2648.
- Трякин А.А. Таргетная терапия колоректального рака, рака желудка поджелудочной железы. Практическая онкология. 2010; 11 (3): 143-150.
- Allegra C.J., Yothers G., O'Connel M.J., Sharif S., Petrelli N.J., Lopa S.H., Wolmark N. Bevacizumab in stage II-III colon cancer: 5-year update of the nationa surgical adjuvant breast and bowel project C08 trial. Journal of clinical oncology. 2013; 31 (3): 359-364.
- Gramont A., Van Cutsem E., Schmoll H.J., Tabernero J., Clarke S., Moore M.J., Cunningham D., Cartwright T.H., Hecht J.R., Rivera F., Im S.A., Bodoky G., Salazar R., Maindrault-Goebel F., ShachamShmueli E., Bajetta E., Makrutzki M., Shang A., André T., Hoff P.M. Bevacizumab plus oxalipla-tin-based chemoterapy as adjuvant treatment for colon cancer (AVANT): a phase 3 randomised controlled trial. The Lancet. Oncology. 2012; 13 (12): 1225-1233.
- Van Custem E., Lenz H-J., Kohne C.-H., Heinemann V., Tejpar S., Melezinek I., Beier F., Stroh C., Rougier P., Van Krieken J.H., Ciardiello F. Fluorouracil, Leucovarin, and Irinotecan plus Cetuximab treatment and RAS mutations in colorectal cancer. Journal of clinical oncology. 2015; 33 (7): 692-700.
- Bassim J.A., Itrat M. Expanding Role of Bio Markers in Colo-Rectal Cancer (CRC). Int. J. Cell. Sci & Mol. biol. 2017; 3 (1): 555-605.
- Brink M., de Goeij A.F., Weijenberg M.P. K-ras oncogene mutations in sporadic colorectal cancer in The Netherlands Cohort Study. Carcinogenesis. 2003; 24 (4). 703-710.
- Cutsem V.E., Dicato M., Arber N., Berlin J., Cervantes A. Molecular markers and biological targeted therapies in metastatic colorectal cancer: expert opinion and recommendations derived from the 11th ESMO/World Congress on Gastrointestinal Cancer, Barcelona, 2009. Ann. Oncol. 2010; 21 (suppl. 6): 1-10.
- Беляева A.B., Янус Г.А., Суспицын E.H., Зайцева O.A., Яцук О.С., Моисеенко А.Б., Гуляев A.B., Имянитов E.H. Возрастные и клинико-патогенетические особенности колоректального рака, ассоциированные со статусом гена k-ras. Успехи геронтологии. 2012; 25 (1): 40-45.
- Пасевич Д.М., Сушков С.А., Семенов В.М. Молекулярная генетика в диагностике злокачественных новообразований. Новости хирургии. 2014; 24 (2): 184-192.
- Имянитов Е.Н. Стандартные и потенциальные маркеры при опухолях желудочно-кишечного тракта. Практическая онкология. 2012; 13 (4): 219-228.
- Farina-Sarasqueta A., Lijnschoten G., Moerland E., Creemers G.J., Lemmens V.E., Rutten H.J., van den Brule A.J. The BRAF V600E mutation is an independent prognostic factor for survival in stage II and stage III colon cancer patients. Ann. Oncol. 2010; 21 (12): 2396-2402.
- Gavin P.G., Colangelo L.H., Fumagalli D., Tanaka N., Remillard M.Y., Yothers G., Kim C., Taniyama Y., Kim S.I., Choi H.J., Blackmon N.L., Lipchik C., Petrelli N.J., O’Connell M.J., Wolmark N., Paik S., Pogue-Geile K.L. Mutation profiling and microsatellite instability in stage II and III colon cancer: an assessment of their prognostic and oxaliplatin predictive value. Clin. Cancer Res. 2012; 18 (23): 6531-6541.
- Федянин М.Ю., Гладков О.А., Гордеев С.С., Рыков И.В., Трякин А.А. Практические рекомендации по лекарственному лечению злокачественных опухолей. Злокачественные опухоли. 2017; 7, 3 (2): 261-277.
- Федянин М.Ю., Строгонова А.М., Сендерович А.И., Дранко С.Л., Козлов Н.А., Трякин А.А., Сехина О.В., Эльснукаева Х.М., Буланов А.А., Покатаев И.А., Подлужный Д.В., Гордеев С.С., Расулов А.О., Тюляндин С.А. Изучение конкордантности мутационного статуса генов KRAS, NRAS, BRAF, PIK3CA между первичной опухолью и метастазами рака толстой кишки. Злокачественные опухоли. 2017; 7 (2): 6-13.
- Трякин А.А., Артамонова Е.В., Болотина Л.В., Гордеев С.С., Моисеенко В.М., Расулов А.О., Секачева М.И., Федянин М.Ю. Практические рекомендации по лекарственному лечению рака прямой кишки. Злокачественные опухоли. 2016; 4 (2): 248-265.


