Клинические случаи эффективного применения агностического подхода в терапии опухолей с мутацией BRAF V600E
Автор: Прокудина Н.В., Крамчанинов М.М.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Клинический случай
Статья в выпуске: 1 т.14, 2024 года.
Бесплатный доступ
Одним из новых направлений персонализированной онкологии стал агностический (tumor-agnostic) подход, подразумевающий выбор препарата в первую очередь на основе генетических аберраций и сигнальных путей, на которые он воздействует, независимо от локализации опухоли. Первым препаратом, разрешенным к применению при нерезектабельных опухолях любых локализаций с высокой микросателлитной нестабильностью (MSI-H), стал пембролизумаб. В 2022 году комбинация дабрафениба и траметиниба получила одобрение Управления по контролю качества пищевых продуктов и лекарственных средств США (FDA) для лечения пациентов с солидными опухолями с мутацией BRAF V600E. Мутации в гене braf встречаются в 60% случаев меланомы, 15% случаев колоректального рака и 5-8% - немелкоклеточного рака легкого. Кроме того, мутации в этом гене также встречаются при глиобластоме (3%), холангиокарциноме (5-7%), раке поджелудочной железы (1-16%) и гистиоцитозе клеток Лангерганса (57%). Представляем описание двух клинических случаев применения комбинации дабрафениба и траметиниба при BRAF-мутированном раке слюной железы и раке поджелудочной железы после прогрессирования на стандартной терапии, в основе которых лежит агностический подход к выбору тактики лечения. Представленные клинические случаи показывают, что следование агностическому подходу и применение BRAF/MEK ингибиторов в терапии BRAFпозитивных опухолей позволяет достичь стабилизации болезни даже у пациентов с обширным метастазированием, а также предоставляет дополнительную терапевтическую опцию для лечения редких опухолей с мутацией в гене braf, для которых существующие варианты лекарственной терапии сильно ограничены.
Агностический подход, braf-позитивные опухоли, таргетная терапия
Короткий адрес: https://sciup.org/140305814
IDR: 140305814 | DOI: 10.18027/2224-5057-2024-14-1-92-98
Текст научной статьи Клинические случаи эффективного применения агностического подхода в терапии опухолей с мутацией BRAF V600E
К созданию индивидуального подхода в лечении пациентов, получившего название «персонализированной» или «прецизионной медицины», привело широкое распространение молекулярного профилирования опухолей в клинической практике. В противовес к стандартному подходу, предполагающему подбор цитостатической терапии на основе происхождения опухоли, ее локализации, гистологического подтипа и классификации на основе критериев TNM, целью прецизионной медицины является определение наилучшей терапии для пациентов на основе фармакогеномных биомаркеров, полученных в результате молекулярно-генетического анализа опухолевого материала [1,2]. Одним из новых направлений персонализированной онкологии стал агностический (tumor-agnostic) подход, подразумевающий выбор препарата в первую очередь на основе генетических аберраций и сигнальных путей, на которые он воздействует, независимо от локализации опухоли. В 2017 году FDA выдало первое разрешение на применение препарата в рамках агностического подхода — пембролизумаба — для лечения пациентов с нере-зектабельными или метастатическими опухолями с MSI-H, а в 2022 году комбинация дабрафениба и траметиниба получила одобрение для лечения пациентов с солидными опухолями с мутацией BRAF V600E [3,4].
Онкоген BRAF кодирует серин/треониновую протеин-киназу BRAF, участвующую в передаче пролиферативного сигнала с мембранных тирозинкиназных рецепторов к клеточному ядру и играющую важную роль в пролиферации и дифференцировке клеток [5]. Мутации в гене braf обнаруживаются примерно в 7–15% всех видов рака и активируют онкогенез в злокачественных новообразованиях различного происхождения. Согласно проекту «The Cancer Genome Atlas», мутации в гене braf встречаются в 60 % случаев меланомы, 60% опухолей щитовидной железы, 15% случаев колоректального рака и 5–8% — немелкоклеточного рака легкого [6]. Кроме того, мутации в этом гене также встречаются при глиобластоме (3%), холангио-карциноме (5–7%), волосатоклеточном лейкозе (79–100%), множественной миеломе (4%), раке поджелудочной железы (1–16%) и гистиоцитозе клеток Лангерганса (57%) [7]. Выявлено и охарактеризовано порядка 30 мутаций в гене braf , среди которых наиболее часто встречается мутация
BRAF V600E — замена валина на глутаминовую кислоту в 600 кодоне [8].
Опухоли с мутацией BRAF V600 успешно отвечают на таргетную терапию BRAF/MEK — ингибиторами: BRAF-ингибитор дабрафениб в комбинации с MEK-ингибитором траметинибом зарегистрированы в России для лечения нерезектабельной и метастатической меланомы кожи с мутацией BRAF V600, а также метастатического немелкоклеточного рака легкого [9,10]. В то же время в 2022 году FDA в ускоренном порядке одобрило комбинацию дабрафе-ниба и траметиниба для лечения взрослых и детей старше 6 лет с неоперабельными или метастатическими опухолями с мутацией BRAF V600E независимо от вида опухоли [11].
Представляем описание двух клинических случаев применения комбинации дабрафениба и траметиниба при BRAF-мутированном раке слюной железы и раке поджелудочной железы после прогрессирования на стандартной терапии, в основе которых лежит агностический подход к выбору тактики лечения.
КЛИНИЧЕСКИЙ СЛУЧАЙ № 1
Пациент N., на момент выявления заболевания — 46 лет. В августе 2020 года обратился по месту жительства с жалобами на уплотнение в области левой слюнной железы. После обследования 16 сентября 2020 г. была выполнена резекция левой околоушной слюнной железы. На основании гистологического исследования у пациента верифицирована мультицентрическая миоэпителиальная карцинома левой околоушной слюнной железы G1, рT2N0M0 — II стадия. После радикального лечения в сентябре 2020 г. пациент находился под динамическим наблюдением. В феврале 2021 г. пациент отметил увеличение шейных лимфоузлов и обратился за консультацией в МНИОИ им. П.А. Герцена. 20 апреля 2021 г. была выполнена пункция лимфоузла, в мае 2021 г. — радикальная лимфаденэктомия слева (операция Крайля).
По результатам иммуногистохимического исследования от 12 мая 2021 г. картина складывалась в пользу миоэпителиальной карциномы слюнной железы. При контрольном обследовании в июле 2021 г. были обнаружены метастазы в головной мозг, в аксиллярные, шейные лимфоузлы, мягкие ткани и кожу туловища, головы. По поводу двух метастатических очагов в головном мозге пациенту проводилось радиохирургическое лечение с применением системы «КиберНож» (СОД 35 Гр). По результатам КТ (компьютерной томографии) от 08 августа 2021 г. дополнительно обнаружено метастатическое поражение костей левой предплюсны, 2 плюсневой кости. Клинически пациента сопровождал болевой синдром, для купирования которого в сентябре пациенту был проведен курс паллиативной лучевой терапии на зону левой стопы (СОД 26 Гр.).
По результатам обследований от октября 2021 г. у пациента отмечалась отрицательная динамика в виде появления кортикального очага в правой лобной доле размером 21 ×23 мм и в левой теменной доле до 7 мм с перифокальным отеком, множественного поражения периферических, внутригруд-ных, мезентериальных, забрюшинных и тазовых лимфоузлов. В обеих долях печени визуализировались множественные образования до 38 мм. В теле правого надпочечника — образование 9×15 мм, транзиторно накапливающее контраст. Остеолитическая деструкция левой лопатки 26 × 12 мм. По результатам пересмотра гистологического материала, полученного после операции Крайля, от 06.10.2021 подтверждена высокодифференцированная мультицентрическая миоэпителиальная карцинома G1, без инвазии в псевдокапсулу лимфатического узла и за ее пределы.
Помимо гистологического подтверждения природы прогрессирования, в октябре 2021 г. пациенту также выполнено молекулярно-генетическое тестирование и выявлена соматическая мутация V600Е в 15 экзоне гена braf . В связи с неэффективностью ранее проводимого лечения, множественными метастазами и наличием мутации BRAF V600E, онкологическим консилиумом было принято решение о назначении таргетной терапии по схеме: дабрафениб 300 мг ежедневно + траметиниб 2 мг ежедневно + дено-сумаб. Терапия начата 16 ноября 2021 г. На начало терапии общее состояние пациента оценивалось на 3 балла по пятибальной шкале ECOG (Eastern Cooperative Oncology Group), которая используется для оценки общего состояния онкологического больного и было обусловлено болевым синдромом 3 ст. В течение первого месяца терапии отмечалось значительное улучшение общего состояния, регресс мягкотканных изменений, болевого синдрома, пациент начал передвигаться самостоятельно.
На фоне лечения 03 января 2022 г. выполнен КТ контроль очагов в головном мозге: очаг в правой лобной области 15 × 15 мм (ранее 21 × 23 мм) без накопления контрастного вещества. В теменно-затылочной области слева вазогенный отек 52 × 73 × 55 мм с положительным масс-эффектом. 21 января 2022 г. выполнена ПЭТ-КТ (позитронно-эмиссионная томография с компьютерной томографией) всего тела: в левой теменной доле очаг 19 × 19 × 18 мм неоднородного накопления РФП (радиофармацевтического препарата) (индекс накопления = 1,31). В сравнении с КТ от 01.22 г. отмечается частичный регресс отечных изменений. В правой лобной доле накопления РФП не выявлено. В печени множественные низкоплотные очаги до 6 мм без накопления РФП. Определяется накопление РФП в очаге 35 × 27 мм в мягких тканях шеи до SUVmax (Standardized Uptake Value — стан- дартизированный уровень захвата РФП) = 2,04. В костях множественные литические и смешанные очаги, наиболее активные в головке и шейке левой плечевой кости, в вертельной области левой бедренной кости, в в/3 диафиза правой большеберцовой кости, в костях предплюсны и плюсны левой стопы, SUVmax до 3,08. В лимфатических узлах накопления РФП не выявлено. У пациента наблюдалась выраженная положительная динамика. Терапия препаратами дабрафениб и траметиниб продолжена в полном объеме при удовлетворительной переносимости.
23 марта 2022 г. выполнен ПЭТ-КТ контроль всего тела: в печени очагов фиксации РФП не выявлено; в толще брыжейки слева кистозно-солидное образование (более вероятно, увеличенный мезентеральный л/у с признаками центрального некроза) увеличенный л/у размерами 35 × 44 с SUV = 5,5; мяготканное образование 14 × 17 мм с SUV = 5,56 в области малого таза, в подкожно-жировой клетчатке поясничной области слева — уплотнение диаметром 6 мм с SUV = 2,42, в остистом отростке Th3 позвонка остеолитический очаг размерами 16 × 12 мм с SUV = 7,9; в мягких тканях правого и левого плеча уплотнения размерами до 11 × 29 мм с SUV = 2,63; в мягких тканях бедра слева образование размерами 8 × 8 мм с SUV = 6,51. По результатам обследования, у пациента наблюдалась стабилизация заболевания.
Однако с конца марта 2023 года пациент стал отмечать выраженное ухудшение самочувствия. В ходе обследования у него выявлена анемия (Hb 82 г/л, назначен эритропоэтин 500 мкг, Fe в/в). По результатам фиброгастродуодено-скопии от 26 марта 2022 г. — эритематозная гастропатия, фиброколоноскопии от 31 марта 2022 г. — полип в прямой кишке 7 мм. С 09 апреля 2022 г. по 12 апреля 2022 г. пациент находился в больнице скорой помощи с признаками острого панкреатита; при обследовании патологии ЖКТ не выявлено, и пациент был выписан под наблюдение терапевта.
Уже 23 апреля 2022 г. у пациента вновь появились жалобы на боли в животе в левой мезогастральной области, тошноту, рвоту, общую слабость. 25 апреля 2022 г. — повторная госпитализация по показаниям в хирургическое отделение с диагнозом хронический панкреатит, обострение. В дальнейшем у пациента стремительно ухудшалось состояние, нарастал астенический синдром. В мае 2022 г. пациент был переведен в отделение паллиативной медицинской помощи, где в июне скончался на фоне признаков полиорганной недостаточности, связанной с прогрессированием основного заболевания.
Гистологический материал из метастаза шейного л/у, на основании которого был установлен первоначальный диагноз) был направлен на пересмотр в НМИЦ онкологии им. Н.Н. Петрова. По результатам гистологического исследования от 26 июня 2022 г. получено следующее заключение: морфологическая картина и иммунофенотип наиболее соответствуют метастазам эпителиоидноклеточной беспигментной меланомы, не менее 1,5 см в наибольшем измерении, без экстранодального распространения.
Таким образом, клиническое мышление, мультидисци-плинарный подход, правильно подобранный диагностический алгоритм и осведомленность специалистов о воз- можности применения агностического подхода к выбору лечения у онкологического пациента позволили предложить больному эффективную терапию даже в случае ошибочно поставленного диагноза «Рак левой околоушной слюнной железы с метастазами в головной мозг, множественными метастазами в печени и лимфатических узлов». Общая продолжительность таргетной терапии комбинацией препаратов дабрафениб и траметиниб до ухудшения у нашего пациента составила около 6 месяцев.
КЛИНИЧЕСКИЙ СЛУЧАЙ № 2
Пациент Д., 1958 года рождения, в октябре 2020 года заболел COVID-19, в связи с чем был направлен на КТ исследование грудной и брюшной полостей, в результате которого было выявлено образование в проекции поджелудочной железы. В связи с отсутствием рекомендаций, пациент регулярно самостоятельно выполнял КТ органов брюшной полости и МРТ, за помощью ни к кому не обращался.
В августе 2021 г. у пациента по данным МРТ брюшной полости наблюдалась картина объемного образования головки поджелудочной железы, умеренная панкреатическая гипертензия с признаками инвазии парапанкреатической клетчатки, инвазия воротной вены, забрюшинная лимфаденопатия. По результатам КТ ОБП картина объемного образования поджелудочной железы, лимфаденопатия регионарных и забрюшинных л/узлов, инвазия верхней брыжеечной вены и канцероматоз брюшины.
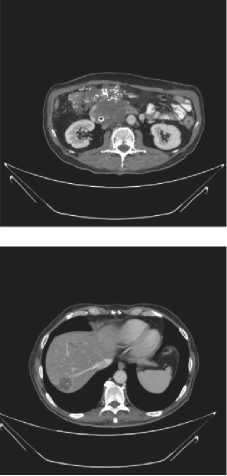
В сентябре 2021 г. выполнена диагностическая лапароскопия биопсия опухолевых узлов брюшины и инцизионная биопсия образования головки поджелудочной железы. По результатам гистологического исследования установлена муцинозная аденокарцинома кишечного типа. По результатам иммуногистохимического исследования полученного образца были обнаружены мутация BRAF V600E и MSI-H. Для дальнейшего лечения пациент обратился в Санкт-Петербургский Онкологический центр имени Н.П. Напалкова (КНПЦ).
При повторном КТ ОБП от 15 октября 2021 г. подтверждается рак головки поджелудочной железы; тромбоз верхней брыжеечной вены; метастазы в регионарных л/узлах, забрюшинных л/узлах; канцероматоз брюшины. С учетом MSI-H, решением мультидисциплинарного консилиума пациенту была назначена первая линия иммунотерапии ниволумабом 1 раз в 28 дней в дозе 480 мг. После 2 циклов иммунотерапии ниволумабом по данным КТ от 15 декабря 2021 года отмечалась стабилизация заболевания.
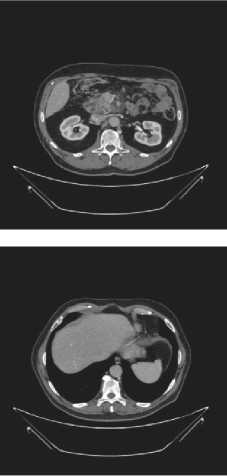
После 4 циклов иммунотерапии ниволумабом по данным КТ от 18 февраля 2022 г. по сравнению с КТ ОБП от 15 декабря 2021 г. была выявлена отрицательная динамика в виде увеличения размеров образования головки поджелудочной железы, увеличения размеров метастазов в регионарных и забрюшинных лимфоузлах, увеличение размеров метастазов в печени, увеличение размеров и количества неорганных узлов по брюшине, нарастание признаков биллиарной гипертензии (рис. 1). Учитывая клиническую картину механической желтухи, 09 марта
1. Октябрь 2011
2. Февраль 2022
3. Май 2022
4. Июль 2022
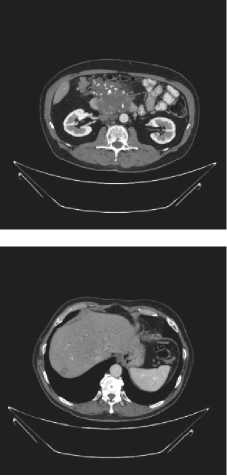
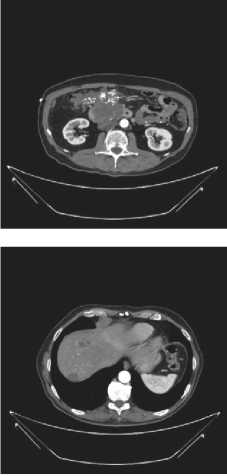
Рисунок 1. КТ ОБП: 1 — до начала терапии первой линии; 2 — прогрессирование после 4 циклов иммунотерапии ниволумабом; 3 — после двух месяцев терапии дабрафенибом и траметинибом; 4 — после одного месяца терапии комбинацией дабрафениб + траметиниб + панитумумаб
Figure 1. Computed tomography of the abdomen: 1 — before starting first-line therapy; 2 — progression after 4 cycles of immunotherapy with nivolumab; 3 — after two months of therapy with dabrafenib and trametinib; 4 — after one month of therapy with the combination of dabrafenib + trametinib + panitumumab
2022 пациенту выполнено чрескожное чреспеченочное наружное дренирование желчных протоков под контролем ультразвукового исследования.
Далее с учетом прогрессирования заболевания после 4 месяцев иммунотерапии и наличием мутации BRAF V600E, по решению мультидисциплинарного консилиума 22 марта 2022 года пациенту была назначена вторая линия терапии комбинацией дабрафениба 300 мг ежедневно и траметиниба 2 мг ежедневно.
По результатам контрольного КТ ОБП от 19 мая 2022 г. у пациента наблюдалась стабилизация заболевания (рис. 1). С учетом умеренного увеличения размеров опухоли в рамках стабилизации мультидисциплинарным консилиумом 27 мая 2022 г. было принято решение об интенсификации 2 линии лекарственной терапии: добавление панитумумаба 6 мг/кг в 1-й день; цикл 14 дней. 20 июня 2022 г. пациенту было проведено стентирование желчных протоков под рентгеноскопическим контролем, пациент продолжил получать 2 линию терапии комбинацией дабрафениб + траметиниб + панитумумаб.
На контрольном КТ ОБП от 15 июля 2022 г. в сравнении с КТ ОБП от 19 мая 2022 г. наблюдается уменьшение размеров очагов печени, разнонаправленная динамика кан-цероматозных узлов и увеличение количества жидкости в малом тазу (рис. 1). Пациент продолжил получать комбинированную терапию комбинацией дабрафениб + тра-метиниб + панитумумаб. На контрольном КТ ОБП от 02 сентября 2022 г. в сравнении с мультиспиральной компьютерной томографией от 15 июля 2022 г. отмечается прогрессирование заболевания: увеличение размеров очагов в печени, увеличение размеров канцероматозных узлов, незначительное увеличение размеров образования головки поджелудочной железы. С учетом прогрессирования заболевания после 5 месяцев таргетной терапии, мультидис-циплинарным консилиумом 3 октября 2022 г. было рекомендовано проведение третьей линии терапии по схеме FOLFIRINOX (цикл 14 дней, введение препаратов через центральный венозный катетер с редукцией доз химиопрепаратов на 25%). Пациент получил суммарно 4 цикла ПХТ по схеме FOLFIRINOX, однако по результатам КТ ОБП от 15 декабря 2022 г. было зарегистрировано прогрессирование заболевания, увеличение количества и размеров метастазов в печени, канцероматозных узлов. К сожалению, о дальнейшей судьбе пациента ничего не известно.
Настоящий случай показывает, что последовательное назначение 3 видов противоопухолевой терапии позволило в течение 11 месяцев держать под контролем агрессивно протекающее злокачественное новообразование поджелудочной железы с наличием MSI-H и мутации BRAF V600E.
ОБСУЖДЕНИЕ
В рассматриваемом клиническом случае BRAF-позитивного рака околоушной слюнной железы таргетная терапия BRAF/MEK— ингибиторами позволила достичь выраженной клинической и рентгенологической положительной динамики у пациента с множественными метастазами и неблагоприятным прогнозом; длительность ответа составила 6 месяцев. Применение комбинации дабрафениб + траметиниб + панитумумаб во второй линии у пациента с метастатическим раком поджелудочной железы с мутацией BRAF V600E после прогрессирования на иммунотерапии ниволумабом позволило достичь стабилизации болезни в течение 6 месяцев в сочетании с хорошей переносимостью и сохранением качества жизни.
Помимо меланомы, рака щитовидной железы рака и рака толстой кишки, распространенность мутации BRAF V600E в других видах рака составляет менее 5% [6–7]. Относительно низкая частота этой мутации объясняет отсутствие рандомизированных контролируемых исследований, изучающих применение таргетной анти-BRAF терапии при других видах новообразований. Для формирования доказательной базы об эффективности BRAF/MEK ингибиторов при редких BRAF-позитивных опухолях независимо от их типа и локализации проводятся «корзинные» исследования. «Корзинные» исследования предполагают включение пациентов с разными гистологическими подтипами опухолей. При этом наличие конкретной молекулярной мишени, на которую воздействует исследуемый таргетный препарат, является ключевым фактором для включения пациента.
В корзинном исследовании II фазы ROAR, в котором изучалась эффективность применения комбинации да-брафениба и траметиниба у пациентов с мутацией BRAF V600E в 8 когортах пациентов с анапластическим раком щитовидной железы (n = 36), раком желчных протоков (n = 43), гастроинтестинальной стромальной опухолью (n = 1), аденокарциномой тонкой кишки (n = 3), глиомой низкой степени (n = 13), глиомой высокой степени (n = 45), волосатоклеточным лейкозом (n = 55) и множественной миеломой (n = 19), частота объективного ответа по оценке исследователя в этих когортах составила 56%, 53%, 0%, 67%, 54%, 33%, 89% и 50% соответственно, а медиана выживаемости без прогрессирования составила 6,7 месяца, 9,0 месяцев, не достигнута, не оценена, 9,5 месяца, 5,5 месяца, не оценена и 6,3 месяца, соответственно [11]. В исследовании NCI–MATCH Subprotocol H изучалась эффективность комбинации дабрафениба и траметиниба у взрослых пациентов с солидными опухолями с мутацией BRAF V600E, за исключением пациентов с меланомой, раком щитовидной железы или колоректальным раком. Всего в исследование был включен 131 пациент, а объединенная частота объективного ответа составила 41 % [12].
Тем не менее, множество данных свидетельствуют о том, что вклад мутаций в гене braf в канцерогенез и, как следствие, степень ответа на анти-BRAF-терапию зависят от гистологического типа опухоли, поэтому вопрос о том, все ли виды рака с мутацией BRAF V600E отвечают на соответствующую таргетную терапию, остается открытым [13].
ЗАКЛЮЧЕНИЕ
Представленные клинические случаи показывают, что следование агностическому подходу и применение BRAF/MEK ингибиторов в терапии BRAF-позитивных опухо- лей позволяет достичь стабилизации болезни даже у пациентов с обширным метастазированием, а также предоставляет дополнительную терапевтическую опцию для лечения редких опухолей с мутаций в гене braf, для которых существующие варианты лекарственной терапии сильно ограничены.
Список литературы Клинические случаи эффективного применения агностического подхода в терапии опухолей с мутацией BRAF V600E
- El-Deiry W.S., Goldberg, R.M., Lenz H.-J., et al. The current state of molecular testing in the treatment of patients with solid tumors, 2019. CA Cancer J Clin 2019;69(4):305-343. https://doi.org/10.3322/caac.21560
- Kumar-Sinha C., Chinnaiyan, A.M. Precision oncology in the age of integrative genomics. Nat Biotechnol 2018;36(1):46- 60. https://doi.org/10.1038/nbt.4017
- Yan L., Zhang W. Precision medicine becomes reality-tumor type-agnostic therapy. Cancer Commun (Lond) 2018;38(1):6. https://doi.org/10.1186/s40880-018-0274-3.
- Hyman D.M., Taylor B.S., Baselga J. Implementing Genome-Driven Oncology. Cell 2017;168(4):584-599. https://doi.org/10.1016/j.cell.2016.12.015
- Leicht D.T., Balan V., Kaplun, A., et al. Raf kinases: function, regulation and role in human cancer. Biochim Biophys Acta 2007;1773(8):1196-1212. https://doi.org/10.1016/j.bbamcr.2007.05.001
- Davies H., Bignell G.R., Coxet C., et al. Mutations of the BRAF gene in human cancer. Nature 2002;417(6892):949-954. https://doi.org/10.1038/nature00766
- Cohn A.L., Day B.M., Abhyankar S., et al. BRAFv600 mutations in solid tumors, other than metastatic melanoma and papillary thyroid cancer, or multiple myeloma: a screening study. Onco Targets Ther. 2017;10:965-971. https://doi.org/10.2147/OTT.S120440
- Bernocchi O., Sirico M., Corona S.P., et al. Tumor type agnostic therapy carrying BRAF mutation: case reports and review of literature. Pharmaceuticals (Basel.) 2021;14(2):159. https://doi.org/10.3390/ph14020159
- Клинические рекомендации. Злокачественные новообразования бронхов и легкого, 2022. Доступно по: https://cr.minzdrav.gov.ru/schema/30_4.
- Клинические рекомендации. Меланома кожи и слизистых оболочек, 2020. Доступно по: https://cr.minzdrav.gov.ru/schema/546_1.
- Subbiah V., Kreitman R.J., Wainberg Z.A., et al. Dabrafenib plus trametinib in BRAFV600E-mutated rare cancers: the phase 2 ROAR trial. Nat Med 2023;29(5):1103-1112. https://doi.org/10.1038/s41591-023-02321-8
- Salama A.K.S., Li S., Macrae E.R., et al. Dabrafenib and Trametinib in patients with tumors with BRAFV600E mutations: Results of the NCI-MATCH trial subprotocol H. J Clin Oncol 2020;38(33):3895-3904. https://doi.org/10.1200/JCO.20.00762
- Barras D., Missiaglia E., Wirapati P., et al. BRAF V600E mutant colorectal cancer subtypes based on gene expression. Clin Cancer Res 2017;23(1):104-115. https://doi.org/10.1158/1078-0432.CCR-16-0140


