Клинический cлучай риносинусогенного абсцесса головного мозга и обзор литературы
Автор: Мамадалиев Абдурахмон Маматкулович, Алиев Мансур Абдухоликович, Абдувойитов Бобур Баходир угли, Хайритдинов Бобуршох Бурхонович, Фарухова Мохинур Фирдавсовна, Гаппарова О.И., Тухтамуродов Х.Х., Бурхонов А.Ш.
Журнал: Uzbek journal of case reports.
Статья в выпуске: 2(2), 2022 года.
Бесплатный доступ
В этом ретроспективном исследовании мы анализируем случай риносинусогенного абсцесса головного мозга. Пациент, 54 года, мужчина, по- ступил в отделение нейрохирургии 1–й клиники СамГМИ по поводу головной боли в течении нескольких месяцев и эпилептических присту- пов за последнюю неделю, сопровождавшихся тошнотой и рвотой. При МРТ головного мозга обнаружено в правой лобной доле обнаружено округлое, объемное образование, а также явно усиленные сигналы DWI, а на кольцевой стенке наблюдалось явное увеличение интенсивности сигнала после усиления. Перед операцией пациенту поставили диагноз абсцесс головного мозга и сделали миниинвазивную операцию — нало- жены фрезевое отверстие в проекции абсцесса. Послеоперационное патогистологическое исследование подтвердило абсцесс головного мозга.
Абсцессы головного мозга, клинический случай, риносинусогенный абсцесс, хирургическое лечение, приточно–отточная система
Короткий адрес: https://sciup.org/14123759
IDR: 14123759 | УДК: 616.831–002.3 | DOI: 10.55620/ujcr.2.2.2022.2
Текст статьи Клинический cлучай риносинусогенного абсцесса головного мозга и обзор литературы
Абсцесс головного мозга, тяжелое внутричерепное инфекционное заболевание, относится к гнойно–воспалительным заболеваниям паренхимы головного мозга, вызванный местной или отдаленной метастатической инфекцией. В последнее время достижения современной медицины, особенно широкое применение противоми-кробных препаратов, способствовали постепенному снижению распространенности этого заболевания. Однако, до сих пор число случаев риносинусогенного абсцесса головного мозга с атипичными симптомами остается относительно высоким.
Распространенность абсцессов головного мозга составляет 0,4–1,2 на 100 000 населения (Мамадалиев А.М. и соавт., 2020; Helweglarsen et al., 2012) а также высокий уровень инвалидности и смертности. Улучшения в его диагностике и лечении, а также достижения в технологиях визуализации (в частности, КТ и МРТ) снизили уровень смертности от абсцесса мозга с 40 до 10%. (Горожанин А.В., 2013; Brouwer et al., 2014). Абсцесс головного мозга возникает в результате проникновения инфекции в ткань головного мозга различными путями, такими как гематогенное распространение, контактное распространение и посттравматическая инфекция. Клинические проявления в первую очередь включают проявления острой инфекции, повышение внутричерепного давления и очаговую симптоматику головного мозга. Поскольку риносинусогенные абсцессы головного мозга не имеют отличительных черт в истории болезни, клинических симптомах и физических признаках, он может быть подвержен ошибочной диагностике и неправильному лечению, а также имеет неблагоприятный прогноз.
В данном исследовании сообщается о случае ри-носинусогенного абсцесса головного мозга. Пациент в недавнем прошлом имел удовлетворительное физическое здоровье, без каких–либо данных о расстройствах иммунной системы, сердечных заболеваниях, травмах головы или недавней инфекции. У пациента наблюдались клинические проявления поражения лобной доли головного мозга и характерные черты скорости прогрессирования заболевания, он был прооперирован. Пациента после операции получали адекватные лекарства. Результаты подробно описаны ниже. На публикацию этого клинического случая было получено письменное информированное согласие пациента.
Uzbek journal of case reports. 2022. Т.2, №2
КЛИНИЧЕСКИЙ СЛУЧАЙ
Пациент, мужчина, 54 года с удовлетворительным физическим здоровьем в анамнезе. Диагностическая консультация выявила очаг инфекции проявляющийся в форме синусита. Его основные жалобы включали головную боль в течение последних месяцев и усиление головной боли в течение последних 10 дней, сопровождающиеся тошнотой, и приступами судорог с 20.12.2020 года. Пациент госпитализирован в отделение нейрохирургии 1–клиники Самаркандского Государственного медицинского института с температурой тела 38,4°C. Отчет о физикальном обследовании, проведенном в отделении нейрохирургии показал, что пациент имел ясное сознание, был апатичным, имел 13 баллов по шкале комы Глазго (GCS), мягкую шею, отмечается левосторонний гемипарез, сниженные глубокая и поверхностная чувствительность. После госпитализации общий анализ крови показал количество лейкоцитов 6,4×109/л (нормальный референсный диапазон: 4,0–10,0×10ˆ9/л), 70,4% нейтрофилов (нормальный референсный диапазон: 50–75%), 20,1% лимфоцитов (нормальный контрольный диапазон: 20–40%) и уровень С–реактивного белка (CRP) 9,0 мг/л (нормальный контрольный диапазон: 0–10 мг/л). При Эхо–КГ и ЭКГ патологические изменения не выявлены. Магнитно–резонансная томография (МРТ) головного мозга, включая обычное сканирование и сканирование с улучшением, показала следующее: (1) неправильные круглые, слегка длинные, аберрантные тени сигналов в T1 и T2–режимах с пластинчатыми, длинными сигналами T1 и T2, а также очевидно сигналы улучшенной диффузно–взвешенной визуализации (DWI) наблюдались в правой лобной доле; (2) стенка окружающего объемное образование кольца с относительно равномерной толщиной, представленная в виде слегка коротких сигналов T1 и T2; (3) стенка кольца проявляла явное увеличение интенсивности сигнала после усиления; (4) поражение было окружено большими пятнами отечной тени Т1 и Т2; (5) соседние желудочки и паренхима деформировались в результате компрессии; (6) структуры средней линии были немного смещены влево (Рисунки 1A–H).
Пациенту выполнена миниинвазивная пункционная аспирация полости абсцесса с последующим его дренированием с приточно–отточной системой. Патогистологи-ческое исследование показало наличие воспалительного экссудата, некроза и грануляций.
После операции пациенту была назначена эмпирическая схема лечения: 1 г меропенема каждые 8 часов и 1 г левомицетина каждые 12 часов. Посев гноя показал присутствие Streptococcus viridae, а тест на лекарственную чувствительность показал, что бактерия была чувствительна к левомицетину; Таким образом, пациент получала левомицетин 1 г каждые 12 часов. После операции у пациента поднялась субфебрильная температура, которая колебалась около 37,5°C. После 10 дней лечения температура его тела нормализовалась. Общий анализ крови показал следующее: количество лейкоцитов 7,1×109/л, нейтрофилов 65,4%, лимфоцитов 24,5%, уровень СРБ 8,2 мг/л. Таким образом, пациент продолжал принимать левомицетин еще 3 недели, после чего у него наблюдалась ремиссия головной боли и нормаль-
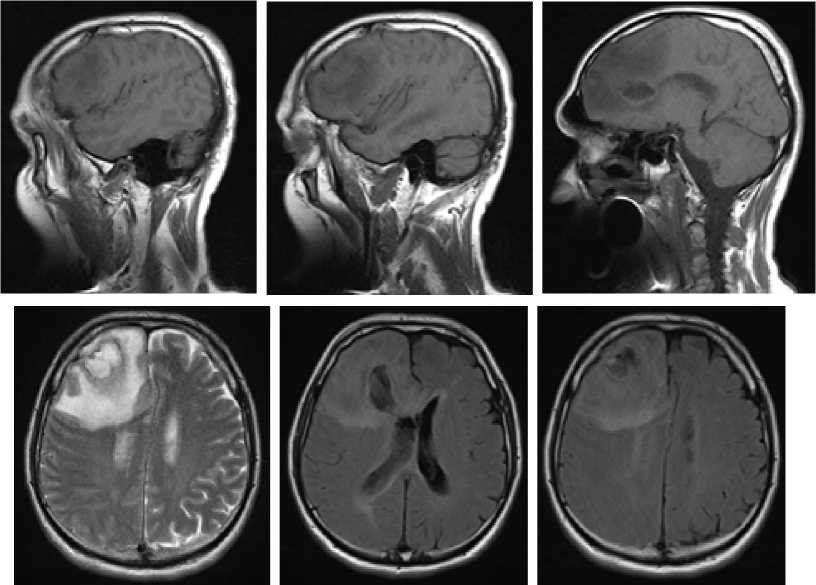
Рис. 1
В правой теменной доле было обнаружено образование неправильной формы, занимающее пространство, со слегка длинными тенями сигналов T1 и немного длинными тенями сигналов T2, в которых наблюдались плоские длинные сигналы T1 и T2, окруженные большими пятнами отека (A–C).
Сигналы DWI, по–видимому, были усилены, и стенка краевого кольца, по–видимому, имела относительно равномерную толщину, что проявлялось в виде слегка коротких сигналов T1 и T2 (D). После усиления на стенке кольца наблюдалось явное усиление сигнала (E–H).
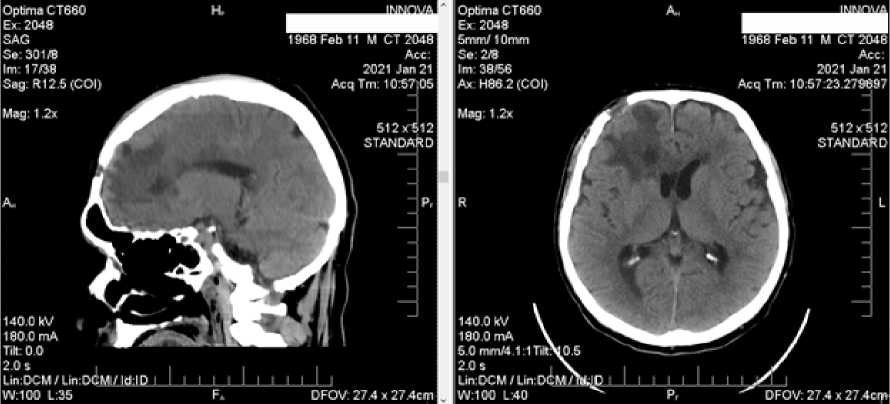
Рис. 2
Через четыре недели после операции на МСКТ объемное образование исчезло, но остались пятна отека с размытыми границами.
ная сила конечностей. Контрольная мультиспиральная компьютерная томография (МСКТ) головы показала, что объемное образование в правой лобной доле исчезло, в окружающей области были небольшие участки теней низкой плотности с размытыми границами, а срединные структуры отображали локальный сдвиг влево (рис. 2).
Больной выписан. Физикальное обследование показало, что у пациента нормальная температура тела, ясное сознание, хорошая артикуляция и нормальная мышечная сила конечностей.
ОБСУЖДЕНИЕ
Пациент в текущем исследовании имел в анамнезе удовлетворительное физическое здоровье и нормальную иммунологическую функцию; зафиксирован хронический синусит, не получал травм головы в анамнезе.
На основании данных визуализации абсцессы головного мозга можно разделить на три стадии. Первая — стадия менингоэнцефалита, которая проявляется участками низкой плотности с размытыми границами и неравномерной плотностью на КТ–изображениях, сигналами низкой интенсивности с размытыми границами на МРТ T1W1 и участками сигналов высокой интенсивности на T2W1; поражение сливается с окружающей зоной отека и после усиления проявляет нерегулярное усиление. Вторая — стадия нагноения, при которой проявляются участки с низкой плотностью с неравномерной плотностью, без кольцевых теней и явным отеком в окружающей области. Эта стадия может привести к смещению структур средней линии, и поражение проявляет нерегулярное усиление после усиления. Третий — стадия инкапсулирования, которая проявляется в виде ровных участков с низкой плотностью в центре и круглых теней с высокой плотностью в окружающей области; после усиления круглая тень демонстрирует очевидное усиление с равномерной толщиной и неповрежденными правильными контурами; поражение проявляет изо–интенсивный или слабый гипер–интенсивный сигнал на МРТ T1W1 и ги-пер–интенсивный сигнал на T2W1. После усиления это проявляется как круговое усиление, которое остается неповрежденным тонким и ровным слоем (Демиденко А.Н., 2009; Nathoo et al., 2011). Эти проявления похожи на глиомы и метастазы головного мозга; более того, они не могут использоваться в качестве отличного признака для диагностики абсцесса головного мозга. Развитие технологий МРТ привело к появлению нескольких методов визуализации, включая магнитно–резонансную перфузионную томографию, магнитно–резонансную спектроскопию (MRS) и DWI. MRS позволяет точно идентифицировать абсцесс головного мозга и кистозно–некротические злокачественные новообразования головного мозга. На капсульной стадии абсцесса мозга в некротическом центре отсутствуют метаболиты нормальной мозговой ткани (например, N–ацетиласпар-тат, холин и холевая кислота), но повышенные уровни цитоплазматических аминокислот и молочной кислоты. Кроме того, у некоторых пациентов одновременно повышается уровень уксусной и янтарной кислот. Это классические резонансные признаки полости абсцесса. Хотя сигналы молочной кислоты и липидов могут быть обнаружены в случаях абсцесса и опухоли головного мозга, валин, лейцин и изолейцин являются ключевыми маркерами для диагностики абсцесса мозга. Однако отсутствие трех аминокислот не исключает наличия абсцесса головного мозга (Pal et al., 2010; Hsu et al., 2013). Эти признаки служат доказательством различения абсцесса мозга и некротической злокачественной опухоли мозга. DWI является наиболее ценным методом диагностики абсцесса головного мозга, поскольку он демонстрирует высокую чувствительность и специфичность при дифференцировании абсцесса мозга от глиомы и метастазов в головной мозг. Полость абсцесса проявляется как сверхинтенсивный сигнал на DWI и низкий кажущийся коэффициент диффузии (ADC). Напротив, область некротической кистозной дегенерации опухоли головного мозга демонстрирует гипоинтенсивные сигналы на DWI и высокие значения ADC. Таким образом, DWI может предоставить важные доказательства для диагностики и определения абсцесса мозга.
У пациента болезнь прогрессировала медленно. Перед операцией были выполнены МРТ + DWI головы для изучения внутричерепного состояния. МРТ головы показала, что кистозная полость проявляется в виде гипоинтенсив-ных сигналов на T1W1 и гиперинтенсивных сигналов на T2W1, а окружающая область содержит отек. После усиления поражение проявилось как усиление кольца;
Uzbek journal of case reports. 2022. Т.2, №2
капсула была цела и имела тонкую стенку одинаковой толщины. DWI показал, что кистозная полость выдает сверхинтенсивные сигналы, что согласуется с проявлениями абсцесса на стадии капсулы.
Лечение абсцесса головного мозга включает медикаментозное лечение и хирургическое вмешательство. Медикаментозное лечение подходит только на ранней стадии нагноения, при небольших абсцессах (диаметром менее 2,5 см), при отсутствии явного повышения внутричерепного давления или множественных абсцессах головного мозга без явной занятости пространства (Древаль О.Н., 2015; Arlotti et al., 2010). Рекомендуется незамедлительно вводить противомикробные препараты. Gutiérrezcuadra et al. (2009) рекомендовали, чтобы интервал между двумя введениями составлял не более 2 дней. До того, как будет доступен тест на лекарственную чувствительность, можно назначить эмпирическое лечение после учета фактора инфекции и места поражения. Следует использовать эффективные антибиотики, которые могут проходить через гематоэнцефалический барьер (Кривопалов А.А., 2017; Al Masalma et al., 2009). В случаях абсцесса головного мозга, возникшего в результате полибактериальной инфекции соседних участков, может быть предусмотрено назначение цефалоспорина в сочетании с метронидазолом. Для пациентов, чьи противоречия включают цефалоспорин или метронидазол, меропенем может быть использован в качестве альтернативы. Во время приема лекарств следует проводить периодические исследования КТ или МРТ для наблюдения за морфологическими изменениями абсцесса головного мозга и оценки терапевтического результата. Признаки эффективного лечения включают улучшение клинических симптомов, облегчение или исчезновение участков отека на основе данных визуализации, а также уменьшение или исчезновение очага поражения. На этом этапе лечение консолидации должно продолжаться не менее 2 недель. Хирургические доступы при абсцессе головного мозга включают пункционную аспирацию и стереотаксическую резекцию. Пункционная аспирация подходит для пациентов, которые не подходят для трепанации черепа, потому что абсцессы имеют большой размер поражения (максимальный диаметр абсцесса>2,5 см), тонкую стенку капсулы, глубокое расположение, находятся в ключевых функциональных областях или потому, что пациенты старые, слабые, или страдают другими тяжелыми заболеваниями. С другой стороны, стереотаксическая резекция работает лучше, чем аспирация абсцесса, для пациентов с интактной капсулой, неглубоким расположением капсулы, абсцессом, который не находится в важной функциональной области, толстой стенкой капсулы, многолучевыми поражениями или пациентами с церебральной грыжей.
У больного абсцесс с интактной капсулой. Абсцесс находился на поверхности ткани мозга, а не в важной функциональной области, а стенка капсулы была относительно толстой. На основании этих данных пациенту была проведена стереотаксическая резекция, во время которой хирургические полотенца использовались для защиты операционного поля. Из–за высокого давления в головном мозге было аспирировано около 20 мл вязкого гноя желтого цвета, при этом были приняты меры, чтобы не пролить жидкость. После снятия давления в головном мозге установлена система длительного промывания с приточно–отточным механизмом в полость абсцесса.
Послеоперационная бактериальная культура каждого пациента показала наличие одного микроба Streptococcus. Lakshmi et al. (2011) сообщили, что возбудители риноси-нусогенного абсцесса головного мозга в основном происходят из верхних дыхательных путей или микробиоты полости рта и состоят в основном из Streptococcus spp. и анаэробные кокки. Nathoo et al. (2011) сообщили, что 53,2% случаев абсцесса головного мозга вызваны одним патогеном — бактериями или грибками, наиболее распространенными из которых являются стафилококк (21,2%) и стрептококк (20,2%). Эти бактерии часто обнаруживаются у пациентов после нейрохирургии или у пациентов с синуситом или средним отитом. Послеоперационные пациенты с абсцессом головного мозга должны получать внутривенные антибиотики в течение 4–6 недель. В принципе, прием антибиотиков следует продолжать до тех пор, пока послеоперационная температура тела не останется на нормальном уровне в течение 10–14 дней. На этом этапе следует провести контрольное обследование с помощью МСКТ или МРТ. Пациентам с кистозными объемными образованиями рекомендуется DWI. Если полость абсцесса остается или DWI указывает на то, что полость абсцесса не находится близко к спинномозговой жидкости, то следует продолжить внутривенное введение антибиотиков даже при нормальной температуре тела (Arlotti et al., 2010). В этом исследовании двум пациентам была сделана контрольная компьютерная томография после того, как температура их тела вернулась к норме. Эти снимки показали, что кистозные объемные образования исчезли.
ВЫВОДЫ
Таким образом, риносинусогенный абсцесс мозга редко встречается у людей с нормальной иммунной функцией. Однако, когда у пациента развивается классическая триада, состоящая из лихорадки, головной боли и очаговых неврологических нарушений, следует уделять пристальное внимание истории болезни и результатам физикального обследования, после чего следует исследовать возможность абсцесса головного мозга. Хотя в настоящее время мы оснащены самыми передовыми методами визуализации, большим арсеналом антибиотиков и множеством хирургических возможностей, абсцесс мозга остается заболеванием, связанным с высоким уровнем смертности. Таким образом, ранняя диагностика и лечение имеют решающее значение для минимизации различных осложнений и количества смертей.
Список литературы Клинический cлучай риносинусогенного абсцесса головного мозга и обзор литературы
- Демиденко А.Н. Риносинусогенные внутричерепные осложнения: вопросы этиопатогенеза, совершенствования диагностики, хирургического и консервативного лечения. Автореф. дис. канд. мед. наук А.Н. Демиденко. 2009; 23.
- Древаль О.Н., Джинджихадзе Р.С., Шагинян Г.Г., и соавт. Клинические рекомендации по диагностике и лечению абсцессов головного мозга, внутричерепных эпидуральных и субдуральных эмпием: Клинические рекомендации Ассоциации нейрохирургов России. 2015; 28.
- Кривопалов А.А. Комплексный подход к диагностике и лечению больных с отогенными и риносинусогенными гнойно–воспалительными внутричерепными осложнениями в современных условиях. Автореф. дис. д– ра мед. наук А.А. Кривопалов. 2017; 48.
- 4. Мамадалиев А.М. Об эффективности хирургического лечения абсцессов головного мозга с применением приточно–отточной дренажной системы. «Поленовские чтения»: материалы XIII научно–практической конференции. 2014; 16.
- 5. Мамадалиев А.М. Абсцессы головного мозга. Учебно–методическое пособие. 2020 г; 42.
- 6. Brouwer MC, Tunkel AR, Mckann GM. Brain abscess. New Engl j med. 2014; 371(5):447–456.
- 7. Masalma Al, Armougom M, Scheld F, Dufour WM, Roche H, Drancourt PH. et al. The expansion of the microbiological spectrum of brain abscesses with use of multiple 16S ribosomal DNA sequencing. Clin. Infect. Dis. 2009; 48:1169–1178.
- 8. Arlotti M, Grossi P, Pea F, Tomei G, Vullo V, De Rosa V et al. (2010). Consensus document on controversial issues for the treatment of infections of the central nervous system: bacterial brain abscesses. Int. J. Infect. Dis. 14(4):79–92


