Клинический опыт эффективного использования таргетной терапии у пациентки c диссеминированной формой гастроинтестинальной стромальной опухоли
Автор: Адлейба Сария Темуровна, Когония Лали Михайловна, Гуревич Лариса Евсеевна, Сидоров Александр Вячеславович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 3 т.18, 2019 года.
Бесплатный доступ
Представлен собственный опыт эффективного лечения пациентки с диссеминированной формой гастроинтестинальной стромальной опухоли (ГИСО) препаратом из группы ингибиторов тирозинкиназ (иматинибом). Актуальность. Терапия гастроинтестинальных стромальных опухолей представляет собой сложную проблему современной онкологии. C 2001 г. в лечении больных ГИСО произошел прорыв за счет успешного применения таргетного препарата из группы ингибиторов тирозинкиназ - иматиниба, который эффективен в первой линии неоперабельных и/или метастатических ГИСО, а также используется с целью неоадъювантной, адъювантной терапии локализованных форм ГИСО. Генномутационный анализ, используемый для корректного назначения таргетной терапии, свидетельствует о нецелесообразности назначения иматиниба у пациентов с мутацией в гене сукцинатдегидрогеназы и мутацией D842V в гене тромбоцитарного фактора роста. Однако в разных субъектах РФ подобная диагностическая процедура не всегда может быть выполнена по ряду технических причин. Отсутствие ответа на терапию и, как следствие, прогрессирование заболевания могут быть связаны со снижением терапевтической концентрации иматиниба в плазме крови. Определение концентрации активных метаболитов иматиниба в сыворотке крови позволяет своевременно выявить потенциальные причины недостаточного ответа на терапию и проводить индивидуальную коррекцию дозы препарата. Материал и методы. Для выяснения значимости корреляции между повышением/понижением дозы иматиниба и достижением терапевтического ответа использовался лабораторный метод высокоэффективной жидкостной хроматографии для определения концентрации иматиниба в сыворотке крови. Заключение. Определение пониженной концентрации активных метаболитов иматиниба в плазме крови методом высокоэффективной жидкостной хроматографии с детекцией метода тандемной масс-спектрометрии у пациентки с диссеминированной формой ГИСО позволило провести коррекцию дозы препарата и достичь положительного эффекта с длительностью 51 мес (с момента повышения дозы). Метод высокоэффективной жидкостной хроматографии с детекцией метода тандемной масс-спектрометрии не является абсолютной альтернативой генно-мутационному анализу, однако он может эффективно использоваться для коррекции дозы иматиниба пациентам с ГИСО.
Гастроинтестинальные стромальные опухоли, химиотерапия, таргетная терапия, ингибиторы тирозинкиназ, иматиниб, старческий возраст, хроматография
Короткий адрес: https://sciup.org/140254036
IDR: 140254036 | УДК: 616.33-006-08:615.277.3 | DOI: 10.21294/1814-4861-2019-18-3-109-113
Текст научной статьи Клинический опыт эффективного использования таргетной терапии у пациентки c диссеминированной формой гастроинтестинальной стромальной опухоли
Актуальность
Терапия гастроинтестинальных стромальных опухолей (ГИСО) до сих пор представляет собой сложную проблему современной онкологии [1]. Применение химиотерапии не дало удовлетворительных результатов ни в монорежиме (дакарбазин или доксорубицин), ни в комбинированных схемах (MAID – месна, доксорубицин, ифосфамид, дакар-базин): по данным разных авторов, частота объективных ответов составляла 0–15 %, медиана общей выживаемости – 8–9 мес [2]. C 2001 г. в лечении больных ГИСО произошел прорыв за счет успешного применения таргетного препарата из группы ингибиторов тирозинкиназ – иматиниба [3, 4], который эффективен в первой линии неоперабельных и/или метастатических форм, а также используется при неоадъювантной, адъювантной терапии локализованных ГИСО [5, 6]. Генно-мутационный анализ, используемый для корректного назначения таргетной терапии, свидетельствует о нецелесообразности назначения иматиниба пациентам с мутацией в гене сукцинатдегидрогеназы и мутаци- ей D842V в гене тромбоцитарного фактора роста [7, 8]. Однако в разных субъектах РФ подобная диагностическая процедура не всегда может быть доступна по ряду технических причин. Отсутствие ответа на терапию и, как следствие, прогрессирование заболевания могут быть связаны со снижением терапевтической концентрации иматиниба в плазме крови.
Материал и методы
Через 3 мес после операции состояние пациентки ухудшилось, появились боли в правой половине живота, беспокоила тошнота, слабость, ECOG 1 – 2. В связи с возникшими жалобами пациентка обратилась к районному онкологу, при контрольном УЗИ органов брюшной полости (06.02.13) были выявлены метастазы в печени (наибольший очаг 3 см в диаметре), по поводу чего начата терапия иматинибом в дозе 400 мг в сут. Через 1 мес после начала приёма иматиниба была определена концентрация иматиниба в плазме крови методом высокоэффективной хроматографии с тандемной масс-спектрометрией (первичный забор 08.03.13 – 889 нг/мл, ниже нормы). На фоне проводимой терапии имело место субъективное улучшение состояния пациентки, однако при контрольной КТ (11.03.13) установлено прогрессирование заболевания в виде увеличения очага в печени с 3 до 4 см в диаметре (рис. 1). Учитывая прогрессирование процесса на фоне приема иматиниба в дозе 400 мг, а также выявленную первичную пониженную концентрацию имтаниба (889 нг/мл в сыворотке крови), решено увеличить дозу препарата до 600 мг в сут (11.03.13).
Через 2 нед после начала приема препарата в эскалированной дозе (600 мг/сутки) самочувствие пациентки улучшилось: исчезла тошнота, уменьшились боли в правой половине живота. При повторном определении концентрации иматиниба через 1 мес (02.04.13) после повышения дозы до 600 мг этот показатель составил 1209 нг/мл (рис. 1), что коррелировало с улучшением субъективного состояния пациентки. Следующее контрольное КТ органов брюшной полости (11.02.14) зафиксировало уменьшение размеров метастатического очага с 4 см до 0,8 см в диаметре (рис. 2).
С 11.03.13 по настоящее время пациентка ежедневно принимает иматиниб в дозе 600 мг в сут
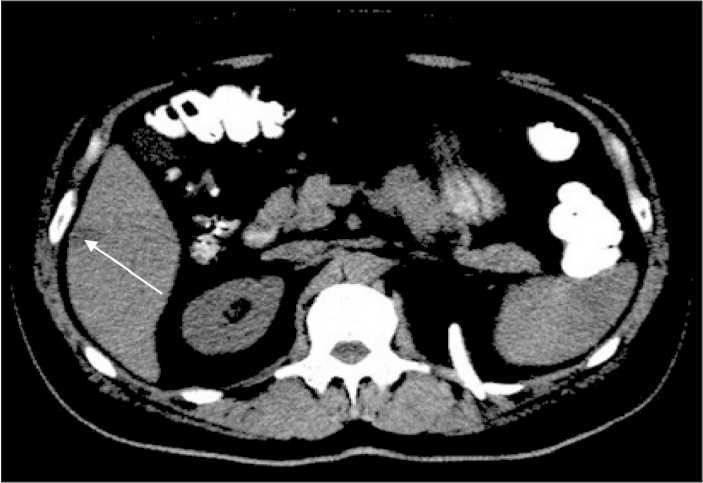
Рис. 1. КТ органов брюшной полости пациентки с диссеминированной формой ГИСО. Прогрессирование при таргетной терапии иматинибом в стандартной суточной дозе 400 мг
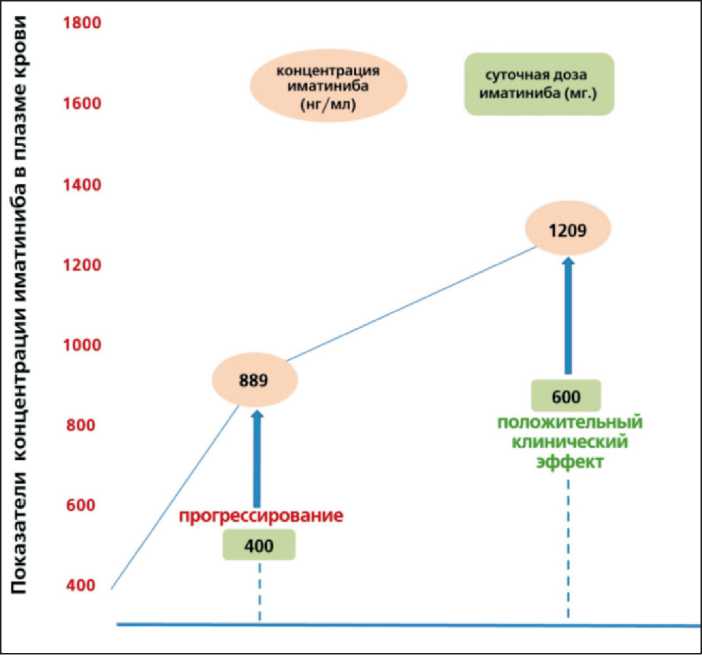
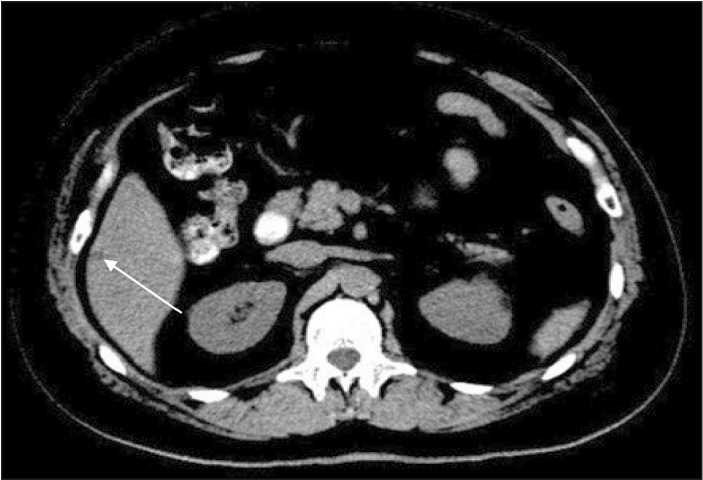
Рис. 3. КТ органов брюшной полости пациентки с диссеминированной формой ГИСО. Положительный клинический эффект индивидуализации таргетной терапии иматинибом в суточной дозе 600 мг
и наблюдается в течение 5 лет с момента повышения дозы. С момента начала терапии имати-нибом больная находится под наблюдением 5 лет и 7 мес, на диспансерном учете – 5 лет и 10 мес. При последнем контрольном осмотре состояние удовлетворительное, ECOG 0, активных жалоб не предъявляет. По данным регулярных плановых исследований, а также при последнем контрольном КТ органов брюшной полости (05.09.18) отмечается сохранение достигнутого эффекта. Из нежелательных явлений больная отмечала преходящие умеренные периорбитальные отеки и редко тошноту, лекарственной коррекции не требовалось. Выраженных побочных эффектов на фоне проводимой терапии иматинибом в вышеуказанной дозировке не выявлено.
Список литературы Клинический опыт эффективного использования таргетной терапии у пациентки c диссеминированной формой гастроинтестинальной стромальной опухоли
- ESMO/European Sarcoma Net-work Working Group. Gastrointestinal stromal tumours: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2014 Sep; 25 Suppl 3: iii21-6. DOI: 10.1093/annonc/mdu255
- Копп М.В., Королева И.А. Мультидисциплинарный подход в диагностике и лечении гастроинтестинальных стромальных опухолей. Злокачественные опухоли. 2013; 1: 15-27.
- Кащенко В.А., Карачун А.М., Орлова Р.В., Пелипась Ю.В., Петрова В.В., Непомнящая С.Л., Глузман М.И., Бескровный Е.Г. Особенности хирургического подхода в лечении гастроинтестинальных стромальных опухолей. Вестник хирургии имени И.И. Грекова. 2017; 176(2): 22-27.
- Sreide K., Sandvik O.M., S0reide J.A., Giljaca V., Jureckova A., Bulusu V.R. Global epidemiology of gastrointestinal stromal tumors (GIST): A systematic review of population-based cohort studies. Cancer Epidemiol. 2016 Feb; 40: 39-46. DOI: 10.1016/j.canep.2015.10.031
- Когония Л.М., Корнилова А.Г., Моськин В.Г., Морданов С.В., Оксенюк О.С. Стратификация больных гастроиноматестинальными стромальными опухолями по группам риска: определение целесообразности проведения адъювантной терапии и ее продолжительность. Якутский медицинский журнал. 2014; 3(47): 12-16
- Когония Л.М., Корнилова А.Г., Морданов С.В., Оксенюк О.С. Адъювантная терапия пациентов с гастроинтестинальными стромальными опухолями: стратификация больных по группам риска. Злокачественные опухоли. 2014; 1: 39-46.
- Никулин М.П., Архири П.П., Владимирова Л.Ю., Жабина А.С., Носов Д.А., Стилиди И.С. Практические рекомендации по лекарственному лечению гастроинтестинальных стромальных опухолей. Злокачественные опухоли: Практические рекомендации RUSSCO. 2018; 8: 421-429.
- Hayashi Y., Bardsley M.R., Toyomasu Y., Milosavljevic S., Gajdos G.B., Choi K.M., Reid-Lombardo K.M., Kendrick M.L., Bingener-Casey J., Tang C.M., Sicklick J.K., Gibbons S.J., Farrugia G., Taguchi T., Gupta A., Rubin B.P., Fletcher J.A., Ramachandran A., Ordog T. Platelet-derived growth factor receptor-alpha regulates proliferation of gastrointestinal stromal tumor cells with mutations in KIT by stabilizing ETV1. Gastroenterology. 2015 Aug; 149(2): 420-32.e16. 10.1053/j. gastro.2015.04.006. DOI: 10.1053/j.gastro.2015.04.006


