Клинический результат длительного контроля заболевания при HER-2 положительном диссеминированном раке молочной железы с метастазами в головной мозг у пациентки фертильного возраста
Автор: Важенин Андрей Владимирович, Ворошина Наталья Владимировна, Терешин Олег Станиславович, Дубровская Надежда Сергеевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 3 т.20, 2021 года.
Бесплатный доступ
Введение. Среди злокачественных новообразований рак молочной железы в Российской Федерации занимает второе место (14,9 %), а среди онкологической патологии у женщин - первое место (20,9 %). У 11,0 % больных к моменту постановки диагноза имеются отдаленные метастазы, 10,3 % пациенток умирают в течение первого года жизни от прогрессирования заболевания. Наиболее частая причина гибели больных раком молочной железы - отдаленные метастазы, наиболее опасным считается поражение головного мозга. Описание клинического случая. Приводим клиническое наблюдение длительного лечения диссеминированного рака молочной железы с метастазами в головной мозг у пациентки 32 лет. Гистологическое заключение: тубулярная карцинома молочной железы, низкой степени злокачественности G1. Иммуногистохимическое исследование: ER-Ts - 4 балла, PR-Ts - 3 балла, Her-2 положительный, Ki67 - 35,0 %. Герминальная мутация BRCA1 5382ins C не обнаружена. Представлены этапы терапии, в том числе с длительным использованием препаратов лапатиниб и капецитабин. Заключение. Представленный случай демонстрирует возможность длительного (31 мес) контроля над Her-2 позитивным раком молочной железы с множественными метастазами в головной мозг и кости с сохранением качества жизни и социальной активности пациентки молодого возраста. При этом не отмечено когнитивных нарушений, несмотря на риски, связанные с облучением всего головного мозга. Терапия лапатинибом и капецитабином была эффективна в течение 28 мес с хорошей переносимостью.
Диссеминированный рак молочной железы, гиперэкспрессия her-2 neu, метастатическое поражение головного мозга, лучевая терапия на головной мозг, таргетная терапия, качество жизни
Короткий адрес: https://sciup.org/140254505
IDR: 140254505 | УДК: 618.19-006.6-033.2-08 | DOI: 10.21294/1814-4861-2021-20-3-158-164
Текст научной статьи Клинический результат длительного контроля заболевания при HER-2 положительном диссеминированном раке молочной железы с метастазами в головной мозг у пациентки фертильного возраста
Среди всех злокачественных новообразований (ЗНО) рак молочной железы в Российской Федерации занимает второе место (14,9 %), среди ЗНО женского населения – первое место (20,9 %) [1]. У 11,0 % больных к моменту постановки диагноза уже имеются отдаленные метастазы, а 10,3 % пациенток умирают в течение первого года жизни от прогрессирования заболевания [2]. Наиболее частая причина гибели больных раком молочной железы (РМЖ) – отдаленные метастазы, наиболее опасным считается метастатическое поражение головного мозга [3]. Метастазирование в центральную нервную систему признано характерным признаком РМЖ, особенно тройного негативного и Her-2 положительного подтипов, при котором оно может встречаться в 30,0 % (доля метастазов в головной мозг среди других локализаций метастазов) [4]. Метастазы в головной мозг – значимый негативный фактор прогноза. При ретроспективном анализе 1 256 пациенток с метастазами РМЖ в головной мозг медиана общей выживаемости была равна 8,7 мес. При подгрупповом анализе для люминального рака этот показатель был равен 9,3 мес, для Her-2 положительного РМЖ – 16,5 мес, для тройного негативного подтипа – 4,9 мес [5].
Какую роль в этих результатах играет лекарственная блокада Her-2 сигнального пути, проникают ли препараты через гематоэнцефалический барьер – остается предметом дискуссий и исследований. Для пациенток с диссеминированным РМЖ вторым по важности после выживаемости критерием лечения является качество жизни [6, 7]. В случае проведения лучевой терапии на метастазы в головной мозг существует риск возникновения когнитивных нарушений [3]. Наш клинический случай иллюстрирует возможность длительного контроля Her-2 положительного РМЖ с метастазами в головной мозг, с применением таргетной терапии и облучения всего головного мозга с сохранением качества жизни пациентки.
Клинический случай
Пациентка О., 32 года, в анамнезе 3 беременности, из них 2 закончились своевременными родами, 1 медицинский аборт на сроке 8 нед. В мае 2015 г. самостоятельно обнаружила уплотнение в левой молочной железе и обратилась в ГБУЗ «Челябинский областной клинический центр онкологии и ядерной медицины», где проведена трепан-биопсия опухоли.
Гистологическое исследование (№№ 45375– 77/15): тубулярная карцинома молочной железы, низкой степени злокачественности G1; ИГХ: ERTs – 4 балла, PR-Ts – 3 балла, Her-2 положительный, Ki67 – 35,0 %. Герминальная мутация BRCA1 5382ins C не обнаружена. Пациентка обследована согласно действовавшим на тот момент клиническим рекомендациям. Диагноз: Рак левой молочной железы T4N2M0, IIIВ стадии (отечноинфильтративная форма), люминальный В Her-2 положительный. Проведено 4 цикла химиотерапии по схеме АС (доксорубицин 60 мг/м2, циклофосфамид 600 мг/м2, 21-дневный цикл). Отмечена выраженная положительная динамика: уменьшение размера опухоли с 3,5 до 2,0 см; отсутствие отека кожи и ареолы, а также уменьшение размеров подмышечных лимфоузлов слева.
С учетом личных обстоятельств пациентке 25.09.15 выполнена мастэктомия по Пейти слева с резекцией большой грудной мышцы. Гистологическое исследование (№№ 77036–083): инвазивная микропапиллярная карцинома молочной железы, G2, в состоянии слабого (I ст.) терапевтического патоморфоза. В 7 из 16 исследованных лимфоузлов метастазы в состоянии слабого лечебного пато-морфоза I ст. Клеток опухоли по линии резекции нет.
Далее проведено 4 цикла адъювантной химиотерапии доцетакселом (154 мг) с одновременным введением трастузумаба, химическая кастрация препаратом золадекс. По окончании химиотерапии получила послеоперационный курс дистан- ционной гамма-терапии в СОД 44 Гр на область послеоперационного рубца и пути лимфооттока в стандартном режиме фракционирования. В дальнейшем пациентка получала таргетную терапию до 1 года, гормонотерапию ингибиторами ароматазы (литразол – 2,5 мг/сут) на фоне химической кастрации, бифосфонатотерапию с профилактической целью 1 раз в полгода.
Через 5 мес после окончания таргетной терапии трастузумабом на фоне проводимой терапии литразолом и химической кастрации имело место быстрое и значимое ухудшение состояния больной – появились боли в нижних конечностях, слабость, головокружение. При ОФЭКТ скелета (18.05.17) выявлено множественное метастатическое поражение костной системы: костей свода черепа (накопление радиофармпрепарата до 216 %), тела позвонка LIV (258 %), крестца на уровне SI (184 %). По результатам МРТ головного мозга (18.05.17) выявлено множественное метастатическое поражение левой лобной доли (очаг 32×36 мм), правой височной области, правого полушария мозжечка (12×10 мм), костей свода черепа (около 10 очагов от 0,6 до 2,5 см) (рис. 1).
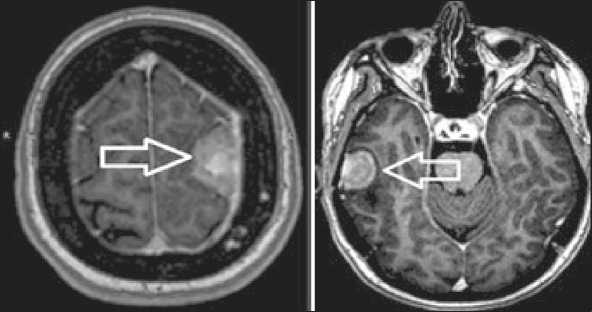
Рис. 1. МРТ (аксиальная проекция) головного мозга с контрастным усилением. В левой лобной и в правой височной долях: определяются внемозговые образования с нечеткими, неровными контурами, интенсивно, неоднородно накапливающие контрастное вещество
Fig. 1. MRI (axial projection) of the brain with contrast enhancement. In the left frontal and right temporal lobes: extracerebral lesions with indistinct, uneven contours are seen, intensively and non-uniformly accumulating contrast agent
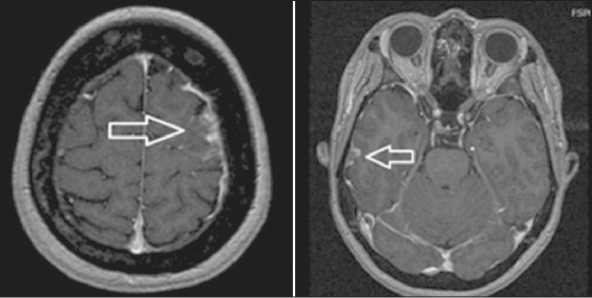
Рис. 2. МРТ (аксиальная проекция) головного мозга с контрастным усилением. В левой лобной и в правой височной долях определяются внемозговые образования с нечеткими, неровными контурами, интенсивно, неоднородно накапливающие контрастное вещество. Положительная динамика
Fig. 2. MRI (axial projection) of the brain with contrast enhancement. In the left frontal and right temporal lobes: extracerebral lesions with indistinct, uneven contours; intensively and non-uniformly accumulating contrast agent. Positive changes
Проведен паллиативный курс дистанционной гамма-терапии на весь головной мозг с захватом костей черепа, РОД 3 Гр, СОД 30 Гр. Лечение проводилось на фоне противоотечной терапии дексаметазоном 8 мг/сут. Через 2 нед после лучевой терапии выполнена лапароскопическая 2-сторонняя аднексэктомия. Гистологическое заключение (№№ 42166–177): метастазы рака молочной железы в яичники. ИГХ: ERTs – 8 баллов, PR – 0 баллов, Her2 neu +++, Ki67–20,0 %. С учетом высокой эффективности антрациклинов в анамнезе вновь начата химиотерапия по схеме АС до максимальной кумулятивной дозы доксирубицина.
При обращении пациентки для проведения химиотерапии выявлена опухоль мягких тканей нижнего века левого глаза. 4.07.17 выполнена биопсия опухоли и проведен цикл химиотерапии по схеме АС (доксирубицин – 124 мг, эндоксан – 1200 мг). Гистологическое заключение по биопсийному материалу (№№ 44358–59/17): метастаз рака молочной железы, ERTs – 8 баллов, PR – 0 баллов, Her-2 neu +++, Ki67–20,0 %.
Далее больная получила 4 цикла химиотерапии по схеме АС, трастузумаб, деносумаб до сентября 2017 г. Достигнуто значимое улучшение общего состояния, у пациентки исчезли боли, головокружения и шаткость при ходьбе. С сентября 2017 г. по решению консилиума больная переведена на следующую схему лечения: лапатиниб (1250 мг в сут) ежедневно и капецитабин (2500 мг в сут, 1–14-й день). Продолжено применение деносумаба – 120 мг, каждые 28 дней.
В первый месяц от начала терапии лапатинибом и капецитабином проведена МРТ головного мозга (27.09.17): множественные объемные образования с активным захватом контраста, предлежащие к ТМО, вероятно, внемозговые, в левой теменной доле, задней черепной ямке справа, правой височной доле. Единичные мелкие очаги накопления контраста в веществе полушарий мозжечка и в левой лобной доле. Множественные очаги в костях свода черепа. ПЭТ-КТ – исследование в режиме «все тело» с применением 18F-ФДГ (17.10.17): метастатическое поражения костей скелета с умеренной активностью части очагов. Патологический перелом средней трети VII ребра справа. Метаболически неактивные образования печени, селезенки (возможно, киста). Мелкоочаговые изменения паренхимы обоих легких. Изменения верхней доли левого легкого (вероятно, постлучевого генеза).
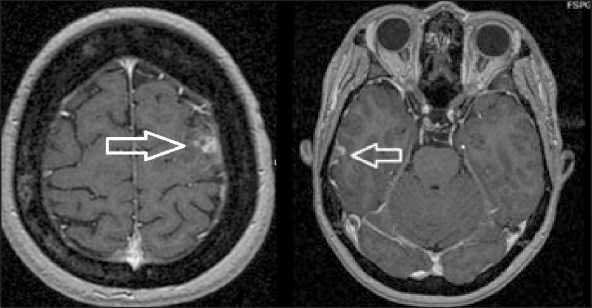
Рис. 3. МРТ (аксиальная проекция) головного мозга с контрастным усилением. В левой лобной и в правой височной долях определяются внемозговые образования с нечеткими, неровными контурами, интенсивно, неоднородно накапливающие контрастное вещество. Стабилизация
Fig. 4. MRI (axial projection) of the brain with contrast enhancement. In the left frontal and right temporal lobes: extracerebral lesions with indistinct, uneven contours; intensively and non-uniformly accumulating contrast agent. Stabilization
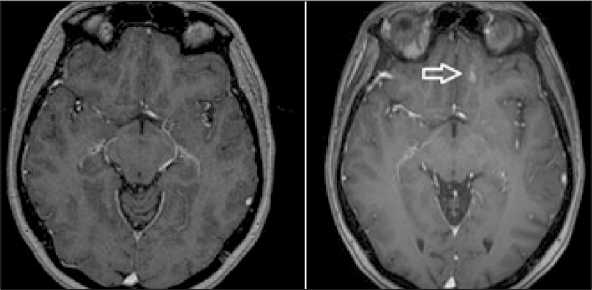
Рис. 4. МРТ (аксиальная проекция) головного мозга с контрастным усилением. В левой лобной доле появилось образование с нечеткими, неровными контурами, интенсивно, неоднородно накапливающее контрастное вещество. Прогрессирование Fig. 4. MRI (axial projection) of the brain with contrast enhancement. In the left frontal lobe: a lesion with indistinctand uneven contours; intensively, non-uniformly accumulating contrast agent. Progression
Через 5 мес от начала данной линии терапии 16.01.18 проведена МРТ головного мозга, выявлена положительная динамика в виде частичной резорбции метастатических очагов: в левой теменной области с 32×36 мм до 6×12 мм, 6×9 мм, 15×12 мм, 8×12 мм; в правой височной области без динамики 10×15×16 мм (рис. 2). При ПЭТ-КТ-контроле (18.01.18): положительная динамика за счет снижения уровня метаболической активности в большинстве метастатических очагов.
При следующем контрольном обследовании в апреле 2018 г. по данным МРТ (4.04.18) головного мозга и ПЭТ-КТ (5.04.18) без отрицательной динамики. Нежелательные явления терапии капе-цитабин + лапатиниб + эксджива не отмечены. При контрольном МРТ головного мозга (26.11.18) в левой теменной области очаги до 11×24×23 мм, 3×8×8 мм, 6×13×12 мм, в правой височной области уменьшение очага с 10×15 мм до 7×13 мм, отмечается уменьшение количества очаговых образований; по данным ПЭТ-КТ (13.12.18) – стабилизация процесса.
Осенью 2018 г., после 15 мес терапии отмечена периферическая полинейропатия I ст., купируемая терапией сопровождения. На фоне лечения пациентка чувствовала себя удовлетворительно, ECOG – 0, продолжала работать. При контрольной МРТ головного мозга с контрастным усилением (27.06.19): в левой лобной и в правой височной долях определяются внемозговые образования с нечеткими, неровными контурами, интенсивно, неоднородно накапливающие контрастное вещество. Стабилизация (рис. 3).
В ноябре 2019 г. вновь появилось образование нижнего века слева, при биопсии (11.11.19) получено гистологическое заключение (№№ 130264–73/19): метастаз рака молочной железы, ИГХ: ERTs – 0 баллов, PR – 0, HER2+++, Ki67 – 45,0 %. В связи с прогрессированием заболевания и изменением рецепторного статуса назначена следующая линия терапии: трастузумаб–эмтанзин, запланирована МРТ головного мозга. Первое введение препаратов (23.12.19) перенесла удовлетворительно, продолжается терапия деносумабом. МРТ головного мозга с контрастным усилением (9.01.20): множественные образования, появились 2 новых очага, в правой и левой лобных долях – 5 и 12 мм соответственно. Констатировано прогрессирование (рис. 4).
Обсуждение
Пациентки с Her-2 положительным и базальноподобным РМЖ имеют в 3,6–5,3 раза более вы- сокий риск развития метастазов в головной мозг, чем при люминальном A подтипе [8]. Несмотря на выраженное неблагоприятное влияние метастазов в головной мозг на прогноз, в реальной клинической практике все чаще встречаются пациентки с длительным периодом стабилизации заболевания при Her-2 положительном РМЖ, что может свидетельствовать об эффективности соответствующей терапии.
Список литературы Клинический результат длительного контроля заболевания при HER-2 положительном диссеминированном раке молочной железы с метастазами в головной мозг у пациентки фертильного возраста
- Kaprin A.D., Starinskii V.V., Petrova G.V. Zlokachestvennye novoobrazovaniya v Rossii v 2018 g. (Zabolevaemost' i smertnost'). M., 2019. 4-25.
- Andres R., Mayordomo J., Isla D. Capecitabine p1us gemcitabine is an active combination for patients with metastatic breast cancer refractory to anthracyclines and taxanes. Proc Am Sos Clin Oncol. 2003; 22: 89.
- Baklanov A.S., Petrushina N.N. Osobennosti metastazirovaniya v golovnoi mozg patsientok s lyuminal'nym podtipom raka molochnoi zhelezy; Al'manakh klinicheskoi meditsiny. 2016; 44(5): 635-639.
- Witzel I., Oliveira-Ferrer L., Pantel K., Müller V., Wikman H. Breast cancer brain metastases: biology and new clinical perspectives. Breast Cancer Res. 2016 Jan 19; 18(1): 8. https://doi.org/10.1186/s13058-015-0665-1.
- Niikura N., Hayashi N., Masuda N., Takashima S., Nakamura R., Watanabe K., Kanbayashi C., Ishida M., Hozumi Y., Tsuneizumi M., Kondo N., Naito Y., Honda Y., Matsui A., Fujisawa T., Oshitanai R., Yasojima H., Tokuda Y., Saji S., Iwata H. Treatment outcomes and prognostic factors for patients with brain metastases from breast cancer of each subtype: a multicenter retrospective analysis. Breast Cancer Res Treat. 2014 Aug; 147(1): 103-12. https://doi.org/10.1007/s10549-014-3090-8.
- Kvinikadze R.D. Sovremennoe napravlenie lekarstvennoi terapii disseminirovannogo raka molochnoi zhelezy (Obzor literatury). Vestnik RNTsRR. 2012; 12.
- O A.S., D'yachenko V.G. Targetnaya terapiya i kachestvo zhizni patsientok, stradayushchikh rakom molochnoi zhelezy. Dal'nevostochnyi meditsinskii zhurnal. 2014; 4: 31-34.
- Kennecke H., Yerushalmi R., Woods R., Cheang M.C., Voduc D., Speers C.H., Nielsen T.O., Gelmon K. Metastatic behavior of breast cancer subtypes. J Clin Oncol. 2010 Jul 10; 28(20): 3271-7. https://doi.org/10.1200/JCO.2009.25.9820.
- Bachelot T., Romieu G., Campone M., Diéras V., Cropet C., Dalenc F., Jimenez M., Le Rhun E., Pierga J.Y., Gonçalves A., Leheurteur M., Domont J., Gutierrez M., Curé H., Ferrero J.M., Labbe-Devilliers C. Lapatinib plus capecitabine in patients with previously untreated brain metastases from HER2-positive metastatic breast cancer (LANDSCAPE): a single-group phase 2 study. Lancet Oncol. 2013; 14(1): 64-71. https://doi.org/10.1016/S1470-2045(12)70432-1.
- Pivot X., Manikhas A., Żurawski B., Chmielowska E., Karaszewska B., Allerton R., Chan S., Fabi A., Bidoli P., Gori S., Ciruelos E., Dank M., Hornyak L., Margolin S., Nusch A., Parikh R., Nagi F., DeSilvio M., Santillana S., Swaby R.F., Semiglazov V. CEREBEL (EGF111438): A Phase III, Randomized, Open-Label Study of Lapatinib Plus Capecitabine Versus Trastuzumab Plus Capecitabine in Patients With Human Epidermal Growth Factor Receptor 2-Positive Metastatic Breast Cancer. J Clin Oncol. 2015 May 10; 33(14): 1564-73. https://doi.org/10.1200/JCO.2014.57.1794.
- Brown P.D., Ballman K.V., Cerhan J.H., Anderson S.K., Carrero X.W., Whitton A.C., Greenspoon J., Parney I.F., Laack N.N.I., Ashman J.B., Bahary J.P., Hadjipanayis C.G., Urbanic J.J., Barker F.G. 2nd, Farace E., Khuntia D., Giannini C., Buckner J.C., Galanis E., Roberge D. Postoperative stereotactic radiosurgery compared with whole brain radiotherapy for resected metastatic brain disease (NCCTG N107C/CEC·3): a multicentre, randomised, controlled, phase 3 trial. Lancet Oncol. 2017 Aug; 18(8): 1049-1060. https://doi.org/10.1016/S1470-2045(17)30441-2.


