Клинический случай длительного успешного использования поддерживающей терапии ингибиторами PARP в первичном лечении распространенного BRCA-ассоциированного рака яичников
Автор: Чуруксаева О.Н., Коломиец Л.А., Виллерт А.Б.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 4 т.22, 2023 года.
Бесплатный доступ
Актуальность. Рак яичников в структуре злокачественных новообразований женских репродуктив-ных органов находится на 3-м месте после рака шейки и тела матки, в 2/3 случаев диагностируется III-IV стадия заболевания. Применение поддерживающей терапии PARP-ингибиторами обеспечивает более продолжительную безрецидивную и общую выживаемость. Цель исследования - демонстрация длительной ремиссии при распространенном раке яичников на фоне поддерживающей терапии ингибиторами PARP (олапарибом). Описание клинического случая. Пациентка, 54 лет, с верифи-цированным раком яичников IV стадии, канцероматозом брюшины и метастатическим плевритом слева, получившая комбинированное лечение, включающее 2 курса неоадъювантной химиотерапии«паклитаксел/карбоплатин», циторедуктивную операцию и 6 курсов послеоперационной химиотерапии «доцетаксел/цисплатин». Методом секвенирования ДНК опухолевой ткани у больной выявлена соматическая мутация в гене BRCA2 (c.3708delA). В дальнейшем ей назначен препарат олапариб в качестве поддерживающей терапии. Продолжительность приема препарата составляет 38 мес, данных за прогрессирование заболевания нет. заключение. Продемонстрирована возможность использования поддерживающей терапии PARP-ингибиторами у пациентки с изначально диссеминированной злокачественной опухолью яичника, чувствительной к препаратам платины. В наблюдении отражен персонифицированный подход к лечению. Прием олапариба в качестве поддерживающей терапии обеспечивает стойкую длительную ремиссию при отсутствии нежелательных явлений с сохранением удовлетворительного качества жизни больной.
Рак яичников, brca-мутация, ингибиторы parp
Короткий адрес: https://sciup.org/140302017
IDR: 140302017 | УДК: 618.11-006.6-08 | DOI: 10.21294/1814-4861-2023-22-4-135-141
Текст научной статьи Клинический случай длительного успешного использования поддерживающей терапии ингибиторами PARP в первичном лечении распространенного BRCA-ассоциированного рака яичников
Злокачественные новообразования яичников сохраняют лидирующие позиции в структуре смертности среди гинекологических опухолей. Несмотря на первоначально высокую чувствительность рака яичников (РЯ) к химиотерапии, у большинства пациенток с распространенными формами заболевания развиваются рецидивы. При рецидивах заболевания часто наблюдается резистентность к химиотерапии. Под влиянием химиотерапевтических препаратов опухоль с течением времени становится малочувствительной к цитостатикам [1].
Терапия рецидивов РЯ направлена как на сохранение чувствительности опухолевых клеток к производным платины, так и на увеличение времени между рецидивами заболевания [2, 3]. Большая роль в этом отводится внедрению поддерживающей терапии после цитостатической терапии. Данные литературы свидетельствуют о положительной корреляции между поддерживающей терапией ингибиторами PARP и показателями общей и безрецидивной выживаемости [4, 5]. Недавно опубликованные данные метаанализа показали преимущества PARP-ингибиторов перед бевацизумабом в лечении платиночувствительного рецидивирующего РЯ [6].
В исследовании PRIMA III фазы 733 пациентки с высокодифференцированным серозным или эндометриоидным РЯ, ответившие на химиотерапию на основе платины, после начальной адъювантной химиотерапии были рандомизированы на группу с поддерживающим лечением нирапарибом и группу плацебо. У больных раком яичников с дефицитом гомологичной рекомбинации, в том числе с мутациями BRCA, выживаемость без прогрессирования была более продолжительной при приеме нирапариба (22 vs 10 мес). У больных, имеющих опухоли с отсутствием дефицита гомологичной рекомбинации, выживаемость без прогрессирования была выше, чем в группе плацебо (8,1 vs 5,4 мес). По результатам исследования FDA в апреле 2020 г. одобрило применение нирапариба в качестве поддерживающей терапии у больных с распространенным эпителиальным РЯ с полным или частичным ответом на адъювантную химиотерапию препаратами платины [7].
В плацебо-контролируемое исследование VELIA III фазы было включено 1 140 пациенток с РЯ, рандомизированных на химиотерапию на основе платины (контрольная группа), химиотерапию на основе платины с велипарибом с последующей плацебо-поддерживающей терапией и группу химиотерапии на основе платины с велипарибом и поддерживающую терапию велипарибом (вели-париб на протяжении всего лечения). У пациенток с герминальными или соматическими мутациями BRCA, получавших велипариб на протяжении всего лечения, выживаемость без прогрессирования составила 35 мес vs 22 мес в контрольной группе; у пациенток с дефицитом гомологичной рекомбинации (включая женщин с мутациями BRCA) выживаемость без прогрессирования составила 32 мес vs 21 мес. Во всей когорте преимущество в выживаемости без прогрессирования составило 24 мес vs 17 мес [8].
Стратегия длительности приема олапариба предусматривает возможность использования препарата до 2 лет непрерывного режима либо до непереносимой токсичности (NCCN, 2022 г.). Несмотря на общий механизм действия, отдельные PARP-ингибиторы демонстрируют различный профиль безопасности. Наиболее распространенными побочными эффектами ингибиторов PARP являются гематологическая токсичность (анемия, тромбоцитопения, нейтропения) и желудочнокишечные симптомы (тошнота, рвота, диарея). В целом, данные препараты хорошо переносятся пациентками, и побочные эффекты часто легко устраняются.
Клинический случай
Пациентка Б., 54 лет, впервые обратилась в НИИ онкологии Томского НИМЦ в июле 2018 г. При обращении предъявляла жалобы на увеличение живота в объеме, общую слабость. Из анамнеза: в январе 2018 г. на фоне отсутствия менструации в течение 9 мес началось обильное кровотечение. В феврале 2018 г. продолжались ациклические мажущие выделения. При обращении к гинекологу на ультразвуковом исследовании органов малого таза (ОМТ) выявлены объемные образования яичников. В июне 2018 г. отметила увеличение живота в объеме, одышку. 12.07.18 выполнено раздельное диагностическое выскабливание. Гистологически данные за железисто-фиброзный полип эндометрия.
Пациентка имела две беременности, закончившиеся родами, без осложнений. Ранее гинекологических заболеваний не отмечала. Гинекологический статус: наружные половые органы сформированы правильно, оволосение по женскому типу, паховые лимфоузлы не увеличены. Влагалище емкое, слизистая розовая. Шейка матки цилиндрической формы, чистая. Своды эластичные. Матка отклонена кзади, оттеснена двусторонними объемными образованиями, исходящими из яичников и занимающими весь малый таз и выходящими в брюшную полость. Подвижность относительно сохранена. При комплексном обследовании выявлен асцит, канцероматоз брюшины, левосторонний плеврит. Уровень маркера СА-125 (12.07.18) – 4194 Ед/мл. Пациентке выполнен лапароцентез, удалено 5 л светлой асцитической жидкости. Цитологическое исследование выявило комплексы опухолевых клеток на фоне мезотелия. Выставлен диагноз: Рак яичников сTхNxM1. Полисерозит. Сопутствующие заболевания: Сахарный диабет 2 типа, целевой HbA1C<7,5 %, декомпенсация (достигнутый HbA1C=9,1 %). Диабетическая нефропатия, протеинурия (0,150 г/л), гиперфильтрация. Стеатогепатоз. АГ в анамнезе, целевое АД, риск 4. ГЭРБ, катаральный рефлюкс-эзофагит. Хронический калькулезный холецистит. Варикозная болезнь вен нижних конечностей.
Проведен онкологический консилиум для определения тактики ведения больной: учитывая цитологическую верификацию диагноза, распространенный процесс, высокие опухолевые маркеры, наличие полисерозита. Решено начать лечение с химиотерапии.
В августе 2018 г. проведены 2 курса неоадъювантной химиотерапии по схеме паклитаксел в дозе 175 мг/м2 + карбоплатин по AUC 5. Лечение сопровождалось анемией легкой степени. Отмечалась выраженная положительная динамика в виде снижения маркеров: СА-125 – 2180, НЕ-4 – 685 рМ (август 2018 г.), СА-125 – 1060, НЕ-4 – 451 рМ (сентябрь 2018 г.). В то же время при оценке объективного ответа опухоли на проводимую терапию, согласно критериям RECIST, установлена стабилизация процесса.
Для определения дальнейшей тактики лечения проведен консилиум в составе онкогинеколога, терапевта, анестезиолога, химиотерапевта . Учитывая положительную динамику после курсов химиотерапии в виде уменьшения объема внутриплевральной жидкости, нормализацию показателей функции внешнего дыхания, снижение опухолевых маркеров, решено выполнить хирургическое вмешательство.
27.09.18 выполнена циторедуктивная операция лапаротомным доступом. При ревизии: в брюшной полости – большое количество асцитической жидкости. В рану предлежат 2 объемных образования, исходящие из яичников и выходящие в брюшную полость, размерами – справа до 20 см, слева – до 25 см, с гладкой капсулой грязно-серого цвета. Сальник частично подпаян к передней брюшной стенке в области слепой кишки. Печень визуально не изменена. Отмечаются мелкие диссеминаты в Дугласовом пространстве и на брюшине ректо-сигмоидного отдела. По брюшине среднего и верхнего этажа брюшной полости диссеминатов нет. Справа образование уходит за-брюшинно, выраженная инфильтрация брюшины над сосудами, последние не компрометированы. Опухоль прорастает правую крестцово-маточную связку, прямокишечно-маточную складку. После удаления основного опухолевого конгломерата сохраняется резидуальная опухоль, размером до 4 см на брюшине, прилежащая интимно к со- судистому пучку. При попытке ее мобилизации отмечалась повышенная кровоточивость, в связи с чем прекращены дальнейшие попытки удалить остаточную опухоль. Инфильтрированы ткани, окружающие правый мочеточник, последний выделен до парацервикса. Кровопотеря – 1200 мл, восполнена в полном объеме. Тугая тампонада. Выполнена экстирпация матки, оментэктомия. В ложе остаточной опухоли установлены гемостатические губки. Брюшная стенка ушита послойно с оставлением дренажа в левой гипогастральной области. Таким образом, выполнена циторедуктивная операция в неоптимальном объеме (рис. 1). Послеоперационный период протекал без осложнений.
Послеоперационная гистология (№ 26618–56/18 от 3.10.18): residual high-grade серозная карцинома яичников (состояние после 2 курсов химиотерапии) с вовлечением сальника. CRS 2: частичный ответ опухоли. Выявлена соматическая мутация в гене BRCA2 (c.3708delA) методом секвенирования ДНК опухолевой ткани.
Консультация химиотерапевта: учитывая результаты морфологического исследования, сохраняющееся умеренное количество жидкости в плевральной полости слева, рекомендовано изменить схему химиотерапии, назначена комбинация доцетаксел в дозе 75 мг/м2 + цисплатин в дозе 75 мг/м2. Проведено 6 курсов послеоперационной химиотерапии по вышеуказанной схеме. Лечение осложнилось анемией легкой степени (гемоглобин – 116 г/) и токсической нефропатией (мочевина – 13,9 ммоль/л, креатинин – 109 мкмоль/л), завершено в марте 2019 г. При контрольном обследовании объемных образований в малом тазу и брюшной полости, а также жидкости в плевральной полости не выявлено. Уровень опухолевых маркеров (05.03.19): СА-125 – 5,1 Ед/мл, НЕ-4 – 173 рМ. Объективный ответ после лечения расценен как полная регрессия. При контрольном обследовании в июле 2019 г. также не выявлено признаков прогрессирования заболевания.
В НИИ онкологии Томского НИМЦ проведен консилиум, где пациентке рекомендована поддерживающая терапия PARP-ингибитором – препаратом олапариб в поддерживающем режиме, учитывая наличие BRCA 2-мутации и полную регрессию опухоли. С июля 2019 г. получала олапариб в дозе 150 мг в таблетках по 2 таблетки 2 раза в день (600 мг в сутки) по Программе Раннего доступа. Переносимость была удовлетворительной, нежелательные явления не наблюдались.
C декабря 2020 г. по август 2021 г. продолжала терапию препаратом олапариб в капсулах в дозе 400 мг 2 раза в день. С сентября 2021 г. по настоящее время принимает олапариб в дозе 600 мг/сут (по 150 мг – 2 таблетки дважды в день). Побочных эффектов при приеме не отмечается, у пациентки сохраняется удовлетворительное качество жизни. В мае 2023 г. выполнялось плановое обследование, признаков прогрессирования заболевания обнаружено не было. Таким образом, продолжительность приема препарата на июль 2023 г. составляет 48 мес, общая выживаемость – 60 мес, время без прогрессирования – 52 мес..
Обсуждение
Основным методом лечения рака яичников в настоящее время является комбинированный, сочетающий полную циторедуктивную операцию с
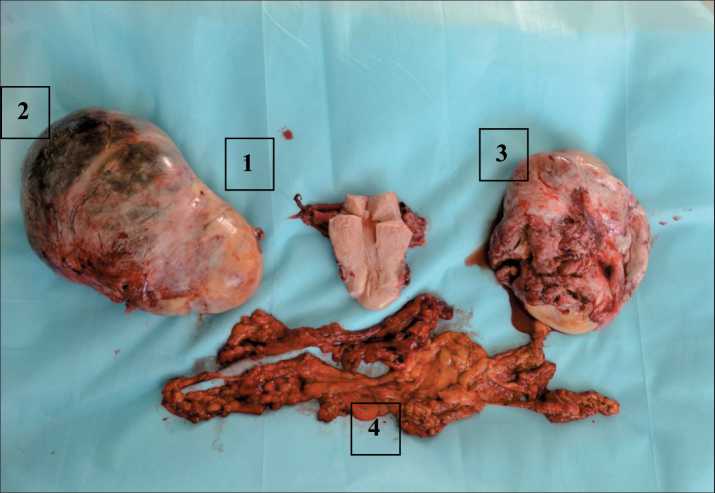
Рис. 1. Операционный макропрепарат:
1 – матка с трубами; 2 – опухоль правого яичника; 3 – опухоль левого яичника; 4 – сальник
Fig. 1. Surgical specimen: 1 – uterus with fallopian tubes, 2 – tumor of the right ovary, 3 – tumor of the left ovary, 4 – omentum
последующей химиотерапией препаратами платины и таксанами. Однако несмотря на эффективность первичного лечения, у 70–80 % пациенток развивается рецидив заболевания, что приводит к летальному исходу [9, 10].
Наиболее обнадеживающим способом увеличения эффективности лечения является внедрение поддерживающей терапии после окончания химиотерапии. Внедрение таргетных препаратов, таких как антиангиогенный препарат бевацизумаб и ингибитор PARP (поли (АДФ-рибозы) полимеразы) олапариб, способствует не только повышению эффективности терапии, но и подбору индивидуальных терапевтических опций. Олапариб – первый ингибитор PARP, зарегистрированный в Европейском союзе и России в монорежиме в качестве поддерживающего лечения пациенток с high-grade серозным раком яичников при чувствительном к платине рецидиве, при условии наличия BRCA-мутации (герминальной и/или соматической), у которых зафиксирован полный или частичный ответ на платиносодержащую химиотерапию (NCCN, 2022).
Мутации BRCA играют важную роль в развитии рака яичников. Считается, что примерно 35 % носителей мутации BRCA не имеют семейной истории мутации BRCA. Более трети рецидивов, чувствительных к платине, имеют мутации BRCA. Примерно 6 % случаев рака яичников имеют соматическую мутацию BRCA без наличия герминальной мутации. Соматические и герминальные мутации в генах BRCA1 и 2 приводят к потере функции BRCA [11]. Особенностями BRCA-ассоциированного рака являются более благоприятный прогноз, повышенная чувствительность к препаратам платины и некоторым цитостатикам [12].
Семейство белков PARP участвует в одной из самых важных систем репарации повреждений ДНК – эксцизионной репарации азотистых оснований. Репарация повреждения ДНК необходима для поддержания геномной стабильности. Белки, кодируемые генами BRCA1 и 2, участвуют в восстановлении разрывы двухцепочечной ДНК. В результате утраты функции этими генами опухолевые клетки становятся более зависимыми от альтернативного пути восстановления ДНК – механизма восстановления одноцепочечной ДНК. PARP является одним из главных компонентов репарации одноцепочечной ДНК, его ингибирование полностью предотвращает функцию восстановления ДНК в опухолевых клетках с дефицитом BRCA после повреждения, вызванного химиотерапией [13–15].
Основанием для назначения препарата в качестве поддерживающей терапии послужили результаты двух крупных рандомизированных плацебо-контролируемых исследований олапариба при РЯ III фазы. В SOLO1 включены больные РЯ III–IV стадии после первой линии химиотерапии, в
SOLO2, по крайней мере, после двух предыдущих линий химиотерапии [16, 17]. В SOLO1 терапия олапарибом показала в целом снижение риска прогрессирования заболевания на 70 % (ОР 0,30 (95 % ДИ 0,23–0,41), р<0,001). При медиане безре-цидивной выживаемости, равной 56 мес, при терапии олапарибом в течение 25 мес, положительный эффект сохраняется и после терапии олапарибом, что позволяет надеяться и на улучшение показателей общей выживаемости. Только 12 % пациенток прекратили прием олапариба из-за токсичности.
В исследование SOLO2 были включены 295 пациенток с платиночувствительным рецидивом high-grade серозного рака яичников с подтвержденным наличием мутации в генах BRCA1/2, которым была проведена стандартная платиносодержащая химиотерапия и отмечено достижение объективного ответа (уменьшение опухоли на ≥30 %). Монотерапия олапарибом в дозе 400 мг × 2 раза в сут имела преимущество перед плацебо. По результатам исследования медиана продолжительности жизни составила 51,7 мес в группе олапариба по сравнению с 38,8 мес в группе плацебо (ОР 0,74; 95 % ДИ 0,54–1,00; p=0,053), снижение относительного риска смерти составило 26 % по сравнению с группой плацебо. При сравнении группы олапариба с пациентками из группы плацебо, не получавшими олапариб после выбывания из исследования, снижение риска смерти составило 44 % [18].
Основными побочными эффектами, наблюдавшимися у некоторых пациенток при приеме ола-париба, были усталость (30 %), тошнота (32 %) и анемия (5 %) [19]. Подчеркнем, что нежелательных явлений у нашей пациентки за весь период приема препарата не отмечалось.
В настоящее время проводится рандомизированное контролируемое многоцентровое исследование SOLO3, целью которого является оценка эффективности и безопасности олапариба по сравнению со стандартом лечения на основе выбора врачом одноагентной химиотерапии (паклитаксел, или топотекан, или пегилированный липосомальный доксорубицин, или гемцитабин). В исследование входят пациентки с платино чувствительным или частично платино чувствительным рецидивирующим РЯ, имеющие герминальную BRCA-мутацию. Олапариб применяется в дозе 300 мг дважды в день. Олапариб приводил к статистически и клинически значимым улучшениям объективного ответа и безрецидивной выживаемости по сравнению с неплатиновой химиотерапией у пациенток с рецидивирующим РЯ. Объективный ответ в группе олапариба составил 72,2 vs 51,4 %, при этом полная регрессия была у 9,3 vs 2,8 %. Безрецидивная выживаемость составила 13,4 мес у пациенток, принимающих олапариб, у получающих неплатиновую химиотерапию – 9,2 мес [20].
Заключение
В настоящее время анализ на BRCA-мутационный статус – первый шаг на пути к индивидуальным стратегиям лечения больных раком яичников, определяющий терапевтические опции при данном заболевании. Успешное применение поддерживающей терапии PARP-ингибиторами у платиночувствительных больных РЯ с BRCA- ассоциированным раком при условии полного объективного ответа после проведенного комбинированного лечения, несмотря на неоптимальную циторедукцию, обеспечивает длительный без-рецидивный период с высоким качеством жизни, а также дает шанс на увеличение сроков общей выживаемости даже у пациенток с диссеминированным раком яичников.
Список литературы Клинический случай длительного успешного использования поддерживающей терапии ингибиторами PARP в первичном лечении распространенного BRCA-ассоциированного рака яичников
- Селедцов В.И., Селедцова Г.В., Доржиева А.Б., Иванова И.П. Иммунотерапия в комплексном лечении опухолевых заболеваний. Сибирский онкологический журнал. 2022; 21(2): 118–29. [Seledtsov V.I., Seledtsova G.V., Dorzhieva A.B., Ivanova I.P. Immunotherapy in the complex treatment of tumor diseases. Siberian Journal of Oncology. 2022; 21(2): 118–29. (in Russian)]. doi: 10.21294/1814-4861-2022-21-2-118-129.
- Mullen M.M., Kuroki L.M., Thaker P.H. Novel treatment options in platinum-sensitive recurrent ovarian cancer: A review. Gynecol Oncol. 2019; 152(2): 416–25. doi: 10.1016/j.ygyno.2018.10.023.
- Kurnit K.C., Fleming G.F., Lengyel E. Updates and New Options in Advanced Epithelial Ovarian Cancer Treatment. Obstet Gynecol. 2021; 137(1): 108–21. doi: 10.1097/AOG.0000000000004173.
- Endo S., Shigeta S., Tokunaga H., Shimizu T., Hasegawa-Minato J., Hashimoto C., Ishibashi M., Nagai T., Shiga N., Shimada M., Yaegashi N. A Retrospective Analysis of Clinical Biomarkers for Olaparib Maintenance Therapy in Patients with Recurrent Ovarian Cancer. Tohoku J Exp Med. 2022; 258(1): 1–9. doi: 10.1620/tjem.2022.J050.
- Ledermann J., Harter P., Gourley C., Friedlander M., Vergote I., Rustin G., Scott C.L., Meier W., Shapira-Frommer R., Safra T., Matei D., Fielding A., Spencer S., Dougherty B., Orr M., Hodgson D., Barrett J.C., Matulonis U. Olaparib maintenance therapy in patients with platinum-sensitive relapsed serous ovarian cancer: a preplanned retrospective analysis of outcomes by BRCA status in a randomised phase 2 trial. Lancet Oncol. 2014; 15(8): 852–61. doi: 10.1016/S1470-2045(14)70228-1. Erratum in: Lancet Oncol. 2015; 16(4).
- Bartoletti M., Pelizzari G., Gerratana L., Bortot L., Lombardi D., Nicoloso M., Scalone S., Giorda G., Baldassarre G., Sorio R., Puglisi F. Bevacizumab or PARP-Inhibitors Maintenance Therapy for Platinum- Sensitive Recurrent Ovarian Cancer: A Network Meta-Analysis. Int J Mol Sci. 2020; 21(11): 3805. doi: 10.3390/ijms21113805.
- González-Martín A., Pothuri B., Vergote I., DePont Christensen R., Graybill W., Mirza M.R., McCormick C., Lorusso D., Hoskins P., Freyer G., Baumann K., Jardon K., Redondo A., Moore R.G., Vulsteke C., O’Cearbhaill R.E., Lund B., Backes F., Barretina-Ginesta P., Haggerty A.F., Rubio-Pérez M.J., Shahin M.S., Mangili G., Bradley W.H., Bruchim I., Sun K., Malinowska I.A., Li Y., Gupta D., Monk B.J.; PRIMA/ENGOTOV26/GOG-3012 Investigators. Niraparib in Patients with Newly Diagnosed Advanced Ovarian Cancer. N Engl J Med. 2019; 381(25): 2391–2402. doi: 10.1056/NEJMoa1910962.
- Coleman R.L., Fleming G.F., Brady M.F., Swisher E.M., Steffensen K.D., Friedlander M., Okamoto A., Moore K.N., Efrat Ben-Baruch N., Werner T.L., Cloven N.G., Oaknin A., DiSilvestro P.A., Morgan M.A., Nam J.H., Leath C.A., Nicum S., Hagemann A.R., Littell R.D., Cella D., Baron-Hay S., Garcia-Donas J., Mizuno M., Bell-McGuinn K., Sullivan D.M., Bach B.A., Bhattacharya S., Ratajczak C.K., Ansell P.J., Dinh M.H., Aghajanian C., Bookman M.A. Veliparib with First-Line Chemotherapy and as Maintenance Therapy in Ovarian Cancer. N Engl J Med. 2019; 381(25): 2403–15. doi: 10.1056/NEJMoa1909707.
- Хохлова С.В. Новое в лечении high-grade серозного рака яичников. Эффективная фармакотерапия. 2019; 15(38): 24–9. [Khokhlova S.V. New in the treatment of high-grade serous ovarian cancer. Effective Pharmacotherapy. 2019; 15(38): 24–9. (in Russian)]. doi: 10.33978/2307-3586-2019-15-38-24-29.
- Jelovac D., Armstrong D.K. Recent progress in the diagnosis and treatment of ovarian cancer. CA Cancer J Clin. 2011; 61(3): 183–203. doi: 10.3322/caac.20113.
- Friedrich M., Friedrich D., Kraft C., Rogmans C. Multimodal Treatment of Primary Advanced Ovarian Cancer. Anticancer Res. 2021; 41(7): 3253–60. doi: 10.21873/anticanres.15111.
- Bolton K.L., Chenevix-Trench G., Goh C., Sadetzki S., Ramus S.J., Karlan B.Y., Lambrechts D., Despierre E., Barrowdale D., McGuffog L., Healey S., Easton D.F., Sinilnikova O., Benítez J., García M.J., Neuhausen S., Gail M.H., Hartge P., Peock S., Frost D., Evans D.G., Eeles R., Godwin A.K., Daly M.B., Kwong A., Ma E.S., Lázaro C., Blanco I., Montagna M., D’Andrea E., Nicoletto M.O., Johnatty S.E., Kjær S.K., Jensen A., Høgdall E., Goode E.L., Fridley B.L., Loud J.T., Greene M.H., Mai P.L., Chetrit A., Lubin F., Hirsh-Yechezkel G., Glendon G., Andrulis I.L., Toland A.E., Senter L., Gore M.E., Gourley C., Michie C.O., Song H., Tyrer J., Whittemore A.S., McGuire V., Sieh W., Kristoffersson U., Olsson H., Borg Å., Levine D.A., Steele L., Beattie M.S., Chan S., Nussbaum R.L., Moysich K.B., Gross J., Cass I., Walsh C., Li A.J., Leuchter R., Gordon O., Garcia-Closas M., Gayther S.A., Chanock S.J., Antoniou A.C., Pharoah P.D.; EMBRACE; kConFab Investigators; Cancer Genome Atlas Research Network. Association between BRCA1 and BRCA2 mutations and survival in women with invasive epithelial ovarian cancer. JAMA. 2012; 307(4): 382–90. doi: 10.1001/jama.2012.20.
- Покатаев И.А. Место ингибиторов PARP в терапии рецидивов рака яичников. Онкогинекология. 2017; (4): 37–46. [Pokataev I.A. The place of PARP inhibitors in the treatment of recurrent ovarian cancer. Oncogynecology. 2017; (4): 37–46. (in Russian)].
- Helleday T., Petermann E., Lundin C., Hodgson B., Sharma R.A. DNA repair pathways as targets for cancer therapy. Nat Rev Cancer. 2008;8(3): 193–204. doi: 10.1038/nrc2342.
- Ledermann J.A. PARP inhibitors in ovarian cancer // PARP inhibitors in ovarian cancer. Ann Oncol. 2016; 27 (s1): 40–4. doi: 10.1093/annonc/mdw094.
- Moore K., Colombo N., Scambia G., Kim B.G., Oaknin A., Friedlander M., Lisyanskaya A., Floquet A., Leary A., Sonke G.S., Gourley C., Banerjee S., Oza A., González-Martín A., Aghajanian C., Bradley W.,Mathews C., Liu J., Lowe E.S., Bloomfield R., DiSilvestro P. Maintenance Olaparib in Patients with Newly Diagnosed Advanced Ovarian Cancer. N Engl J Med. 2018; 379(26): 2495–2505. doi: 10.1056/NEJMoa1810858.
- DiSilvestro P., Colombo N., Scambia G., Kim B.G., Oaknin A., Friedlander M., Lisyanskaya A., Floquet A., Leary A., Sonke G.S., Gourley C., Banerjee S., Oza A., González-Martín A., Aghajanian C.A., Bradley W.H., Mathews C.A., Liu J., Lowe E.S., Bloomfield R., Moore K.N. Efficacy of Maintenance Olaparib for Patients With Newly Diagnosed Advanced Ovarian Cancer With a BRCA Mutation: Subgroup Analysis Findings From the SOLO1 Trial. J Clin Oncol. 2020; 38(30): 3528–37. doi: 10.1200/JCO.20.00799. Erratum in: J Clin Oncol. 2021; 39(12): 1414.
- Poveda A., Floquet A., Ledermann J.A., Asher R. Final overall survival results from SOLO2/ENGOT-ov21: a Phase III trial assessing maintenance olaparib in patients with platinum-sensitive, relapsed ovarian cancer and a BRCA mutation. J Clin Oncol. 2020; 38(15s): 6002. doi: 10.1200/JCO.2020.38.15_suppl.6002.
- Fong P.C., Boss D.S., Yap T.A., Tutt A., Wu P., Mergui-Roelvink M., Mortimer P., Swaisland H., Lau A., O’Connor M.J., Ashworth A., Carmichael J., Kaye S.B., Schellens J.H.M., de Bono J.S. Inhibition of Poly(ADPRibose) Polymerase in Tumors from BRCA Mutation Carriers. N Engl J Med. 2009; 361: 123–34. doi: 10.1056/NEJMoa0900212.
- Penson R.T., Valencia R.V., Cibula D., Colombo N., Leath C.A., Bidziński M., Kim J.W., Nam J.H., Madry R., Hernández C., Mora P.A.R., Ryu S.Y., Milenkova T., Lowe E.S., Barker L., Scambia G. Olaparib Versus Nonplatinum Chemotherapy in Patients With Platinum-Sensitive Relapsed Ovarian Cancer and a Germline BRCA1/2 Mutation (SOLO3): A Randomized Phase III Trial. J Clin Oncol. 2020; 38(11): 1164–74. doi: 10.1200/JCO.19.02745.


