Клинический случай ишемического инсульта у пациента с небактериальным тромботическим эндокардитом
Автор: Рамазанов Г. Р., Ахматханова Л. Х.-Б., Хуцишвили Л. Г., Каниболоцкий А. А., Петриков С. С.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клинический случай
Статья в выпуске: 4 (58), 2022 года.
Бесплатный доступ
Ишемический инсульт при онкологических заболеваниях возникает как вследствие вызываемого раком протромботического эффекта, так и на фоне противоопухолевой терапии. При рецидивирующей системной эмболии у пациентов с онкологическим анамнезом следует в первую очередь исключить кардиоэмболию. В большинстве случаев причиной церебральной эмболии при онкологических заболеваниях служит небактериальный тромботический эндокардит, диагностика которого основана на эхокардиографии, предпочтительно чреспищеводной. В данной статье представлен клинический случай ишемического инсульта, развившегося на фоне марантического эндокардита, методы верификации и лечения.
Кардиоэмболический инсульт, марантический эндокардит, аденокарцинома легкого, криптогенный инсульт
Короткий адрес: https://sciup.org/143179121
IDR: 143179121 | УДК: 616-009.86+ | DOI: 10.20340/vmi-rvz.2022.4.CASE.4
Текст научной статьи Клинический случай ишемического инсульта у пациента с небактериальным тромботическим эндокардитом
УДК 616-009.86+616.1:616-02
Несмотря на развитие диагностических технологий, в среднем у 25 % пациентов с ишемическим инсультом (ИИ) не удается установить причины и механизмы развития острого нарушения мозгового кровообращения, и, как следствие, остается неясной оптимальная вторичная профилактика [1]. Среди потенциальных причин острой церебральной ишемии у пациентов с криптогенным инсультом (КИ) следует рассмотреть открытое овальное окно, парадоксальную эмболию, атерому дуги аорты, неатеросклеротическую васкулопатию, гиперкоагуляционные синдромы, а также онкологические заболевания (ОЗ). Подобная неоднородность группы пациентов с КИ, по всей видимости, и обусловила негативные результаты исследований NAVIGATE ESUS (2018 г.) и RESPECT ESUS (2019 г.), целью которых служила оценка эффективности и безопасности ривароксабана и дабигатрана этексилата в профилактике повторного ИИ и/или системной эмболии [10, 11] . В результате исследований не установлено превосходство пероральных антикоагулянтов (ПОАК) над ацетилсалициловой кислотой в профилактике повторного ИИ и/или системной эмболии у пациентов с КИ. При этом частота кровотечений у пациентов, получавших ПОАК, оказалась выше по сравнению с ацетилсалициловой кислотой.
Установлено, что у 10–20 % пациентов с КИ выявляют онкологические заболевания [2, 3]. Более того, ИИ может явиться первым проявлением ОЗ [4–6]. В настоящее время можно выделить следующие патогенетические механизмы развития ИИ у пациентов с онкологическими заболеваниями: непосредственная церебральная эмболия опухолевыми клетками, внутрисосудистое свертывание крови (тромбоз in situ), ускорение атеросклероза на фоне химиотерапии, небактериальный тромботический эндокардит (НБТЭ), а также синдром гиперкоагуляции, который может быть проявлением ОЗ либо являться осложнением лечения злокачественного новообразования [7].
Знание патогенеза ИИ на фоне онкопатологии может значительно облегчить выбор профилактической терапии. В настоящее время оптимальное средство вторичной профилактики у пациентов с ИИ на фоне ОЗ не установлено. С этой целью продолжается исследование ENCHASE, изучающее эффективность и безопасность применения эдоксабана у пациентов с КИ на фоне ОЗ по сравнению с эноксапарином [12].
Ниже приводим клиническое наблюдение кардиоэмболического инсульта у пациента с небактериальным тромботическим эндокардитом на фоне аденокарциномы легкого.
Материалы и методы
В статье представлен клинический случай кардиоэмболического ишемического инсульта у пациента с небактериальным тромботическим эндокардитом, развившимся на фоне аденокарциномы левого легкого. Описаны методы ранней диагностики заболевания, лечение и исходы.
Клинический случай
Пациент 62 лет доставлен в НИИ СП им. Н.В. Склифосовского бригадой скорой медицинской помощи с клинической картиной острого нарушения мозгового кровообращения. На догоспитальном этапе у пациента отмечены левосторонняя гемиплегия, сглаженность носогубной складки слева, девиация языка влево, дизартрия. При поступлении в стационар выявлен частичный регресс неврологического дефицита, сохранялась дизартрия. Тяжесть инсульта по шкале National Institutes of Health Stroke Scale (NIHSS) составила 2 балла. Артериальное давление 136/72 мм рт. ст., частота сердечных сокращений (ЧСС) 77 ударов в минуту, по данным ЭКГ ритм синусовый. Из анамнеза известно, что за два года до настоящей госпитализации у пациента верифицирована периферическая низкодифференцированная аденокарцинома верхней доли левого легкого, проведено комбинированное лечение: левосторонняя верхняя лобэктомия с лимфаденэктомией, курсы лучевой терапии и адъювантной химиотерапии, приведшие к стойкой ремиссии онкологического заболевания. В тот же срок с целью проведения продленной химиотерапии была имплантирована постоянная система венозного доступа (порт-система), функционировавшая вплоть до поступления – пациенту регулярно выполняли ультразвуковое сканирование подключичных и верхней полой вен для исключения тромботических осложнений. Известно, что у пациента в анамнезе неод- нократно возникали тромбоэмболические события в виде рецидивирующего окклюзионного тромбоза глубоких вен нижних конечностей, что потребовало назначения антикоагулянтной терапии ривароксабаном в дозе 20 мг в сутки. Кроме того, год назад пациент переносил ишемический инсульт неустановленной этиологии с полным клиническим восстановлением.
С целью исключения внутричерепного кровоизлияния выполнена компьютерная томография (КТ) головного мозга (рис. 1), по результатам которой структурного поражения головного мозга не выявлено. Балл по шкале ASPECTS (Alberta Stroke Program Early CT Score) составил 10. КТ-ангиография интра- и экстракраниальных сосудов не проведена в связи с анамнестическими указаниями на аллергическую реакцию в виде анафилактического шока на йодсодержащие вещества. Системная тромболитическая терапия пациенту не выполнена ввиду приема орального антикоагулянта и частичного регресса неврологической симптоматики.
Учитывая онкологический анамнез, в условиях приемного отделения пациенту также была проведена КТ органов грудной полости, верифицирован левосторонний гидроторакс объемом 948 см3 (рис. 2).
В лабораторном скрининге выявлены следующие отклонения от референсных значений: тромбоцитопения до 64х109/л, снижение уровня общего белка в биохимическом анализе крови до 63 г/л за счет фракции альбумина (20,50 г/л), по- вышение креатинина до 153,77 г/л. В коагулоло-гическом анализе крови отмечена тенденция к гиперкоагуляции: активированное частичное тромбопластиновое время (АЧТВ) – 18,7 секунд, уровень D-димера – 13,9.
С целью дальнейшего обследования и лечения пациент госпитализирован в палату реанимации и интенсивной терапии неврологического отделения.
На вторые сутки госпитализации пациенту выполнена магнитно-резонансная томография (МРТ) головного мозга, выявлены ишемические изменения в правых височной и островковой долях, левой гемисфере мозжечка (рис. 3).
Для уточнения патогенетического варианта ИИ проведена диагностика в виде суточного мониторирования ЭКГ по Холтеру, дуплексного сканирования брахиоцефальных сосудов – источников церебральной эмболии не верифицировано. Учитывая онкологический анамнез и радиологический паттерн ИИ с формированием очагов острой церебральной ишемии в нескольких артериальных бассейнах, с целью исключения небактериального тромботического эндокардита пациенту выполнена трансторакальная эхокардиография (ЭХО-КГ), выявившая округлые гетерогенные образования всех створок аортального клапана размерами 3 x 5 мм, аортальную недостаточность 2 степени, перфорации правой и левой коронарных створок, а также дилатацию левого предсердия до 42 мм в диаметре.
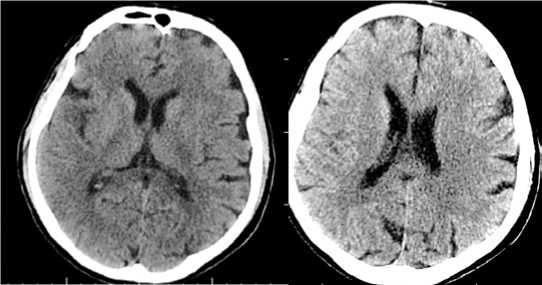
Рисунок 1. КТ головного мозга: ишемических изменений не выявлено
Figure 1. CT scan of the brain: no ischemic changes detected
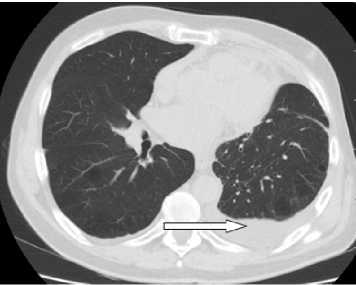
Рисунок 2. КТ органов грудной полости (стрелкой указан левосторонний гидроторакс)
Figure 2. CT scan of the thoracic cavity organs (arrow indicates left-sided hydrothorax)
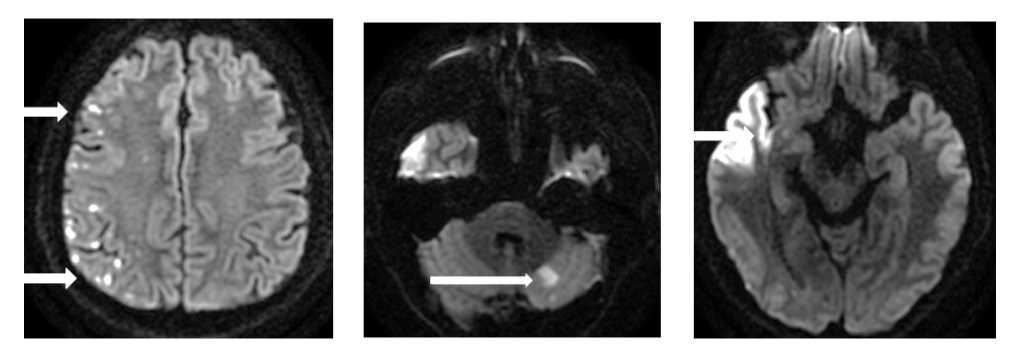
А Б В
Рисунок 3. МРТ головного мозга: А, Б, В – диффузионно-взвешенное изображение (DWI), стрелками указаны очаги повышения интенсивности сигнала, соответствующие острым ишемическим изменениям
Figure 3. Brain MRI: A, B, C – diffusion weighted image (DWI), arrows indicate foci of increased signal intensity corresponding to acute ischemic changes
Инфекционный генез эндокардита оказался маловероятен – отсутствовали «большие критерии» септического эндокардита. Однако для исключения бактериемии незамедлительно взят анализ крови с определением бактериального роста и чувствительности к антибактериальным препаратам – роста не выявлено. Пациент консультирован кардиохирургом, и в связи с высокой вероятностью повторного эмболического синдрома рекомендован перевод в кардиохирургическое отделение для дальнейшего хирургического лече-ния.Для исключения тромбоза ушка левого предсердия на фоне гиперкоагуляционного синдрома в рамках ОЗ пациенту выполнили КТ сердца, признаков внутрисердечного тромба или спонтанного эхо-контрастирования не получено (рис. 4).
На 7-е сутки госпитализации проведено протезирование аортального клапана механическим протезом в условиях искусственного кровообращения длительностью 102 минуты, время пережатия аорты составило 64 минуты. При макроскопическом исследовании створки аортального клапана истончены, покрыты тромботическими мягкоэластическими наложениями размерами до 3 мм, определяются перфорации правой и левой коронарных створок, отрыв комиссуры между некоронарной и левой коронарной створкой, зона кооптации поражена инфекционным процессом с наложениями фибрина (рис. 5). Интраоперационная кровопотеря достигла двух литров, что потребовало проведения трансфузии эритроцитарной взвеси и тромбоцитного концентрата – в связи с тромбоцитопенией. В раннем послеоперационном периоде в связи со склонностью к артериальной гипотензии начата инотропная поддержка растворами дофамина 4,5 мкг/кг/мин и адреналина 35 нг/кг/мин, продолжена искусственная вентиляция легких (ИВЛ).
При гистологическом изучении послеоперационного материала поверхность клапанов не изъязвлена, к ним прилежат тромботические массы из фибрина с признаками организации, с примесью малочисленных нейтрофилов, лимфоцитов и эритроцитов.
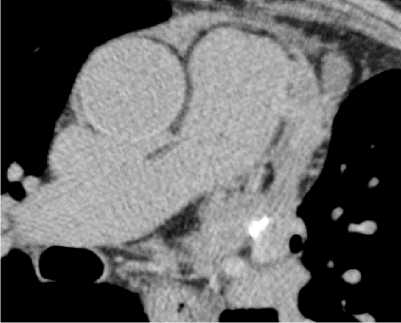
Рисунок 4. КТ сердца: данных за внутрисердечный тромбоз не получено
Figure 4. Cardiac CT scan: no evidence of intracardiac thrombosis
При микроскопическом исследовании заслонки клапана с невыраженным фиброзом, отеком, фибробластической реакцией, с новообразованными сосудами, со скудной лимфоплазмоцитарной инфильтрацией с примесью единичных нейтрофилов (рис. 6, 7). Данных за инфекционный эндокардит не получено, выявленные изменения соответствуют марантическому (асептическому) тромбозу на заслонках клапана.
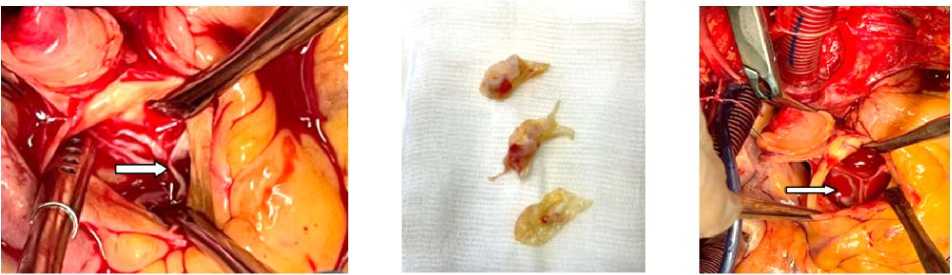
А Б В
Рисунок 5. Интраоперационные фотографии: А, Б – аортальный клапан до операции с наличием вегетаций на всех створках;
В – состояние после операции. Биологический протез Braile-23 Biomedica
Figure 5. Intraoperative photos: A, B – preoperative aortic valve with the presence of vegetations on all the leaflets; C – postoperative condition. Braile-23 Biomedica biological prosthesis
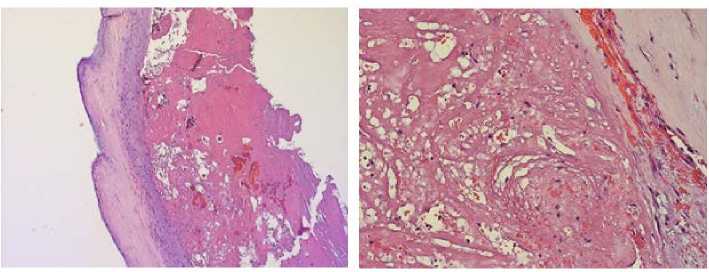
А
Б
Рисунок 6. Микроскопическое исследование аортального клапана, окраска гематоксилином и эозином: А – наложения фибрина на заслонке клапана со скудным клеточным компонентом, признаками неоангиогенеза, увеличение х 50; Б - наложения фибрина на заслонке клапана с примесью лимфоцитов и макрофагов, с новообразованными сосудами, увеличение х 200 Figure 6. Microscopic examination of aortic valve, hematoxylin and eosin staining: А - fibrin deposits on the valve leaflet with scanty cellular component, signs of neoangiogenesis, magnification x 50; в — fibrin deposits on the valve leaflet with admixture of lymphocytes and macrophages, with newly formed vessels, magnification x 200
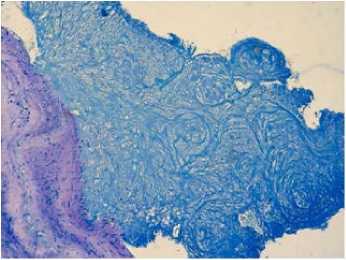
Рисунок 7. Микроскопическое исследование аортального клапана, окраска MSB (Martius, scarlet, blue), зрелый фибрин, увеличение x 200
Figure 7. Microscopic examination of the aortic valve, MSB staining (Martius, scarlet, blue), mature fibrin, magnification x 200
Обсуждение
В представленном клиническом случае ишемический инсульт развился на фоне прогрессирующего рака легкого и асептического эндокардита, явившегося источником церебральной эмболии. Диагностика марантического эндокардита основана на УЗИ сердца, предпочтительно чреспищеводной ЭХО-КГ, и последующей гистологической верификации заболевания. В данном наблюдении отсутствовали клинические проявления аортальной недостаточности, ставшей след- ствием небактериального тромботического эндокардита. Диагноз установлен на основании трансторакальной ЭХО-КГ и подтвержден результатами гистологического исследования. В изложенном клиническом случае пациенту с небактериальным тромботическим эндокардитом с целью профилактики повторного ишемического инсульта и/или системной эмболии выполнено протезирование аортального клапана, и пациент для дальнейшего наблюдения переведен в профильное отделение.
Данный клинический случай служит напоминанием о том, что при ведении пациентов с КИ необходимо рассматривать злокачественное новообразование как потенциальную причину церебральной эмболии. В настоящее время отсутствуют оптимальные стратегии профилактики и лечения ишемического инсульта у пациентов с онкологическими заболеваниями, что требует проведения исследований для выбора наиболее эффективной превентивной терапии.
Выводы
У пациентов с онкологическим анамнезом, повторными тромбоэмболическими синдромами, в том числе церебральной и/или системной эмболии, следует в первую очередь исключить небактериальный тромботический эндокардит. С этой целью необходимо выполнение чреспищеводной эхокардиографии как «золотого стандарта» визуализации сердца [13]. В настоящее время отсутствуют данные о наиболее эффективном методе вторичной профилактики ИИ и/или системной эмболии у пациентов с онкологическим заболеванием, что обуславливает острую необходимость дальнейших исследований.
Список литературы Клинический случай ишемического инсульта у пациента с небактериальным тромботическим эндокардитом
- Hart RG, Diener HC, Coutts SB, Easton JD, Granger CB, O'Donnell MJ, et al. Embolic strokes of undetermined source: the case for a new clinical construct. Lancet Neurol. 2014;13(4):429-438. PMID: 24646875 https://doi.org/10.1016/S1474-4422(13)70310-7
- Kim SJ, Park JH, Lee MJ, Park YG, Ahn MJ, Bang OY. Clues to occult cancer in patients with ischemic stroke. PLoS One. 2012;(9)7:e44959. PMID: 22984594 https://doi.org/10.1371/journal.pone.0044959
- Graus F, Rogers LR, Posner JM. Cerebrovascular complication in patients with cancer. Medicine (Baltimore). 1985;64(1):16-35. PMID: 3965856 https://doi.org/10.1097/00005792-198501000-00002
- Navi BB, DeAngelis LM, Segal AZ. Multifocal strokes as the presentation of occult lung cancer. J Neurooncol. 2007;85(3):307-309. PMID: 17611718 https://doi.org/10.1007/s11060-007-9419-y
- Navi BB, Kawaguchi K, Hriljac I, Lavi E, DeAngelis LM, Jamieson DG. Multifocal stroke from tumor emboli. Arch Neurol. 2009;66(9):1174-1175. PMID: 19752313 https://doi.org/10.1001/archneurol.2009.172
- Grisold W, Oberndorfer S, Struhal W. Stroke and cancer: a review. Acta Neurol Scand. 2009; 119(1):1-16. PMID: 18616624 https://doi.org/10.1111/j.1600-0404.2008.01059.x
- Bang OY, Chung JW, Lee MJ, Seo WK, Kim GM, Ahn MJ, et al. Cancer-Related Stroke: An Emerging Subtype of Ischemic Stroke with Unique Pathomechanisms. J Stroke. 2020;22(1):1-10. PMID: 32027788 https://doi.org/10.5853/jos.2019.02278
- Navi BB, Iadecola C. Ischemic stroke in cancer patients: a review of an underappreciated pathology. Ann Neurol. 2018;83(5):873-883. PMID: 29633334 https://doi.org/10.1002/ana.25227
- Navi BB, Reiner AS, Kamel H, et al. Arterial thromboembolism risk before a diagnosis of lung, pancreas, or gastric cancer. Thromb Res. 2018;164(Suppl 1):S179-180. https://doi.org/10.1016/j.thromres.2018.02.014
- Harloff A, Schlachetzki F. Rivaroxaban for Stroke Prevention after Embolic Stroke of Undetermined Source. N Engl J Med. 2018;379(10):986-987. PMID: 30188630 https://doi.org/10.1056/NEJMoa1802686 4
- Diener HC, Sacco RL, Easton JD, Granger CB, Bernstein RA, Uchiyama S, et.al. Dabigatran for Prevention of Stroke after Embolic Stroke of Undetermined Source. N Engl J Med. 2019;380(200):1906-1917. PMID: 31091372 https://doi.org/10.1056/NEJMoa1813959
- Edoxaban for the treatment of coagulopathy in patients with active cancer and acute ischemic stroke: a pilot study. (ENCHASE Study) (ENCHASE). 2018. Available at: https://clinicaltrials.gov/ct2/show/NCT03570281 [Accessed July 15, 2022].
- Рамазанов Г.Р., Ковалева Э.А., Шамалов Н.А. Онкологические заболевания как фактор риска криптогенного инсульта. Журнал им. Н.В. Склифосовского «Неотложная медицинская помощь». 2021;10(4):778-786. [Ramazanov G.R., Kovaleva E.A., Shamalov N.A. Oncologic Diseases as a Risk Factor for Cryptogenic Stroke. Russian Sklifosovsky Journal "Emergency Medical Care". 2021;10(4):778-786. (In Russ)]. https://doi.org/10.23934/2223-9022-2021-10-4-778-786


