Клинический случай экстрагастроинтестинальной стромальной опухоли в сочетании с синдромом тестикулярной феминизации (синдром Морриса)
Автор: Сидакова З.А., Баранова А.А., Грицай А.Н., Ефремов Г.Д., Любченко Л.Н.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 4 т.22, 2023 года.
Бесплатный доступ
Актуальность. В клинической практике встречаются ошибки при диагностике гастроинтестинальных опухолей (GIST), которые, по литературным данным, составляют около 6 %. Описание клинического случая. Представлено редкое клиническое наблюдение манифестации экстрагастроинтестинальной стромальной опухоли на фоне синдрома тестикулярной феминизации (СТФ) - синдрома Морриса. Эта наследственная патология ассоциирована с полной нечувствительностью органов-мишеней к андрогенам и описана американским гинекологом Д. Моррисом в 1953 г. Самостоятельное обращение пациентки в специализированное медицинское учреждение, междисциплинарный подход, онконастороженность, активная хирургическая тактика, выполнение дополнительных иммуногистохимического (ИГХ) и молекулярно-генетических исследований (МГИ) позволили верифицировать диагноз, который ранее был расценен как лейомиома матки. В медицинской литературе описаны единичные случаи экстрагастроинтестинальной опухоли (ЕGIST) мочевого пузыря, предстательной железы, забрюшин- ного пространства, брыжейки кишки, сальника, заднего средостения, однако ни одного случая ЕGIST, происходящей из стенки влагалища. СТФ в сочетании с ЕGIST является уникальным случаем в нашей клинической практике. Заключение. Изучение редких случаев расширяет представление о природе злокачественных новообразований. Пациенты с редкими видами злокачественных опухолей должны в обязательном порядке проходить обследование и лечение в специализированных онкологических учреждениях с привлечением сертифицированных специалистов: онкологов, хирургов, химиотера- певтов, генетиков.
Гастроинтестинальная стромальная опухоль, экстрагастроинтестинальная опухоль, синдром тестикулярной феминизации, иммуногистохимическое исследование
Короткий адрес: https://sciup.org/140301242
IDR: 140301242 | УДК: 616.33-006.6:618.1:616-056.7 | DOI: 10.21294/1814-4861-2023-22-4-142-148
Текст научной статьи Клинический случай экстрагастроинтестинальной стромальной опухоли в сочетании с синдромом тестикулярной феминизации (синдром Морриса)
Синдром тестикулярной феминизации (СТФ) – синдром Морриса – наследственно обусловленное заболевание, связанное с нарушением половой дифференцировки. Частота встречаемости в общей популяции 1:20 000–1:60 000 новорожденных [1].
Патогенез связан с дефектом гена рецептора к андрогенам (AR), ассоциированного с чувствительностью к тестостерону и дигидротестостерону, ответственных за формирование мужского фенотипа. Секреция эстрогенов надпочечниками и частично гонадами формирует женский фенотип при отсутствии производных мюллеровых протоков (маточных труб, матки, верхней трети влагалища). Диагностика СТФ основывается на определении клинико-генетических параметров: изучение семейного анамнеза пациента, гинекологического и урологического осмотров, УЗИ и рентгенологического обследования органов малого таза, молекулярно-генетической диагностики и кариотипирования. При осмотре обнаруживается слепо заканчивающееся влагалище, отсутствуют шейка матки, матка и ее придатки, подтверждается мужской кариотип – 46 XY. Молекулярногенетическая диагностика с целью определения мутаций гена андрогенного рецептора при наличии характерной клинической картины подтверждает диагноз синдрома Морриса.
Мутации в AR гене могут приводить к нескольким аномалиям, таким как дефицит/изменение синтеза андрогеновых рецепторов или неспособность связывать специфические лиганды [2]. В настоящее время, согласно базе данных , в гене AR описывается около 900 различных мутаций, связанных с синдромом нечувствительности к андрогенам мутации, которые приводят к стоп-кодонам или аминокислотным заменам, делеции, и вставки, связанные со сдвигом в рамке считывания трансляции, частичные или полные делеции генов, затрагивающие большую часть последовательностей генов и мутации, которые вовлекают интроны, изменяя сплайсинг РНК [3].
Среди генов, вовлеченных в процесс сперматогенеза и нарушения фертильности, включая синдромальную патологию, особого внимания заслуживают гены, локализованные в локусах AZF (azoospermia factor) длинного плеча Y-хромосомы (Yq) [4]. Микроделеции в локусах AZFа, AZFb и AZFc гена AZF выявляют у 12–15 % мужчин при азооспермии и олигозооспермии [4–6].
Проведены исследования по изучению роли индивидуальной генетической предрасположенности, связанной с риском развития злокачественных новообразований у пациентов с синдромом Морриса [6, 7]. Согласно современным данным, гонады у больных с СТФ обладают высоким риском малигнизации – гонадобластома или дисгер-минома тестикул встречается в 20–50 % случаев наблюдений [2, 5–7].
Наш клинический случай продемонстрировал возможность сочетания синдрома нарушения половой дифференцировки и развития злокачественной экстрагастроинтестинальной стромальной опухоли.
Хирургический метод является основным эффективным методом лечения при условии отсутствия признаков диссеминации GIST. При локализованных, верифицированных GIST стандартом хирургического вмешательства является радикальное удаление опухоли единым блоком. Для улучшения результатов хирургического лечения GIST с высоким риском прогрессирования рекомендовано молекулярно-генетическое исследование с целью определения активирующих мутаций в генах c -KIT и PDGFRA с последующим назначением таргетной терапии ингибиторами тирозинкиназы (iTK).
Наш опыт представлен уникальным клиническим случаем успешной диагностики и лечения c -KIT ассоциированной экстрагастроинтестинальной опухоли, происходящей из стенки влагалища, в сочетании с синдромом Морриса без признаков рецидива и прогрессирования неопластического процесса на фоне таргетной терапии Иматинибом.
Клиническое наблюдение
Пациентка А., 58 лет, поступила в отделение реконструктивно-пластической гинекологии и онкологии НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина, в декабре 2021 г., с жалобами на наличие плотного опухолевидного образования в области промежности и тянущие боли в этой зоне (рис. 1). Из анамнеза известно, что у пациентки диагностирован СТФ, установленный в подростковом возрасте, когда при обследовании по поводу отсутствия менархе выявлена аномалия развития внутренних половых органов. В 2017 г. по месту жительства выполнено удаление опухоли верхней трети влагалища (гистологическое заключение: лейомиома). В дальнейшем по месту жительства, трижды, в 2018, 2019, 2020 гг., выполнено удаление опухолей влагалища. Пересмотреть гистологические препараты не представилось возможным. На момент госпитализации выявлено 2 образования, до 5 см, с вовлечением преддверия влагалища, а также опухолевый узел, размерами 3×4 см, в прямокишечнопузырном углублении.
Объективно: фенотип женский; наружные половые органы сформированы правильно; телосложение нормостеническое. При гинекологическом осмотре: укороченное влагалище, заканчивающееся слепо; матка и придатки не пальпируются.
При УЗИ органов малого таза матка и яичники не определяются. Заключение: агенезия матки с придатками. КТ малого таза: в мезоректальной клетчатке кпереди от прямой кишки и позади мочевого пузыря определяется округлой формы образование, размером 3×5 см, отодвигает заднюю стенку мочевого пузыря кпереди. Параректально по правой боковой стенке аналогичное образо-
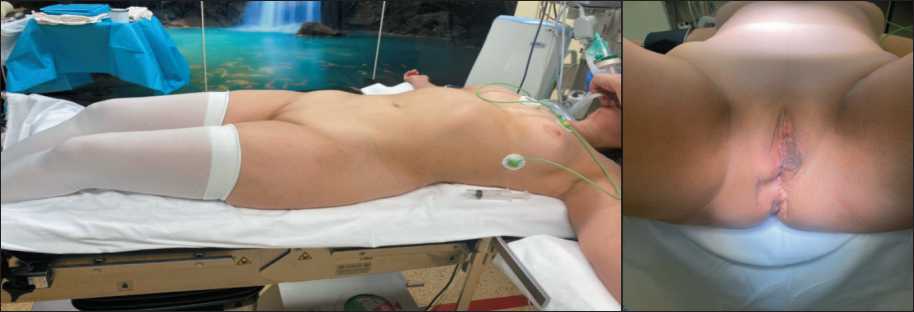
Рис. 1. Внешний вид пациентка А. Опухоль в области преддверия влагалища
Fig. 1. Patient A. Tumor in the vestibule
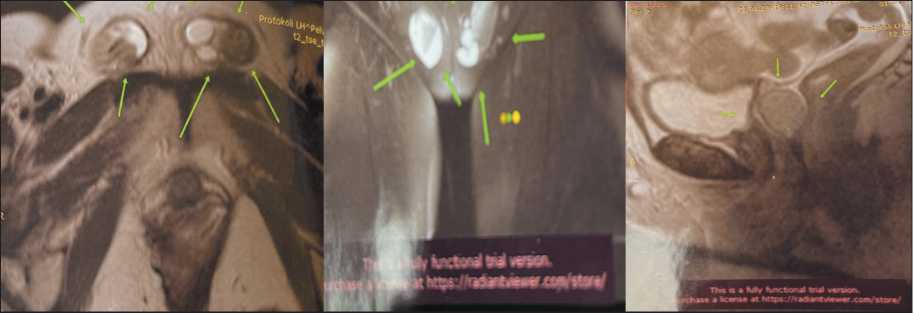
Рис. 2. Компьютерная томография органов малого таза до операции Fig. 2. Computed tomography of the pelvic organs before surgery
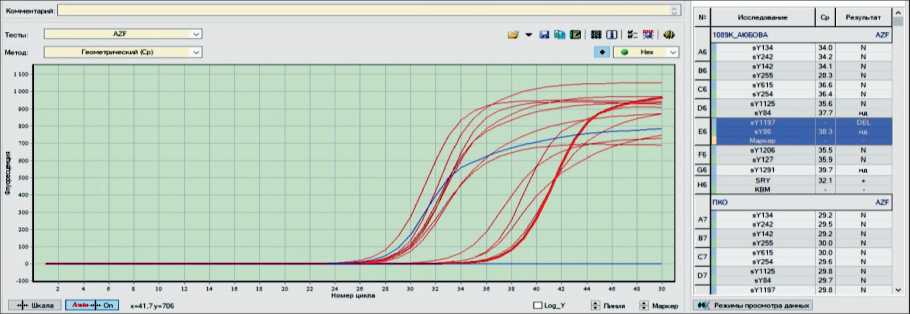
Рис. 3. del Y1197 в гене AZF (ПЦР в реальном времени) Fig. 3. del Y1197 in AZF gene (real-time PCR)
вание, размером 4,6×2,4 см. В паховом канале справа и слева два округлых образования, размерами 1,2×1,0 см и 1,2×0,8 см – рудиментарные тестикулы (рис. 2). ЭГДС (15.11.21): поверхностный антрум-гастрит; эзофагит. Колоноскопия (17.11.21): без опухолевой патологии. КТ грудной клетки (13.11.21): без патологических изменений. Осмотр эндокринолога (13.12.21): СТФ. Анализ крови на гормоны: тестостерон – 12,9 нмоль/л (норма – 4,6 нмоль/л), ЛГ, ФСГ, пролактин, эстрадиол, прогестерон в пределах нормы. Консультация врача-генетика (13.12.21): по данным клинического, лабораторных и инструментальных методов исследования у пациентки диагностировано нарушение половой дифференцировки – синдром Морриса. Семейный анамнез отягощен раком молочной железы, случаев врожденной патологии не отмечено.
Для подтверждения генетического диагноза синдрома тестикулярной феминазиции рекомендовано выполнение ДНК-диагностики – определение делеции AZF локуса методом ПЦР в реальном времени, специфичного для маркеров Y-хромосомы (рис. 3). При исследовании ДНК, выделенной из лимфоцитов периферической крови, в гене AZF выявлена делеция Y1197. Генетический диагноз: синдром Морриса, ассоциированный с del Y1197 в гене AZF. Риск развития злокачественных новообразований, в том числе гонадобластомы, значительно превышает общепопуляционный.
Проведен онкологический консилиум в НИИ урологии и интервенционной радиологии им. Н. А. Лопаткина: с учетом наличия у пациентки подтвержденного генетического диагноза СТФ, неверифицированной злокачественной опухоли рекомендовано хирургическое лечение в объеме: лапаротомии, двустороннего удаления гонад и новообразований прямокишечнопузырного углубления, параректальной зоны, влагалища. Оперативное вмешательство выполнено в указанном объеме.
Гистологическое заключение: в левом и правом яичниках инволютивно-склеротические изменения. Мезенхимальные веретеноклеточные опухоли влагалища, параректальной зоны и прямокишечнопузырного углубления с неопределенным потенциалом злокачественности (рис. 4). С целью уточнения гистогенеза опухолей рекомендуется проведение иммуногистохимического исследования (ИГХ).
По результатам ИГХ в клетках опухоли определяется экспрессия CD117, CD34 (рис. 5). Индекс пролиферации опухолевых клеток по экспрессии Ki67 составил 12–15 % (рис. 6). Заключение: GIST.
Учитывая ИГХ-заключение, рекомендовано выполнение молекулярно-генетического исследования с целью определения соматических мутаций в генах с-KIT, PDGFRA, ассоциированных с патогенезом GIST и чувствительностью к ингибиторам тирозинкиназы (iTK).
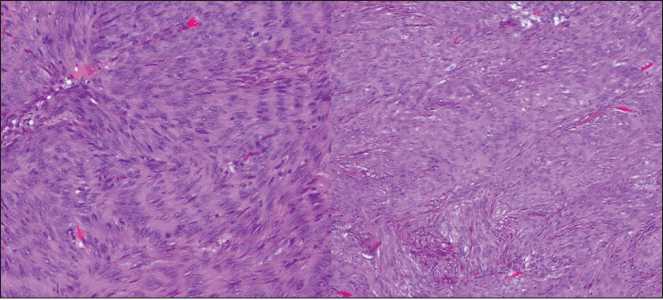
Рис. 4. Микроскопическая картина удаленных опухолей влагалища и параректальной зоны. Окраска гематоксилином и эозином, ×20 Fig. 4. Microscopic image of the resected tumors of the vagina and pararectal zone. Hematoxylin and eosin staining, ×20

Рис. 5. Микрофото. ИГХ-исследование:
1 – экспрессия CD117, ×20; 2 – экспрессия CD34, ×20
Fig. 5. Microphoto. Immunohistochemistry:
1 – expression of CD117, ×20; 2 – expression of CD34, ×20
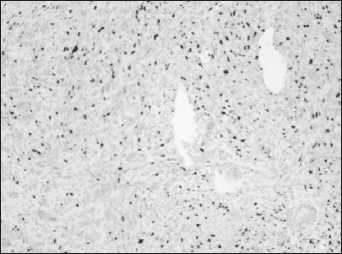
Рис. 6. Микрофото. ИГХ-исследование. Экспрессия Ki67, ×10
Fig. 6. Microphoto. Immunohistochemistry. Ki67 expression, ×10
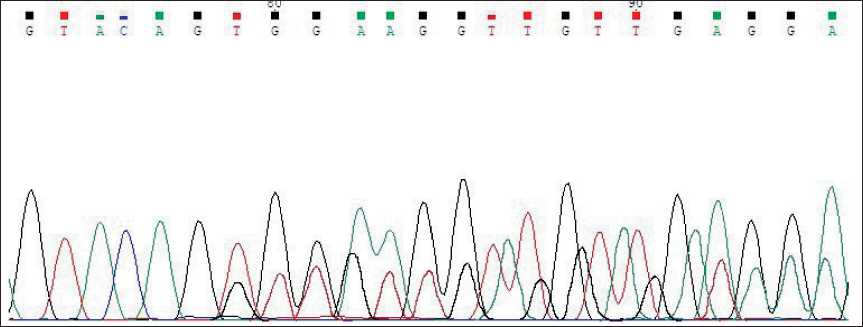
Рис. 7. Мутация c.1669_1674delTGGAAG, COSM1217 (Секвенирование по Сэнгеру) Fig. 7. c.1669_1674delTGGAAG, COSM1217 mutation (Sanger sequencing)
При исследовании ДНК, выделенной из образца опухолевой ткани, под контролем патоморфолога в 11 экзоне гена с-KIT обнаружена активирующая соматическая мутация – делеция 557-558 кодонов, p.W557_ K558del (c.1669_1674delTGGAAG, COSM1217) (рис. 7). Мутация c.1669_1674delTGGAAG в гене c-KIT зарегистрирована в международной базе данных COSMIC как патогенный клинически значимый вариант, ассоциированный с чувствительностью к ингибиторам тирозинкиназы.
На основании иммуногистохимического и молекулярно-генетического исследований опухоль верифицирована как злокачественная, еретено-клеточная гастроинтестинальная стромальная опухоль, экстра-гастроинтестинальный вариант, ассоциированная с мутацией в гене с-KIT. Учитывая размеры опухолей (до 5 см), индекс пролиферации опухолевых клеток Ki67(12–15 %), рецидивирующее течение, больная включена в группу высокого риска прогрессирования.
На основании результатов молекулярногенетического исследования – наличия активирующей мутации в гене с-KIT – назначена терапия Иматинибом в дозе 400 мг в сут в течение 3 лет. По данным контрольного обследования в течение 2 лет признаков рецидива заболевания не выявлено.
Обсуждение
В медицинской литературе описаны редкие случаи ЕGIST мочевого пузыря, предстательной железы, забрюшинного пространства, брыжейки кишки, сальника, заднего средостения. СТФ в сочетании с ЕGIST является крайне редким клиническим случаем, представляющим особый интерес, а также демонстрирует достаточно нетипичную локализацию GIST с ростом опухолей в преддверии влагалища и в малом тазу, не имеющих связи с ЖКТ. Представленное клиническое наблюдение иллюстрирует сложность в постановке клинического диагноза при выявлении внеорган-ных опухолей на амбулаторном этапе, несмотря на весь существующий спектр диагностических возможностей. Мультидисциплинарный подход с участием смежных специалистов (врача-генетика, патоморфолога, онкогинеколога, химиотерапевта) позволил уточнить диагноз, а проведение онкологического консилиума обеспечило индивидуальный подход и адекватную тактику лечения с последующим проведением таргетной терапии.
Риск развития злокачественных новообразований различной локализации повышен у пациентов с наследственной синдромальной патологией. Крайне редкая встречаемость в практике экстра-гастроинтестинальной опухоли в сочетании с син- дромом Морриса создает как интраоперационные тактические трудности в постановке диагноза, так и возможные сложности в разработке рекомендаций по дообследованию на амбулаторном этапе.
СТФ тесно связан с мутацией гена, кодирующего AR, сцепленной с Х-хромосомой. Мутация приводит к дефекту функции андрогенового рецептора, что ухудшает или исключает способность органов-мишеней реагировать на андрогены [2]. Под действием антимюллерова гормона, секретируемого семенниками, женские внутренние половые органы, такие как фаллопиевы трубы, матка, шейка матки и проксимальный отдел влагалища, не формируются [8]. Клиническое наблюдение иллюстрирует полную форму синдрома Морриса, связанную с нарушением половой дифференцировки и риском развития злокачественных новообразований. С учетом современных рекомендаций вопрос о гонадэктомии необходимо выносить на обсуждение после полового созревания пациентки.
Хирургическая тактика в отношении тестикул у пациентки была реализована симультанно при
Список литературы Клинический случай экстрагастроинтестинальной стромальной опухоли в сочетании с синдромом тестикулярной феминизации (синдром Морриса)
- Delev P., Pacheva S. Akus. i Ginekol. (Sofia). 1998; 37: 55-7.
- Oakes M.B., Eyvazzadeh A.D., Quint E., Smith Y.R.Complete androgen insensitivity syndrome-a review. J Pediatr Adolesc Gynecol. 2008; 21(6): 305-10.
- Hughes I.A., Deeb A. Androgen resistance. Best Pract Res Clin Endocrinol Metab. 2006; 20(4): 577-98. 10.1016/j. beem.2006.11.003.
- Petroli R.J., Hiort O., Struve D., Gesing J.K., Soardi F.C., Spínola-Castro A.M., Melo K., Prado Arnhold I.J., Maciel-Guerra A.T., Guerra-Junior G., Werner R., de Mello M.P. Functional Impact of Novel Androgen Receptor Mutations on the Clinical Manifestation of Androgen Insensitivity Syndrome. Sex Dev. 2017; 11(5-6): 238-47.
- Gulía C., Baldassarra S., Zangari A., Briganti V., Gigli S., Gaffi M., Signore F., Vallone C., Nucciotti R., Costantini F.M., Pizzuti A., Bernardo S., Porrello A., Piergentili R. Androgen insensitivity syndrome. Eur Rev Med Pharmacol Sci. 2018; 22(12): 3873-87.
- Sarlomo-Rikala M., Kovatich A.J., Barusevicius A., Miettinen M. CD117: a sensitive marker for gastrointestinal stromal tumors that is more specific than CD34. Mod Pathol. 1998; 11(8): 728-34.
- Chung C.C., Kanetsky P.A., Wang Z., Hildebrandt M.A., Koster R., Skotheim R.I., Kratz C.P., Turnbull C., Cortessis V.K., Bakken A.C., Bishop D.T., Cook M.B., Erickson R.L., Fosså S.D., Jacobs K.B., Korde L.A., Kraggerud S.M., Lothe R.A., Loud J.T., Rahman N., Skinner E.C., Thomas D.C., Wu X., Yeager M., Schumacher F.R., Greene M.H., Schwartz S.M., McGlynn K.A., Chanock S.J., Nathanson K.L. Meta-analysis identifies four new loci associated with testicular germ cell tumor. Nat Genet. 2013; 45(6): 680-5.
- Brown T.R. Human androgen insensitivity syndrome. J Androl. 1995; 16(4): 299-303.


