Клинический случай этапного лечения множественного холедохолитиаза и местнораспространенного рака почки
Автор: Новрузбеков М.С., Нагаев Р.М., Янгиров И.В., Старков Г.А., Гасанбеков Г.А., Францев Д.Ю., Ласкевич А.В., Аранович Э.В., Абдуллаева А.У.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клинический случай
Статья в выпуске: 5 (53), 2021 года.
Бесплатный доступ
Данная статья представляет собой анализ клинического случая, посвящённого клиническим проявлениям и лечению множественного холедохолитиаза и местнораспространенного рака почки. Было выполнено этапное оперативное вмешательство. Первым этапом была выполнена ретроградная папиллосфинктеротомия с холедохолитоэкстракцией. Вторым этапом - лапаротомия, удаление опухоли правой почки/надпочечника единым блоком, холецистэктомия после предварительной ангиографии и эмболизации питающих опухоль сосудов. Представленное успешное наблюдение демонстрирует один из современных подходов в лечении пациентов с коморбидной патологией.
Холедохолитиаз, рак почки, этапное лечение, папиллосфинктеротомия, эмболизация
Короткий адрес: https://sciup.org/143177350
IDR: 143177350 | УДК: 616.361.003.7+616.61-006 | DOI: 10.20340/vmi-rvz.2021.5.CASE.1
Текст научной статьи Клинический случай этапного лечения множественного холедохолитиаза и местнораспространенного рака почки
Выполнение циторедуктивной (паллиативной) нефрэктомии до начала таргетной терапии показано пациентам группы хорошего прогноза (IMDC или MSKCC), способным перенести хирургическое вмешательство, с потенциально резектабельной первичной опухолью. В группах промежуточного и неблагоприятного прогноза циторедуктивная нефрэктомия, выполненная до начала таргетной терапии, не улучшает показатели общей выживаемости и может выполняться только пациентам с наличием не более трех факторов риска по шкале IMDC. Выполнение циторедуктивной нефрэктомии возможно при угрожающих жизни состояниях, связанных с наличием первичной опухоли (гематурия, токсико-анемический синдром и др.). Радикальное удаление солитарных и единичных метастазов может рассматриваться в качестве возможного лечебного подхода у отдельных больных почечно-клеточного рака (ПКР) с индолентным течением болезни. Адьювантная терапия после радикального хирургического удале- ния метастазов не улучшает результаты лечения, и ее проведение не показано. Лучевая терапия (ЛТ) может быть использована с паллиативной целью при наличии болевого синдрома у пациентов с метастатическим поражением костей.
Целью обследования при ПКР является оценка локализации и процесса. Стандартом диагностики и стадирования ПКР является спиральная компьютерная томография (КТ) забрюшинного пространства, брюшной и грудной полостей с в / в болюсным контрастированием. Пациентам с соответствующими симптомами выполняется радиоизотопное исследование костей скелета с последующим рентгенологическим контролем или контролем магниторезонансной томографии (МРТ) зон повышенного накопления радиофармпрепарата (РФП).
Пациентам с общемозговыми и/или очаговыми неврологическими симптомами показано МРТ головного мозга. Диагностическая эффективность позитронноэмиссионной (ПЭТ) и компьютерной (КТ) томографий ПЭТ/КТ при ПКР неизвестна, метод не рекомендован к применению в рутинной практике ввиду его невысокой чувствительности при данном заболевании.
Основным методом лечения при клинически локализованном и местнораспространенном ПКР (сТ1–4N0/+ М0) является хирургический метод. Стандартным подходом при клинически локализованном ПКР (сТ1–2) является резекция почки. Нефрэктомия выполняется пациентам с опухолями сТ1–2, локализация и размеры которых делают выполнение органосохраняющего лечения технически невозможным, а также пациентам с ПКР сТ3–4. Лимфодиссекция при клинически негативных лимфоузлах (сN0) не является обязательной. При наличии увеличенных забрюшинных лимфоузлов (cN1) выполняется расширенная лимфодиссекция. Аблативные методы в стандарты лечения ПКР не входят и могут рассматриваться как альтернатива хирургическому лечению наряду с динамическим наблюдением при малых периферически расположенных опухолях почки и крайне высоком операционном риске. Химиотерапию считают неэффективной у пациентов с ПКР.
Иммунотерапия. Имеющиеся данные показывают, что иммунотерапия интерфе-роном-альфа (ИФН-а) успешна только у ограниченного числа пациентов: пациентов с хорошим общим состоянием, без прогрессирования заболевания с момента изначальной диагностики более одного года и преимущественно метастазированием в легкие в качестве единственного очага [2].
На результаты оперативного лечения ПКР неблагоприятное воздействие оказывает наличие коморбидной патологии, в том числе желчекаменной болезни (ЖКБ), увеличивает операционные риски, влияет на исход заболевания. Появляется все больше данных, характеризующих ЖКБ не только как самостоятельное заболевание, но и имеющую тесную этиологическую и патогенетическую связь с другими болезнями. Она может способствовать их развитию и прогрессированию. Возможна и об- ратная связь: определенные заболевания и состояния могут служить дополнительным фактором риска камнеобразования.
В основе коморбидности рака почки и холелитиаза прежде всего находятся общие метаболические нарушения. Установлено, что при наличии ЖКБ риск смерти от всех причин и от онкологической патологии повышается на 30 % [1, 3–5].
Целью данной публикации является демонстрация клинического случая этапного лечения множественного холедохолитиаза и местнораспространенного рака почки.
Описание клинического наблюдения
Пациентка К., 62 года, поступила 15.08.2021 с жалобами на изменение цвета мочи, наличие сгустков крови в моче, затруднения при мочеиспускании, слабость, потерю аппетита, снижение массы тела, периодически возникающие боли в эпигастрии и правом подреберье.
Ухудшение состояния с 13.08.2021 г., когда впервые в жизни, без видимой причины, развилась макрогематурия. Обследовалась амбулаторно по месту жительства: по данным УЗИ и КТ выявлена опухоль правой почки, подозрение на опухоль мочевого пузыря. Госпитализирована в Юсуповскую больницу с целью дообследования и решения вопроса о дальнейшей тактике.
При дообследовании по данным УЗИ от 16.08.2021: в проекции 2-го сегмента определяется анэхогенная, аваскулярная структура с неровными четкими контурами 13 x 6 мм. Холедох расширен, 10 мм. В просвете сладж, в проекции терминального отдела определяется гиперэхогенные структуры с акустической тенью (конкременты) 8 и 10 мм. Верхний полюс и среднюю треть паренхимы правой почки занимает объемное образование с неровными контурами, стертой дифференцировкой размерами 107 x 84 мм, ангиоархитектоника нарушена.
Заключение: УЗ признаки объемного образования правой почки. Конкременты терминального отдела холедоха с явлениями холедохоэктазии. Киста 2-го сегмента печени. Сокращенный желчный пузырь.
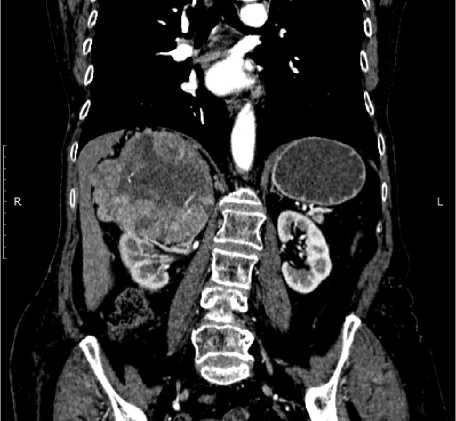
По данным КТ от 16.08.2021: забрю-шинно справа, в области правого надпочечника с распространением на верхних полюс правой почки и висцеральную поверхность правой доли печени, без четкой дифференцировки с ними (с инвазией), определяется многоузловое объемное образование с участками некроза и кровоизлияний в структуре размерами до 11,3 x 10,8 см - более вероятно соответствует образованию правого надпочечника/верхнего полюса правой почки, менее вероятно – забрюшинной неорганной опухоли. Правая почечная вена, нижняя полая вена без признаков тромбоза.
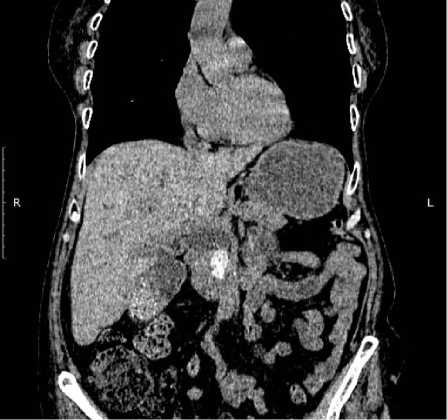
Желчные протоки расширены: гепати-кохоледох до 18 мм; долевые протоки до 7–10 мм. Желчный пузырь не увеличен, в просвете определяется осадок и множественные конкременты до 3–4 мм. В интра-пакреатической части холедоха определяются два крупных конкремента до 7–10 мм.
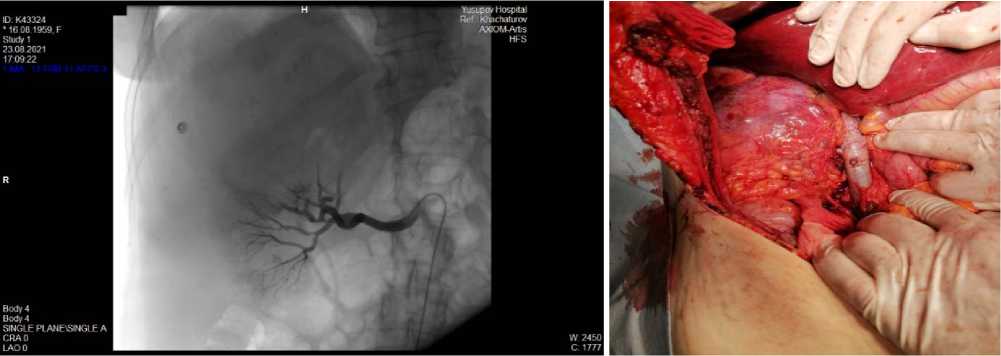
Заключение: объемное образование забрюшинно справа указанной распространенности – более вероятно соответствует образованию правого надпочечни-ка/верхнего полюса правой почки, менее вероятно – забрюшинной неорганной опухоли. Внутри- и внепеченочная холангиоэк-тазия. Холедохолецистохолитиаз (рис. 1).
При дообследовании по данным УЗИ и КТ выявлена опухоль надпочечника с распространением опухолевого процесса на верхний полюс правой почки и правую долю печени, так же выявлены конкременты в общем желчном протоке и желчном пузыре. Пациентка консультирована хирургом, рекомендован перевод в отделение хирургии для двухэтапного оперативного лечения. Первым этапом – выполнение РХПГ, ЭПСТ, литоэкстракции; вторым этапом, после проведения предоперационной подготовки, – выполнение оперативного вмеша- тельства, направленного на апластичное удаление опухоли правого надпочечника после предварительной ангиографии и эмболизации питающих опухоль сосудов.
Перенесенные заболевания: желчнокаменная болезнь, хронический гастрит, хронический панкреатит, узловой зоб, мастопатия.
Перенесенные операции: герниопласти-ка пупочной и вентральных грыж в 2015 г.
При поступлении состояние удовлетворительное, пониженного питания, кожные покровы бледные. Из особенностей – мочеиспускание по уретральному катетеру. Моча с примесью и сгустками крови.
Основное заболевание:
Осложнение основного заболевания: Рецидивирующая задержка мочеиспускания. Нормоцитарная анемия легкой степени. Астенический синдром. Дефицит массы тела.
Сопутствующее заболевание: ИБС: постинфарктный кардиосклероз (по данным ЭхоКГ). Узловой зоб, эутиреоз. Хронический гастродуоденит. Хронический колит. Хронический панкреатит.
В лечении данного пациента принимали участие не только специалисты Юсуповской больницы (ООО «Нейро-клиника»), но и специалисты из ГБУЗ «НИИ скорой помощи им. Н.В. Склифосовского ДЗМ» и НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
В плановом порядке 19.08.2021 выполнена РХПГ, ЭПСТ на протяжении 10 мм, баллонная литоэкстракция двух конкрементов 8 мм и 9 мм в диаметре (рис. 2, 3). Ранний послеоперационный период протекал без хирургических осложнений.
Пациентке показано выполнение циторедуктивной операции с учетом возможности выполнения радикального оперативного вмешательства и высокого риска рецидива кровотечения в надпочечник.
А
Б
Рисунок 1. А. Объемное образование забрюшинно справа указанной распространенности – более вероятно соответствует образованию правого надпочечника/верхнего полюса правой почки, менее вероятно – забрюшинной неорганной опухоли. Б. Конкременты холедоха и желчного пузыря
Figure 1. А. Massive formation of the retroperitoneal right of the indicated accrescence – more likely corresponds to the formation of the right adrenal gland/upper pole of the right kidney, less likely – a retroperitoneal inorganic tumor. В. Concrements of common bile duct and gallbladder
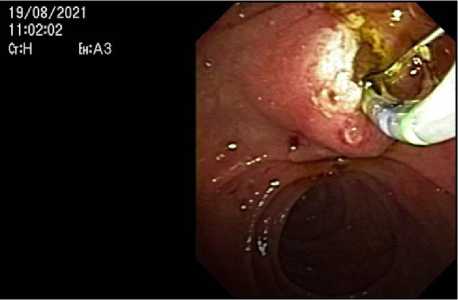
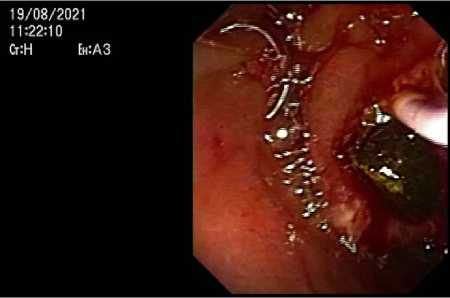
Рисунок 2. Этапы проведения папиллосфинктеротомии и удаление камней баллоным экстрактором
Figure 2. Stages of papillosphincterotomy and removal of stones with a balloon extractor
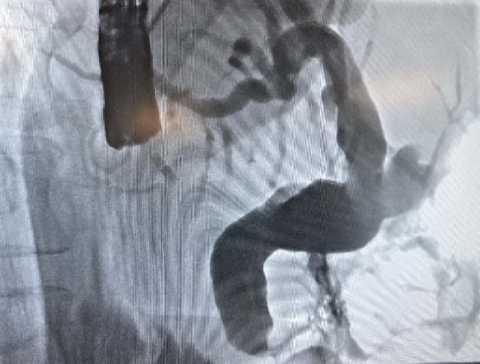
Рисунок 3. Этап проведения ретроградной холангиопанкреоатографии: при тугом контрольном контрастировании гепатикохоледоха дефектов наполнения не выявлено
Figure 3. The stage of retrograde cholangiopancreatography: no filling defects were revealed with tight control contrasting of ductus hepaticocholedochus
А Б
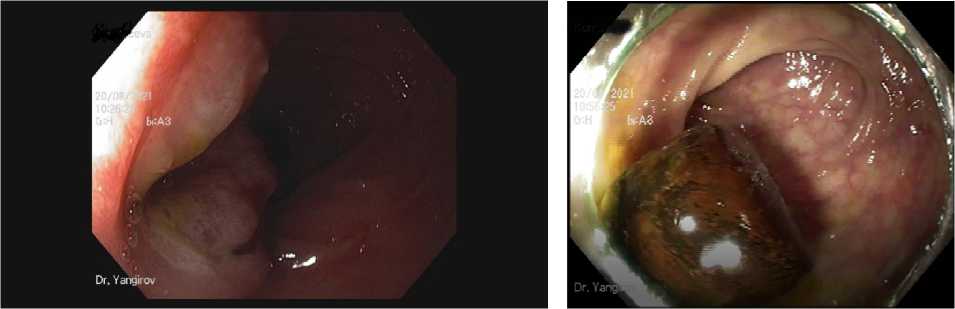
Рисунок 4. А. Большой дуоденальный сосочек. Первые сутки после ПСТ. Б. Выявлены конкременты в сигмовидной кишке при колоноскопии на следующий день после проведения РХПГ, ПСТ и холедохоли-тоэкстрации
Figure 4. А. Large duodenal papilla. The first day after PST. В. The calculi were revealed in the sigmoid colon during colonoscopy the next day after RCPG, PST and choledocholithoectration
При интраоперационном выявлении признаков диссеминации процесса по брюшной полости оперативное лечение ограничить диагностической лапаротомией, забором материала для гистологического исследования.
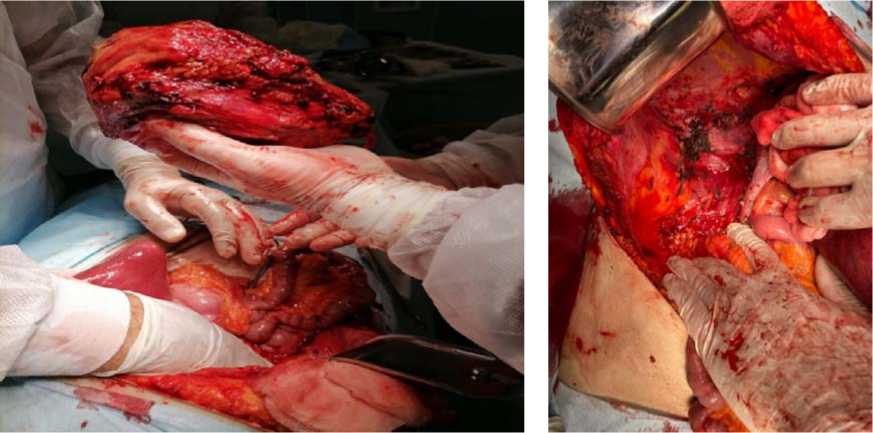
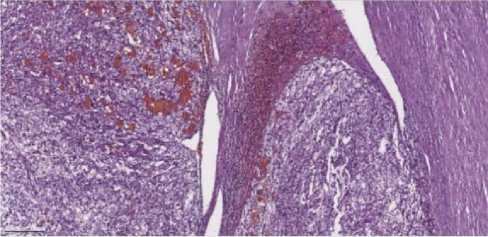
После предоперационной подготовки 24.08.2021 выполнено: лапаротомия, удаление опухоли правой почки/надпочечника размерами 11x10x11 см единым блоком, холецистэктомия (рис. 7, 8). При интраоперационной срочной биопсии парааорталь-ных лимфоузлов данных за злокачественный рост не выявлено. Ранний послеоперацион- ный период протекал без особенностей. На вторые сутки послеоперационного периода удалены дренажи из брюшной полости. На фоне проводимого лечения состояние пациентки с положительной динамикой, послеоперационная рана зажила первичным натяжением. Пациентка в удовлетворительном состоянии выписалась под наблюдение хирурга, онколога поликлиники.
А
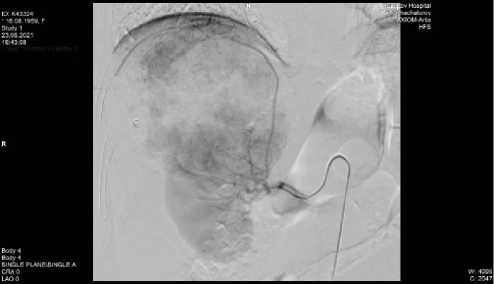
Рисунок 5. А. Селективная артериография правой почечной артерии. В проекции правого надпочечника определяется гиперваскулярное опухолевое образование, основным источником кровоснабжения которой являются ветви верхнего полюса правой почечной артерии, а также функционально расширенная правая нижняя надпочечниковая артерия. Б. Гиперваскулярная опухоль правого надпочечника. Селективная артериография правой нижней диафрагмальной артерии. На снимках определяется крупная зона патологической васкуляризации в проекции верхнего полюса опухолевого узла, источником кровоснабжения которой является правая нижняя диафрагмальная артерия. При помощи микрокатетера произведена селективная катетеризация указанной артерии (на снимке) с ее последующей эмболизацией
Figure 5. А. Selective arteriography of the right renal artery. In the projection of the right adrenal gland, a hyper-vascular tumor formation is determined, the main source of blood supply of which are the branches of the upper pole of the right renal artery, as well as the functionally dilated right lower adrenal artery. В. Hypervascular tumor of the right adrenal gland. Selective arteriography of the right inferior phrenic artery. The images show a large area of pathological vascularization in the projection of the upper pole of the tumor node, the source of blood supply of which is the right lower phrenic artery. With the help of a microcatheter, selective catheterization of the indicated artery (in the picture) was performed, followed by its embolization
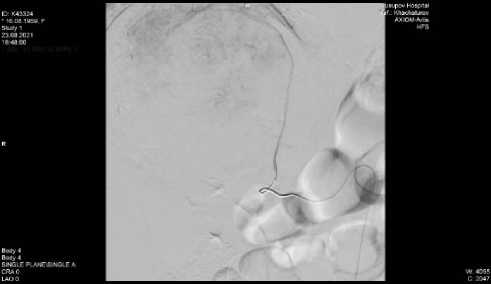
Б
А
Б
Рисунок 6. А. Контрольная артериография правой почечной артерии. Состояние после эмболизации опухолевого узла. Отмечено выраженное снижение васкуляризации образования правого надпочечника. Б. Выделение опухоли правой почки
Figure 6. A. Control arteriography of the right renal artery. Condition after tumor node embolization. There was a marked decrease in vascularization of the formation of the right adrenal gland. B. Dissection of the tumor of the right kidney
А Б
Рисунок 7. А. Удаленное образование. Б. Ложе удаленной опухоли
Figure 7. A. Removed neoplasm. B. The removed tumor bed
А
Б
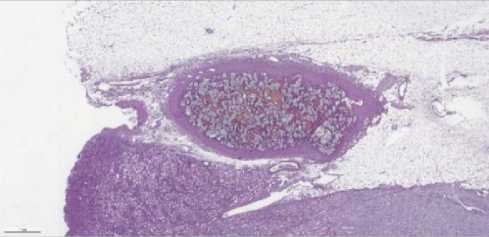
Рисунок 8. А. Светлоклеточная почечноклеточная карцинома почки, grade 2, pT2b pN0 (0/3), LVI 0, Pn 0, без метастатического поражения мочеточника. В краях препарата рост опухоли не выявлен (R0). Альвеолярные и солидные структуры опухоли из клеток со светлой цитоплазмой. Б. Массы инородного вещества в просвете крупного сосуда
Figure 8. A. Clear cell renal cell carcinoma of the kidney, grade 2, pT2b pN0 (0/3), LVI 0, Pn 0, without metastatic lesion of the ureter. No tumor growth was detected at the edges of the resection (R0). Alveolar and solid structures of a tumor from cells with light cytoplasm. B. Masses of foreign matter in the lumen of a large vessel
Заключение
В данном клиническом случае пациентке с желчекаменной болезнью, холецисто-холедохолитиазом и раком почки было выполнено этапное оперативное вмешательство. Первым этапом была выполнена ретроградная папиллосфинктеротомия с хо-ледохолитоэкстракцией, вторым этапом – лапаротомия, удаление опухоли правой почки/надпочечника единым блоком, холецистэктомия после предварительной ангиографии и эмболизации питающих опухоль сосудов. Осложнений во время операций не наблюдалось. Представленное успешное наблюдение демонстрирует один из современных подходов в лечении пациентов с раком почки в сочетании с желчекаменной болезнью и холецистохоледохолитиазом.
Список литературы Клинический случай этапного лечения множественного холедохолитиаза и местнораспространенного рака почки
- Ruhl C.E., Everhart J.E. Gallstone disease is associated with increased mortality in the United States. Gastroenterology. 2011;140(2):508-516. DOI: 10.1053/j.gastro.2010.10.060
- Nosov D.A. et al. Prakticheskiye rekomendatsii po lekarstvennomu lecheniyu pochechnokletochnogo raka. Zlokachestvennyye opukholi. 2020;10:533-541. 10.18027/2224-5057-2020-10-3s2-31. (In Russ). DOI: 10.18027/2224-5057-2020-10-3s2-31.(InRuss)
- Parkin D.M. et al. Global cancer statistics-2002. CA Cancer J. Clin. 2005;55:74-108.
- Chow W.H. et al. Jr. Rising incidence of renal cell cancer in the United States. JAMA. 1999;281:1628-1631.
- Pantuck A.J., Zisman A., Belldegrun A.S. The changing natural history of renal cell carcinoma. J. Urol. 2001;166:1611-1623.


