Клинический случай лечения метастатического почечноклеточного рака комбинацией ниволумаба с кабозантинибом в рутинной клинической практике
Автор: Меньшиков Константин В., Султанбаев Александр В., Измайлов Адель А., Мусин Шамиль И., Меньшикова Ирина А., Чалов Виталий С., Султанбаева Надежда И., Липатов Данила О.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Клинический случай
Статья в выпуске: 2 т.12, 2022 года.
Бесплатный доступ
По данным GLOBOCAN, в 2018 году зарегистрировано около 18 миллионов новых случаев рака и 9,6 миллионов смертей от злокачественных новообразований во всем мире. Почечно-клеточный рак представляет собой опухоль, характеризующуюся потерей гена VHL, и эта потеря приводит к усилению ангиогенеза. Возможности применения иммуно-онкологических и антиангиогенных препаратов значительно улучшили результаты лечения пациентов с метастатическим почечно-клеточный раком. Исследование III фазы CheckMate 9ER посвящено сравнению эффективности и безопасности комбинации ниволумаба с кабозантинибом и сунитиниба в терапии первой линии пациентов со светлоклеточным метастатическим почечно-клеточным раком. Преимущества комбинации ниволумаба и кабозантиниба в сравнении с сунитинибом в отношении отсутствия прогрессирования, общей выживаемости и частоты объективных ответов в целом были одинаковыми в подгруппах, включая группу риска по IMDC, экспрессию опухолевого PD-L1 и наличие или отсутствие метастатического поражения костной ткани. Приведено клиническое наблюдение лечения пациента с метастатическим почечно-клеточным раком. В настоящее время пациенту на протяжении 12 месяцев продолжается терапия кабозантинибом и ниволумабом, сохраняется частичный ответ. Переносимость терапии удовлетворительная, спектр нежелательных явлений соответствует таковому в клиническом исследовании.
Почечно-клеточный рак, ингибиторы тирозинкиназ, ингибиторы контрольных точек, кабозантиниб, ниволумаб
Короткий адрес: https://sciup.org/140296520
IDR: 140296520 | DOI: 10.18027/2224-5057-2022-12-2-45-51
Текст научной статьи Клинический случай лечения метастатического почечноклеточного рака комбинацией ниволумаба с кабозантинибом в рутинной клинической практике
По данным GLOBOCAN, в 2018 году зарегистрировано около 18 миллионов новых случаев рака и 9,6 миллионов смертей от злокачественных новообразований во всем мире [1]. В Республике Башкортостан в 2020 году взято на учет 407 пациентов с вновь установленным диагнозом рака почки, что ниже, чем в предыдущем году — 559. Снижение этого показателя, безусловно, связано с пандемией COVID-19 [2]. По Приволжскому федеральному округу заболеваемость почечноклеточным раком (ПКР) в Республике Башкортостан находится на 4 месте после Республики Татарстан, Нижегородской области, Самарской области. На конец 2020 года в Республике Башкортостан на учете находилось 5094 пациентов с этим диагнозом. Из них 3164 (62,1%) пациентов состоят на учете более 5 лет. Диагноз подтвержден морфологически у 85,3% (81,4%) больных. Одногодичная летальность составила 14,9% (средний показатель по Приволжскому федеральному округу — 15,0%) [3].
Таргетные препараты превосходят традиционные химиотерапевтические по селективности, эффективности и безопасности, действуя на определенные мишени, принимают участие в предотвращении метастазирования. Ингибиторы тирозинкиназ прочно вошли в онкологическую практику и в настоящее время применяются при многих онкологических заболеваниях.
ПКР представляет собой опухоль, характеризующуюся инактивацией гена VHL, что приводит к усилению ангиогенеза [4]. Возможности применения иммуноонкологиче-ских и антиангиогенных препаратов значительно улучшили результаты лечения пациентов с метастатическим ПКР [4–6]. Клинические преимущества у пациентов с прогрессирующим ПКР наблюдались при применении схем, которые включают различные комбинации ингибиторов контрольных точек, антиангиогенные препараты и препараты, блокирующие сигнальную трансдукцию [7–13].
Кабозантиниб (низкомолекулярный ингибитор тиро-зинкиназ) и ниволумаб (ингибитор контрольных точек)
Клинические случаи одобрены для лечения распространенного ПКР. В исследованиях продемонстрировано, что они улучшают общую выживаемость (ОВ) при монтотерапии мПКР в исследованиях III фазы и отдельных наблюдениях [14–20]. Ка-бозантиниб ингибирует тирозинкиназы, участвующие в пролиферации опухолевых клеток, неоваскуляризации и регуляции иммунных клеток, включая MET, рецептор фактора роста 1 (VEGF-R1) посредством VEGF-R3 и семейство киназ ТАМ (TYRO3, AXL и MER) и обладает иммуномодулирующими свойствами, противодействующими индуцированной опухолью иммуносупрессией, которая может усилить ответ на ингибирование иммунных контрольных точек [21–23].
Исследование III фазы CheckMate 9ER посвящено сравнению эффективности и безопасности комбинации ниво-лумаба с кабозантинибом и сунитиниба в терапии первой линии пациентов со светлоклеточным мПКР. В исследование включались пациенты с ранее не леченным светлоклеточным мПКР, с любым прогнозом IMDC и статусом по Карновскому не менее 70 [24–26].
Всего с сентября 2017 г. по май 2019 г. 651 пациент был рандомизирован в 125 центрах в 18 странах; 323 пациента в группу ниволумаба и кабозантиниба и 328 пациентов в группу сунитиниба. Из них 22,4% имели IMDC благоприятный риск, 57,8% — промежуточный риск, а 19,8% — неблагоприятный. Экспрессия PD-L1 более 1 % отмечена у 25,5% пациентов, 74,5% имели менее 1%. Характеристики пациентов на исходном уровне были репрезентативными для популяции с ранее не леченным распространенным мПКР. Основной причиной прекращения исследуемой терапии было прогрессирование заболевания.
При медиане наблюдения за ОВ 18,1 мес. (диапазон от 10,6 до 30,6 мес.) медиана выживаемости без прогрессирования (ВБП) составила 16,6 мес. (95% доверительный интервал ДИ от 12,5 до 24,9) при применении ниволумаба в комбинации с кабозантинибом и 8,3 мес. (95% ДИ от 7,0 до 9,7) в группе сунитиниба. Ниволумаб в сочетании с кабозантинибом продемонстрировал лучшие результаты в ВБП перед сунитинибом. Комбинация ниволумаба с кабозантинибом также имела значительное преимущество в ОВ по сравнению с сунитинибом. Вероятность ОВ через 12 месяцев составила 85,7% (95% ДИ от 81,3 до 89,1) с ниволумабом плюс кабозантиниб и 75,6% (95% ДИ от 70,5 до 80,0) в группе сунитиниба (коэффициент риска смерти 0,60; 98,89% ДИ от 0,40 до 0,89; Р=0,001) [27].
В приведенном ниже клиническом наблюдении продемонстрирован первый опыт терапии мПКР в республике Башкортостан комбинацией ниволумаба и кабозанти-ниба. При выборе терапии первой линии у данного пациента мы руководствовались в первую очередь клиническими рекомендациями и данными рандомизированных исследований. Выбор терапии в настоящее время весьма разнообразен и представляет собой субъективное и потенциально предвзятое мнение экспертов-участников. Это подчеркивает сложность этой проблемы: наличие нескольких вариантов лечения с одинаковым уровнем доказательности усложняет принятие индивидуального решения о лечении в реальных условиях. Рекомендации медицинских сообществ считаются стандартом лечения. Однако они могут не быть перенесены на всех пациентов, наблюдаемых в повседневной практике из-за различных причин, в том числе сопутствующий патологии, предпочтения пациента, доступности препаратов [28,29].
Клинический случай
Пациент Ч., 1967 г. р., в 2016 году оперирован по поводу опухоли левой почки по экстренным показаниям в городской клинической больнице. Пациенту выполнена нефрэктомия слева и установлен диагноз рака левой почки стадии I–T1bN0M0. Гистологически констатирован светлоклеточный почечноклеточный рак. Пациент находился на диспансерном наблюдении до апреля 2021 года, когда при плановом прохождении компьютерной томографии была выявлена опухоль легкого.
В условиях Республиканского клинического онкологического диспансера проведено обследование, включая методы инструментальной диагностики. По данным МРТ головного мозга очаговой патологии не выявлено. По данным сцинтиграфии выявлено метастатическое поражение костей.
По данным КТ ОГК — картина метастатических конгломератов внутригрудных лимфоузлов, на фоне которых не исключается первичный рак нижней доли правого легкого, перибронхиально-узловой формы. КТ ОБП: состояние после нефрэктомии слева, диффузные изменения поджелудочной железы. КТ-картина метастаза в L5 позвонок с инвазией остистой мышцы. Очаг остеосклероза в 1 ребре справа.
С учетом неоднозначной картины, не позволяющей исключить первично-множественный рак, пациенту произведено ПЭТ / КТ всего тела. По результату ПЭТ/ КТ — состояние после нефрэктомии слева в 2016 году, конгломераты увеличенных внутригрудных лимфоузлов, в S6 правого легкого — субплевральный очаг без регистрации активности, ателектаз в S9, S10 правого легкого, литический метастаз в дужке L5 позвонка с распространением в перивертебральные мягкие ткани слева (рис. 1, а, б).
Пациенту произведена бронхоскопия, выявлены признаки метастатического поражения базальных бронхов нижнедолевого бронха справа, главного бронха слева, средостенных лимфатических узлов (рис. 2, а, б). С целью верификации диагноза и подтверждения прогрессии ПКР произведена биопсия метастатических лимфатических узлов средостения посредством фибробронхоскопии, диагноз метастазов почечнокле-точго рака подтвержден.
На момент начала системной терапии мПКР по шкале IMDC пациент относился к группе умеренного про-
Клинические случаи
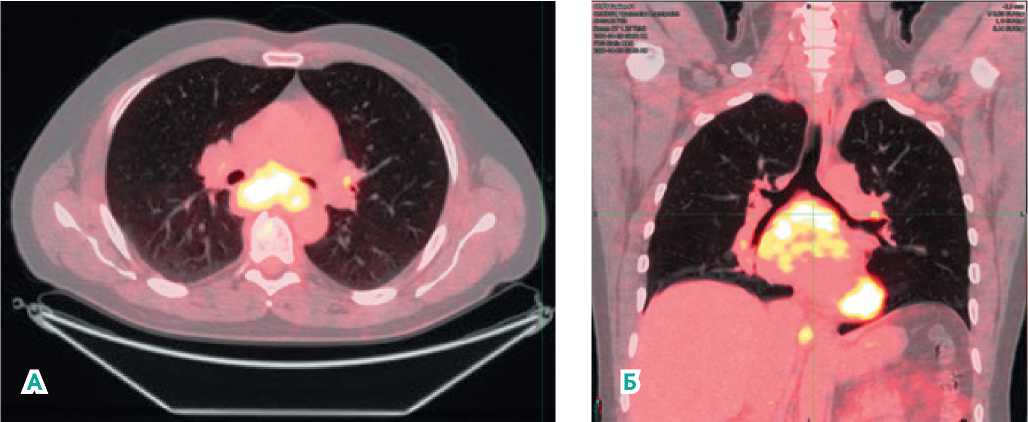
Рисунок 1 (а, б). ПЭТ/КТ тела от 26.04.2021: состояние после нефрэктомии слева в 2016 г. Конгломераты увеличенных внутригрудных лимфоузлов, в S6 правого легкого субплевральный очаг без регистрации активности, ателектаз в S9–10 правого легкого, литический метастаз в дужке L5 позвонка с распространением в перивертебральные мягкие ткани слева.
гноза, так как из факторов риска имелись следующие [26]: уровень гемоглобина < 130 г/л (на момент начала терапии 114 г/л), концентрация скорректированного Ca 2 + в сыворотке крови > 10 мг/дл (12,8 мг/дл).
С мая 2021 года начата терапия кабозантини-бом в дозе 40 мг в сутки ежедневно и ниволумабом 480 мг 1 раз в 28 дней, согласно клиническим рекомендациям. Из нежелательных явлений следует отметить кожную токсичность II ст., которая развилась в течении первых 8 недель терапии, и эпизоды гипертермии до 37,8 С° так же в первые 8 недель терапии.
Нежелательные явления не потребовали редукции или отмены доз препаратов, разрешились к третьему курсу терапии. Следует отметить, что пациенту с учетом метастатического поражения костей начата терапия ингибиторами остеолиза [30].
На контрольном ПЭТ/ КТ через три месяца терапии у пациента был зарегистрирован частичный ответ (рис. 3).
В настоящее время пациенту на протяжении 12 месяцев продолжается терапия кабозантинибом и ниволумабом, сохраняется частичный ответ. Пере-
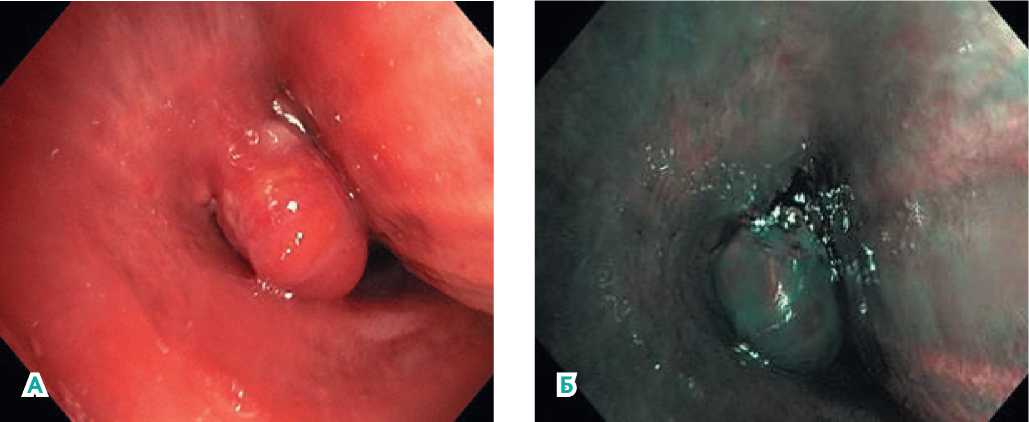
Рисунок 2 (а, б). Данные ФБС от 14.04.2021 при проведении морфологической верификации. Эндоскопическая картина более вероятна для метастатических опухолей базальных бронхов нижнедолевого бронха справа, главного бронха слева. Признаки метастатического поражения средостенных лимфоузлов.
Клинические случаи
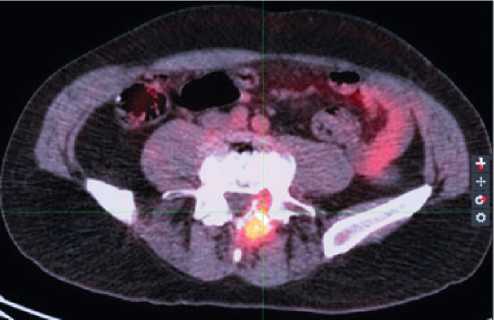
Рисунок 3. ПЭТ/КТ. Отмечается уменьшение размера и активности метастаза в L5 позвонке.
носимость терапии удовлетворительная, в анализах клинически значимых изменений нет. Пациенту проводится мониторинг нежелательных явлений, в том числе иммуноопосредованых, контролируются клинические анализы, гормоны щитовидной железы. Контрольные ПЭТ / КТ проводятся каждые три месяца терапии.
ОБСУЖДЕНИЕ
В клиническом наблюдении у пациента была достаточно выраженная опухолевая нагрузка, количество органов метастазирования более трех (лимфатические узлы, кости, легкие, незначительный плевральный выпот). Для этой группы пациентов предпочтительно назначение тирозинкиназных ингибиторов для достижения более быстрого ответа. Так же следует отметить наличие метастазов в кости. В исследование CABOSUN включались относительно часто пациенты с плохими прогностическими признаками, в том числе не включенными в критерии IMDC, такие как наличие костных метастазов, отсутствие предшествующей нефрэктомии, большее количество метастатических очагов и худшим статусом по ECOG PS [30,31]. Лечение кабозантинибом приводило к клинически значимому и статистически достоверному удлинению ВБП по сравнению с сунити-нибом в качестве первой линии терапии. Наблюдаемое улучшение ВБП может быть частично связано с ингибированием MET и AXL кабозантинибом в дополнение к рецепторам VEGF [27]. Пациенту была начата комбинированная терапия кабозантиниб и ниволумаб. Назначая этот вариант лечения, мы рассчитывали на быстрый ответ и на длительную ВБП, как показано в исследовании CheckMate 9ER [27].
В приведенном клиническом наблюдении отмечались нежелательные явления, связанные как с кабозантини-бом, так и с ниволумабом. В исследовании CheckMate 9ER нежелательные явления любой причины во время лечения возникли у 99,7% пациентов, получавших ниволумаб и кабозантиниб, причем нежелательные явления III ст. и выше имели место у 75,3% пациентов. Иммуноопосре-дованных нежелательных явлений у пациента не было зарегистрировано, хотя в исследовании CheckMate 9ER 19,1% пациентов в группе ниволумаб и кабозантиниб получали глюкокортикоиды по поводу иммуноопосредованных нежелательных явлений [27].
ЗАКЛЮЧЕНИЕ
В настоящее время имеется достаточно большое количество возможностей для лечения пациентов с распространенным ПКР. Выбор первой линии терапии не ограничен только монотерапией, имеются комбинации иммуноон-кологических препаратов и ингибиторов тирозинкиназ. Комбинация ниволумаба и кабозантиниба продемонстрировала удовлетворительный профиль безопасности в реальной клинической практики в условиях дневного стационара. Следует отметить, что это первый опыт применения этой комбинации в Республике Башкортостан. Результаты лечения пациента соответствовали данным исследования CheckMate 9ER. Нежелательные явления были ожидаемы, не требовали редукции и отмены доз препаратов. Комбинация ниволумаба и кабозантиниба продемонстрировала эффективность у пациента с метастатическим почечноклеточным раком в I линии.
Список литературы Клинический случай лечения метастатического почечноклеточного рака комбинацией ниволумаба с кабозантинибом в рутинной клинической практике
- Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68 (6):394-424. https://doi.org/10.3322/caac.21492. Epub 2018 Sep 12.
- Измайлов А. А., Аюпов Р. Т., Сулатнбаев А. В., Мусин Ш. И., Меньшиков К. В., Забелин М. В. Организация работы онкологической службы в Республике Башкортостан в условиях пандемии COVID-19. Современные проблемы здравоохранения и медицинской статистики 2020 г., № 3. C. 195-208. https://doi.org/10.24411/2312-2935-2020-00067.
- Состояние онкологической помощи населению России в 2021 году. Под редакцией Каприна А. Д., Старинского В. В., Шахазадовой А. О.: МНИОИ им. П. А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2021. 239 с. ISBN 978-5-85502-262-9.
- Choueiri TK, Motzer RJ. Systemic therapy for metastatic renal-cell carcinoma. N Engl J Med 2017;376:354-66.
- McKay RR, Bosse D, Choueiri TK. Evolving systemic treatment landscape for patients with advanced renal cell carcinoma. J Clin Oncol 2018 October 29 (Epub ahead of print).
- Heidegger I, Pircher A, Pichler R. Targeting the tumor microenvironment in renal cell cancer biology and therapy. Front Oncol 2019;9:490.
- Apolo AB, Nadal R, Girardi DM, et al. Phase I study of cabozantinib and nivolumab alone or with ipilimumab for advanced or metastatic urothelial carcinoma and other genitourinary tumors. J Clin Oncol 2020;38:3672-84.
- Amin A, Plimack ER, Ernstoff MS, et al. Safety and efficacy of nivolumab in combination with sunitinib or pazopanib in advanced or metastatic renal cell carcinoma: the CheckMate 016 study. J Immunother Cancer 2018;6:109.
- Rini BI, Plimack ER, Stus V, et al. Pembrolizumab plus axitinib versus sunitinib for advanced renal-cell carcinoma. N Engl J Med 2019;380:1116-27.
- Motzer RJ, Penkov K, Haanen J, et al. Avelumab plus axitinib versus sunitinib for advanced renal-cell carcinoma. N Engl J Med 2019;380:1103-15.
- Agarwal N, Vaishampayan U, Green M, et al. Phase Ib study (COSMIC-021) of cabozantinib in combination with atezolizumab: results of the dose escalation stage in patients (pts) with treatmentnaive advanced renal cell carcinoma (RCC). J Clin Oncol 2020;29: Suppl 8:872P. abstract.
- Pal S, Tsao C-K, Suarez C, et al. Cabozantinib (C) in combination with atezolizumab (A) as first-line therapy for advanced clear cell renal cell carcinoma (ccRCC): Results from the COSMIC-021 study. Ann Oncol 2020;31: Suppl 4: S554. abstract.
- Меньшиков К. В., Султанбаев А. В., Мусин Ш. И., Измайлов А. А., Меньшикова И. А., Хамматова Л. А., Попова Е. В., Султанбаева Н. И., Липатов Д. О. Вторая линия терапии метастатического почечноклеточного рака. Обзор литературы. Поволжский онкологический вестник. Том 12, № 4. 2021 С. 39-52.
- Меньшиков К. В., Измайлов А. А., Султанбаев А. В., Мусин Ш. И., Чалов В. С., Меньшикова И. А., Султанбаева Н. И., Липатов Д. О. Метастатический почечно-клеточный рак, возможности таргетной терапии. Медицинский Совет. 2021; (20):138-144. https://doi.org/10.21518/2079-701X-2021-20-138-144.
- Меньшиков К. В., Султанбаев А. В., Мусин Ш. И., Рахматуллина И. Р., Меньшикова И. А., Хамматова Л. А., Попова Е. В., Султанбаева Н. И., Липатов Д. О. Возможности комбинированной иммунотаргетной терапии метастатического почечно-клеточного рака. Обзор литературы. Поволжский онкологический вестник. Том 13, № 1. 2022. С. 46-61.
- Motzer RJ, Escudier B, McDermott DF, et al. Nivolumab versus everolimus in advanced renal-cell carcinoma. N Engl J Med 2015;373:1803-13.
- Schmidt E, Lister J, Neumann M, et al. Cabozantinib versus standard-of-care comparators in the treatment of advanced/ metastatic renal cell carcinoma in treatment-naive patients: a systematic review and network meta-analysis. Target Oncol 2018;13:205-16.
- Choueiri TK, Halabi S, Sanford BL, et al. Cabozantinib versus sunitinib as initial targeted therapy for patients with metastatic renal cell carcinoma of poor or intermediate risk: the Alliance A031203 CABOSUN trial. J Clin Oncol 2017;35:591-7.
- Choueiri TK, Escudier B, Powles T, et al. Cabozantinib versus everolimus in advanced renal cell carcinoma (METEOR): final results from a randomised, openlabel, phase 3 trial. Lancet Oncol 2016;17: 917-27.
- Меньшиков К. В., Султанбаев А. В., Мусин Ш. И., Измай лов А. A., Мугинов Р. Р., Меньшикова И. А., Шарифгалеев И. А., Липатов Д. О., Султанбаева Н. И. Почечно-клеточный рак с метастазами в наружных половых органах. Обзор литературы и клинический случай. Онкоурология. 2021;17 (2):174-181. https://doi.org/10.17650/1726-9776-2021-17-2-174-181.
- Saeed A, Phadnis M, Park R, et al. Cabozantinib (cabo) combined with durvalumab (durva) in gastroesophageal (GE) cancer and other gastrointestinal (GI) malignancies: Preliminary phase Ib CAMILLA study results. J Clin Oncol 2020; 38: Suppl:4563. abstract.
- Bergerot P, Lamb P, Wang E, Pal SK. Cabozantinib in combination with immunotherapy for advanced renal cell carcinoma and urothelial carcinoma: rationale and clinical evidence. Mol Cancer Ther 2019;18:2185-93.
- Lu X, Horner JW, Paul E, et al. Effective combinatorial immunotherapy for castration-resistant prostate cancer. Nature 2017;543:728-32.
- Apolo AB, Nadal R, Tomita Y, et al. Cabozantinib in patients with platinumrefractory metastatic urothelial carcinoma: an open-label, single-centre, phase 2 trial. Lancet Oncol 2020;21:1099-109.
- Heng DY, Xie W, Regan MM, et al. Prognostic factors for overall survival in patients with metastatic renal cell carcinoma treated with vascular endothelial growth factor-targeted agents: results from a large, multicenter study. J Clin Oncol 2009;27:5794-9.
- Heng DYC, Xie W, Regan MM, et al. External validation and comparison with other models of the International Metastatic Renal-Cell Carcinoma Database Consortium prognostic model: a populationbased study. Lancet Oncol 2013;14:141-8.
- Choueiri TK, Powles T, Burotto M, Escudier B, Bourlon MT, Zurawski B, Oyervides Juarez VM, Hsieh JJ, Basso U, Shah AY, Suarez C, Hamzaj A, Goh JC, Barrios C, Richardet M, Porta C, Kowalyszyn R, Feregrino JP, Zolnierek J, Pook D, Kessler ER, Tomita Y, Mizuno R, Bedke J, Zhang J, Maurer MA, Simsek B, Ejzykowicz F, Schwab GM, Apolo AB, Motzer RJ; CheckMate 9ER Investigators. Nivolumab plus Cabozantinib versus Sunitinib for Advanced Renal-Cell Carcinoma. N Engl J Med. 2021 Mar 4;384 (9):829-841. https://doi.org/10.1056/NEJMoa2026982. PMID:33657295;PMCID: PMC8436591.
- Носов Д. А., Б. Я. Алексеев, Гладков О. А., Волкова М. И., Попов А. М., Харкевич Г. Ю. Практические рекомендации по лекарственному лечению почечноклеточного рака. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2021 (том 11). 31. 10.18027/2224-5057-2021-11-3s2-31.
- Aeppli S, Schmaus M, Eisen T, Escudier B, Grunwald V, Larkin J, McDermott D, Oldenburg J, Porta C, Rini BI, Schmidinger M, Sternberg CN, Rothermundt C, Putora PM. First-line treatment of metastatic clear cell renal cell carcinoma: a decision-making analysis among experts. ESMO Open. 2021 Feb;6 (1):100030. https://doi.org/10.1016/j.esmoop.2020.100030. Epub 2021 Jan 15. PMID:33460963;PMCID: PMC7815472.
- McKay RR, Lin X, Perkins JJ, Heng DY, Simantov R, Choueiri TK. Prognostic significance of bone metastases and bisphosphonate therapy in patients with renal cell carcinoma. Eur Urol 2014;66 (3):502e9.
- Hanna N, Sun M, Meyer CP, Nguyen PL, Pal SK, Chang SL, et al. Survival analyses of patients with metastatic renal cancer treated with targeted therapy with or without cytoreductive nephrectomy: a national cancer data base study. J Clin Oncol 2016; 34 (27):3267e75


