Клинический случай метастаза остеосаркомы в полости сердца
Автор: Иофе Елена Игоревна, Конов В.Е., Соловьев Е.Б., Бридун И.М.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Случаи из клинической практики
Статья в выпуске: 1 т.22, 2018 года.
Бесплатный доступ
Новообразования сердца относятся к малоизученной области клинической онкологии, что обусловлено крайней редкостью представленной патологии, отсутствием патогномоничных симптомов, значительным разнообразием клинических проявлений и сложностью диагностики. В целях достижения диагностической и терапевтической адекватности клиницисты должны быть осведомлены об онкологической сердечной патологии, а также ее часто атипичных клинических проявлениях. В статье представлен клинический случай распространения опухолевого процесса по сосудистой системе и злокачественного поражения правого предсердия сердца у пациента с остеосаркомой плечевой кости. Выполнена резекция метастаза остеосаркомы и пластика правого предсердия заплатой из аутоперикарда.
Новообразования сердца, метастаз, остеосаркома
Короткий адрес: https://sciup.org/142230596
IDR: 142230596 | DOI: 10.21688/1681-3472-2018-2-58-62
Текст научной статьи Клинический случай метастаза остеосаркомы в полости сердца
Многие злокачественные опухоли могут метастазировать в сердце. Вторичные опухоли сердца выявляют в 13–40 раз чаще, чем первичные. Метастазирование в сердце или прорастание опухоли в миокард и перикард регистрируют по различным данным у 0,3–27,0% умерших от злокачественных новообразований [1]. K.Y. Lam и коллеги рассмотрели 7 случаев первичных и 154 случая вторичных сердечных опухолей на вскрытиях, проведенных в течение 20-летнего периода в Больнице королевы Марии в Гонконге (англ. Queen Mary Hospital) [2]. В этом исследовании частота первичных и вторичных опухолей сердца в 12 485 проведенных вскрытиях составила 0,056 и 1,23% соответственно [3]. В зависимости от вида первичной опухоли метастазы в сердце чаще всего возникают при меланоме, реже — при лейкозах и лимфомах. Большинство вторичных опухолей сердца относятся к карциномам, реже встречаются саркомы [4]. Метастазы в сердце почти всегда возникают на далеко зашедшей стадии заболевания и сочетаются с первичной опухолью или метастазами в пределах грудной по- лости. Метастазы обычно представляют собой мелкие плотные узлы при некоторых новообразованиях, в частности саркомах и гемобластозах, встречается диффузная опухолевая инфильтрация сердца [5]. Симптомы зависят от локализации и размеров метастазов, а не происхождения. Метастазирование в перикард сопровождается образованием геморрагического перикардиального выпота и симптомами тампонады сердца. При интрамуральном миокардиальном метастазировании возникают предсердные и желудочковые аритмии, включая трепетание и фибрилляцию предсердий, а также нарушения проводимости. Крупные метастазы в эндокард способствуют формированию внутриполостной обструкции [6]. Эхокардиография является наиболее чувствительным инструментом для выявления метастатического поражения сердца. Терапия при метастатических сердечных опухолях зависит от происхождения новообразования, включает системную химиотерапию или паллиативные процедуры. Хирургическая резекция показана только при уединенных внутриполостных метастазах в сердце и приводит к удалению камер и клапана [7].
Статья доступна по лицензии Creative Commons Attribution 4.0.
Клинический случай
18 января 2017 г. в отделение детской кардиологии и кардиохирургии ИНВХ им. В.К. Гусака обратились мать с ребенком 11 лет с жалобами на боли за грудиной, одышку, цианоз носогубного треугольника. Из анамнеза жизни: в 2015 г. ребенку проведены межлопаточно-грудная ампутация слева, торакотомия справа, удален очаг нижней доли правого легкого по поводу остеосаркомы левой плечевой кости; T2N0Mla, IVA стадия по классификации Американского объединенного противоракового комитета (англ. American Joint Committee on Cancer, AJCC), III стадия по Enneking, метастатическое поражение легких. Проведено 18 блоков полихимиотерапии (доксорубицин, цисплатин, метотрексат). В послеоперационном периоде у ребенка обнаружен флотирующий тромб правой брахиоцефальной вены, разрешившийся на фоне терапии. По данным повторных исследований в 2016 г. (ультразвуковых исследований сосудов и сердца, компьютерной томографии органов грудной клетки) тромбов и патологических образований не выявлено.
При поступлении отмечены бледность кожных покровов и видимых слизистых, цианоз носогубного треугольника, петехиальные высыпания на передней брюшной стенке и голенях. Аускультативно — жест кое дыхание, справа ниже лопатки крепитирующие хрипы. Частота дыхания — 22 в мин. Границы относительной сердечной тупости расширены в поперечнике. Деятельность сердца ритмичная, частота сердечных сокращений — 140 в мин, артериальное давление — 95/60 мм рт. ст. Тоны сердца были приглушены, выявлен систолический шум на верхушке по левому краю грудины. Печень увеличена на 2 см. Пастозность голеней и стоп.
По данным общего анализа крови, 63 г/л. Снижение протромбинового индекса до 50%, международного нормализованного отношения до 1,52, повышение активированного частичного тромбопластинового времени до 57 с. По данным эхокардиографии (ЭхоКГ) 19.01.2017 определяется образование 1,9 х 3,9 х 4,8 см, пролабирующее в полость правого желудочка, практически полностью обтурирующие трикуспидальный клапан (ТК). Градиент давления ( Δ р) на ТК — 8,7 мм рт. ст. Сепарация листков перикарда по задней стенке левого желудочка составляет 0,88 см, по передней стенке — 0,44 см, что соответствует приблизительно 125 мл выпота (рис. 1).
Ребенку проведена рентгенография органов грудной клетки (19.01.2017): определяется периферическое образование до 2 см в диаметре слева на уровне IV ребра с четкими контурами. Консолидированный перелом VI
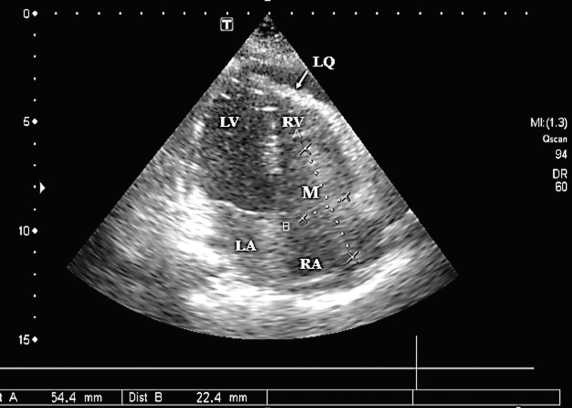
Рис. 1. Эхокардиография (19.01.2017) — апикальная четырехкамерная позиция: в полости правого предсердия определяется образование больших размеров, пролабирующее в правый желудочек, практически полностью обтурирующее трикуспидальный клапан
Примечание. М — метастаз; LA — левое предсердие; LV — левый желудочек; RA — правое предсердие; RV — правый желудочек; LQ — экссудат в полости перикарда
Fig. 1. Echocardiography as of 19.01.17 in apical four-chamber position: a large-sized neoplasm is observed in the right atrium cavity bulging into the right ventricle and nearly blocking the tricuspidal valve. М, metastasis; LA, left atrium; LV, left ventricle; RA, right atrium; RV, right ventricle; LQ, exudate in the pericardial cavity ребра справа. Корни структурны. По данным спиральной компьютерной томографии (20.01.2017) отмечается появление в S4 верхней доли левого легкого, субплеврально, очага до 17 мм в диаметре, с вероятным распространением на паракостальную плевру. В околосердечной сумке определяется жидкостное содержимое с расслоением листков перикарда максимально в проекции левого желудочка до 12 мм. С целью уточнения локализации и верификации образования в полости правого предсердия и исключения тромбоза верхней полой вены ребенку проведена флебо графия (20.01.2017): протекание контрастного вещества по подключичной и верхней полой венам свободное, адекватно скорости и объему введения контрастного вещества; контрастируются правое предсердие, правый желудочек, легочная артерия. Исключить пристеночный тромбоз в верхней полой вене невозможно.
При повторной эхокардиографии в правом предсердии продолжает лоцироваться образование 4,9 х 2,4/3,6 см (размеры незначительно увеличились, наросла обструкция ТК, градиент давления на ТК — 12,3 мм рт. ст.). Незна-
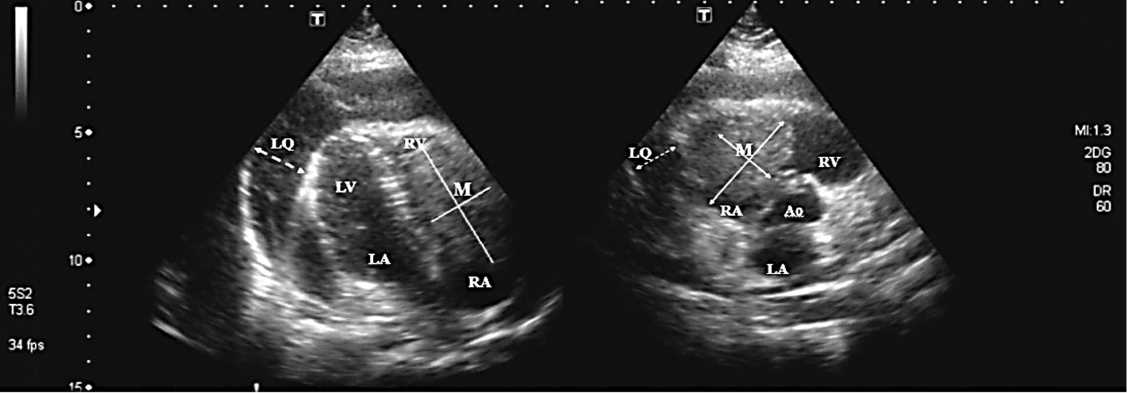
Рис. 2. Эхокардиография на 7-е сут. пребывания в стационаре
Примечание. М — метастаз; LA — левое предсердие; LV — левый желудочек; RA — правое предсердие; RV — правый желудочек; LQ — экссудат в полости перикарда; Ао — аорта
Fig. 2. Echocardiography at 7 days of hospital stay. М, metastasis; LA, left atrium; LV, left ventricle; RA, right atrium; RV, right ventricle; LQ, exudate in the pericardial cavity; Ao, aorta чительно увеличился выпот в перикарде (1,1–1,2 см). В устье верхней полой вены тень 1,5 см.
В динамике в лабораторных данных нарастала тромбоцитопения до 32 г/л, гипокоагуляция (протромбиновый индекс — 57%, протромбиновое время — 23 с, международное нормализованное отношение — 1,8, активированное частичное тромбопластиновое время — 38 с, фибриноген — 2,75 г/л, длительность кровотечения по Дюке — 1 мин). Растворимый фибрин-мономерный комплекс повысился до 19 мг/% при n = 3–4 мг/%. Диагностирован синдром диссеминированного внутрисосудистого свертывания крови (ДВС-синдром), стадия гипокоагуляции.
С учетом ДВС-синдрома в терапию введено переливание одногруппной свежезамороженной плазмы 10 мл/кг/сут., для уменьшения размеров образования — гепарин 10 ед./кг/ч под контролем свертываемости по Ли – Уайту. С антибактериальной целью добавлен цефтазидим (фортум).
На 7-е сут. (с 15:00 24.01.2017) пребывания в стационаре ухудшилось состояние ребенка. Появились жалобы на слабость, нехватку воздуха. Общее состояние тяжелое за счет нарастания сердечно-дыхательной недостаточности. Ступорозное состояние. Явления адинамии. Тенденция к снижению артериального давления с 90/60 до 80/50 мм рт. ст., синусовая тахикардия до 150 в мин, парадоксальный пульс, нарастание одышки до 30–40 в мин, снижение сатурации кислородом на фоне инсуфля-ции увлажненного кислорода до 82%. По данным ЭхоКГ отмечалось нарастание сепарации листков перикарда по передней стенке правого желудочка до 2,8 см, в области верхушки до 2,1 см, по задней стенке левого желудочка до 2,0 см. Образование в правом предсердии 4,9х2,9х9,6 см, пролабирующее в полость правого желудочка, практически полностью обтурирующее трикуспидальный клапан. Градиент давления на ТК — 11,0 мм. рт. ст. Нижняя и верхняя полые вены не колабируют (рис. 2).
Учитывая резко прогрессирующие явления сердечнодыхательной недостаточности, обусловленные обтурацией трикуспидального клапана, объемным образованием в правом предсердии и тампонадой сердца на фоне нарастания экссудата в перикарде, удалено новообразование правого предсердия, проведена пластика правого предсердия заплатой из аутоперикарда с применением искусственного кровообращения.
Ход операции: продольная срединная стернотомия. Перикард напряжен. Следы хронического воспалительного процесса переднего средостения. При вскрытии перикарда эвакуировано до 400 мл геморрагического выпота. На этом фоне отмечена стабилизация показателей гемодинамики. Перикард утолщен. При ревизии: перед няя боковая поверхность правого предсердия от устья верхней полой вены кверху от пограничной борозды до верхушки ушка правого предсердия покрыта бугристой, плотной на ощупь тканью (рис. 3), проникающей через стенку предсердия в полость сердца. По обычной методике подключен и пущен аппарат искусственного кровообраще-
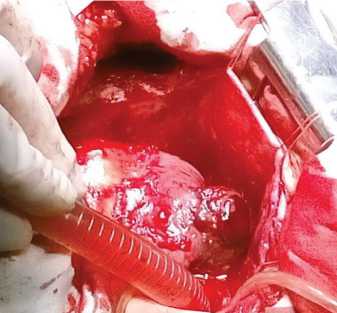
Рис. 3. Правое предсердие, покрытое метастатической тканью
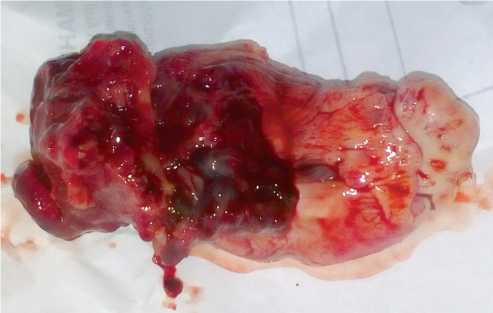
Рис. 4. Макропрепарат метастаза остеосаркомы, удаленного из правого предсердия
Fig. 4. Gross specimen of osteosarcoma metastases resected from the right atrium
Fig. 3. Right atrium covered with metastatic tissue
ния. В пределах визуально неизмененных тканей иссечена стенка предсердия, интимно взаимосвязанная с образованием (размером 10 x 5 см), которое от стенки предсердия пролабировало через трикуспидальный клапан в полость правого желудочка (рис. 4). Ревизия трикуспидального клапана, клапан компетентен. Пластика дефекта стенки правого предсердия заплатой из аутоперикарда размером 6 x 4 см. Тщательный гемостаз. Установка двух дренажей и проведение электродов к правому желудочку. Послойное ушивание раны. Асептическая повязка.
Во время оперативного лечения ребенку был перелит тромбоконцентрат для профилактики нарастания тромбоцитопения как звена ДВС-синдрома.
В 1-е сут. после оперативного лечения состояние ребенка улучшилось, регрессировали явления сердечно-дыхательной недостаточности, пациент не лихорадил. Кожные покровы бледные с угасающими элементами мелкоточечной петехиальной сыпи на передней поверхности брюшной стенки, голенях. Сохранялась легкая пастозность голеней и стоп. Над легкими перкуторно легочной звук, аускультативно жесткое дыхание, в нижних отделах ослаблено, справа в прикорневой зоне крепити-рующие хрипы. SрО2 96% на фоне инсуффляции увлажненного кислорода. Тоны сердца оставались приглушены, но увеличилась их звучность. Гемодинамика стабильная: артериальное давление 128/63 мм рт. ст., ритм синусовый с частотой сердечных сокращений 88 в мин. Живот симметричный, мягкий, безболезненный во всех отделах, прослушивается вялая перистальтика. Мочеотделение по мочевому катетеру. По дренажам 90 мл геморрагичес- кого отделяемого с гемоглобином 15 г/л. По данным общего анализа крови: анемия средней степени тяжести (Эр — 2,68 Т/л, Нв — 91 г/л), тромбоцитопения (Тr — 147 г/л). По данным ЭхоКГ: сохраняется дилатация правых камер сердца, недостаточность ТК III ст. (20,5 мм рт. ст.). Давление в легочной артерии 26 мм рт. ст. Уплотнение свободной стенки правого предсердия 0,7x1,5 см, градиент давления на ТК — 4,1 мм рт. ст. Выпота в перикарде нет.
По данным гистологического исследования в материале обнаружены элементы незрелой соединительнотканной опухоли, вероятно остеосаркомы (рис. 5).
На фоне проводимого лечения состояние ребенка улучшилось, полностью регрессировали явления сердечно-дыхательной недостаточности, постепенно нормализовалась картина крови, субъективно ребенок чувствовал себя хорошо, послеоперационная рана зажила первичным натяжением.
Учитывая данные гистологического заключения, на 7-е сут. после оперативного лечения ребенка перевели в онкологическое отделение для получения специализированной терапии.
Обсуждение
Представленный случай является примером вторичного метастатического поражения сердца трансвенозным путем. Вследствие активации тромбоцитов, синтеза ингибиторов фибринолиза и прокоагулянтов опухолевыми клетками в организме происходит активация коагуляционного и сосудисто-тромбоцитарного
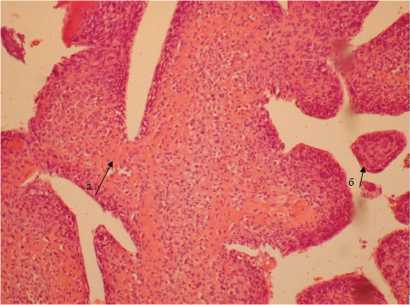
Рис. 5. Микропрепарат метастаз остеосаркомы: а — остеоидное вещество, б — формирование виллезных структур недифференцированными клетками. Окраска гематоксилином и эозином. Увеличение х 100
Fig. 5. Gross specimen of osteosarcoma metastases: a , osteoid substance; б , generation of villous structures by immature cells. Dyed with hematoxylin and eosin.
100х magnification звеньев свертывающей системы крови. При этом циркулирующие опухолевые клетки также могут прилипать к эндотелию венозных сосудов, образуя гнездо для формирования тромба. Опухолевый тромб способен расти по току крови по направлению к правому предсердию и в ряде случаев дорастать до правого желудочка и легочной артерии. По данным литературы, риск венозного тромбоэмболизма зависит от степени злокачественности опухоли: самые высокие показатели наблюдаются у больных с опухолями костной системы (37,7 случая на тысячу больных) [8]. В представленном случае флотирующий тромб в правой брахиоцефальной вене, выявленный у ребенка после межлопаточно-грудной ампутации слева, мог быть метастазом опухоли, и его передислокация в область устья верхней полой вены привела к прорастанию опухолевых клеток в предсердие. Травматизация эндокарда предсердий в результате катетерных манипуляций также могла стать причиной появления опухолевых клеток. Приведенный случай свидетельствует о необходимости более прецизионного подхода к обследованию больных со злокачественными онкопатологиями в послеоперационном периоде для выявления метастатических очагов.
Заключение
В данном случае, несмотря на высокий риск операции, удаление опухоли из полости правого предсердия было единственным путем спасти жизнь ребенка, так как вкли- нение опухоли в трехстворчатый клапан нарушало пути венозного оттока и вторично привело к нарастанию выпота в перикардиальной сорочке и тампонаде сердца. По данным Американского антиракового сообщества, 5-летняя выживаемость пациентов, независимо от вида опухоли, составляет 16%. Согласно прогнозам, 4% больных с метастазами в сердце проживут более 5 лет, 22% пациентов — 3 года, 20% больных — 2 года [9]. Если возможно выполнить полную резекцию новообразования, при отсутствии поражения других органов тела, прогноз положительный. К сожалению, это удается крайне редко, а при частичной резекции смертность очень высока.
Финансирование
Исследование не имело финансовой поддержки.
Список литературы Клинический случай метастаза остеосаркомы в полости сердца
- Hoffmeier A., Sindermann J.R., Scheid Н.Н., Martens S. Cardiac tumors - diagnosis and surgical treatment. J Deutsches Ärzteblatt International. 2014; 111 (12): 205-211. PMCID: PMC3983698. http://dx.doi.оrg/ DOI: 10.3238/arztebl.2014.0205
- Neragi-Miandoab S., Kim J., Vlahakes G.J. Malignant tumours of the heart: a review of tumour type, diagnosis and therapy. Clinical Oncology (R Coll Radiol). 2007; 19(10): 748-56. PMID: 17693068. http://dx.doi.оrg/ DOI: 10.1016/j.don.2007.06.009
- Butany J., Nair V., Naseemuddin A., Nair G.M, Catton C., Yau T. Cardiac tumours: diagnosis and management. Lancet Oncol. 2005; 6(4): 219-228. PMID: 15811617. http://dx.doi.оrg/ DOI: 10.1016/S1470-2045(05)70093-0
- Малашенков А.И, Кавсадзе В.Э. Хирургия опухолей сердца. М.: Медицина, 2004. 94 с.
- Burke A., Virmani R„ Rosai J. Tumors metastatic to the heart and pericardium. In: Atlas of Tumor Pathology. Washington: DC Armed Forces Institute of Pathology; 1996. pp. 195-209.
- Paraskevaidis I.A., Michalakeas C.A., Papadopoulos C.H., Nana MA. Cardiac Tumors. Int Sch Res Notices. 2011; 2011: 36-41. http://dx.dоi.оrg/ DOI: 10.2165/00129784-200303060-00004
- Кнышов Г.В., Витовский P.M., Захарова В.П. Опухоли сердца. Проблемы диагностики и хирургического лечения. Киев: Пресса Украины, 2005. 254 с.
- Blom J.W., Vanderschoot J.P., Oostindier M.J., Osanto S., van der Meer F.J., Rosendaal F.R. Incidence of venous thrombosis in a large cohort of 66,329 cancer patients: results of a record linkage study. J Thromb Haemost. 2006; 4(3): 529-35. PMID: 16460435. http://dx.doi.оrg/.x DOI: 10.1111/j.1538-7836.2006.01804
- Sarjeant J., Butany J., Cusimano R. Cancer of the heart. Epidemiology and management of primary tumors and metastasés. Am] Cardiovasc Drugs. 2003; 3(6): 407-421. PMID: 14728061. http://dx.doi.оrg/ DOI: 10.2165/00129784-200303060-00004


