Клинический случай многососудистого минимально инвазивного коронарного шунтирования в рамках гибридной полной реваскуляризации миокарда
Автор: Шабаев Ильмир Фанилевич, Козырин К.А., Тарасов Р.С.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Случаи из клинической практики
Статья в выпуске: 3S т.24, 2020 года.
Бесплатный доступ
Цель. Представить первый опыт выполнения минимально инвазивного многососудистого коронарного шунтирования (многососудистое аутоартериальное коронарное шунтирование без искусственного кровообращения через левостороннюю мини-торакотомию и чрескожное коронарное вмешательство ветви тупого края) в рамках гибридной реваскуляризации миокарда. Клинический случай. В НИИ КПССЗ впервые выполнена полная реваскуляризация миокарда при многососудистом поражении с использованием минимально инвазивных техник на работающем сердце. Первым этапом выполнены бимаммарное шунтирование левой внутренней грудной артерии с передней нисходящей артерией in situ и Y-образный шунт «левая внутренняя грудная артерия - правая внутренняя грудная артерия с диагональной ветвью». В раннем послеоперационном периоде (через 2 ч после окончания операции) своевременно диагностирована дисфункция шунта с диагональной ветвью в виде субтотального стеноза анастомоза правой внутренней грудной артерии с левой внутренней грудной артерией. Через 3,5 ч после вмешательства выполнена реоперация с перекладыванием анастомоза и удовлетворительными показателями флоуметрии. Острый инфаркт миокарда не развился. Через 24 ч выполнен второй этап гибридной процедуры - контрольная коронарошунтография и стентирование ветви тупого края. На 8-е сут. пациент выписан на амбулаторный этап долечивания и реабилитации. Гибридная реваскуляризация объединяет преимущества коронарного шунтирования и чрескожного коронарного вмешательства, но ее ограничением является техническая сложность. В представленном клиническом случае показано развитие неблагоприятных событий на этапе обучения хирурга выполнению нестандартной технологии. Своевременная диагностика и реоперация не привели к осложнениям и увеличению реабилитации пациента. Заключение. Гибридная реваскуляризация в виде малоинвазивного коронарного шунтирования на работающем сердце и чрескожного коронарного вмешательства со стентированием с использованием стентов с лекарственным покрытием новых генераций потенциально может представлять достойную конкуренцию традиционному многососудистому аортокоронарному шунтированию, превосходя его малой инвазивностью при полном объеме реваскуляризации.
Гибридная реваскуляризация, клинический случай, коронарное шунтирование на работающем сердце, минимально инвазивное коронарное шунтирование
Короткий адрес: https://sciup.org/142230752
IDR: 142230752 | DOI: 10.21688/1681-3472-2020-3S-108-118
Текст научной статьи Клинический случай многососудистого минимально инвазивного коронарного шунтирования в рамках гибридной полной реваскуляризации миокарда
Шабаев И.Ф., Козырин К.А., Тарасов Р.С. Клинический случай многососудистого минимально инвазивного коронарного шунтирования в рамках гибридной полной реваскуляризации миокарда. Патология кровообращения и кардиохирургия. 2020;24(3S):108-118.
Рис. 1. Доступ при многососудистом аутоартериальном коронарном шунтировании без искусственного кровообращения через левостороннюю мини-торакотомию (Режим доступа:
Ишемическая болезнь сердца (ИБС) является главной причиной снижения трудоспособности и роста смертности населения как в России, так и мире. Хирургическая реваскуляризация миокарда повышает качество жизни, снижает смертность и улучшает показатели отдаленной выживаемости [1].
Существуют различные хирургические опции лечения таких пациентов: аортокоронарное шунтирование (АКШ) как в условиях искусственного кровообращения, так и без него и чрескожное коронарное вмешательство (ЧКВ). Каждый из методов обладает преимуществами и недостатками, а выбор оптимальных методов лечения пациентов с ИБС находится в центре горячих споров и не имеет окончательного решения. По данным нескольких рандомизированных и множества ретроспективных клинических исследований изучены результаты соотношения риска и пользы двух техник: ЧКВ и АКШ при многососудистом поражении коронарных артерий (КА) [1–6]. Так, ЧКВ, бесспорно, обладает малой инвазивностью, ранним послеоперационным восстановлением, кос-метичностью доступа, однако негативным аспектом является более частая, чем при АКШ, повторная реваскуляризация миокарда, связанная с рестенозом и тромбозом стентов. Аортокоронарное шунтирование в условиях искусственного кровообращения, по сравнению с ЧКВ, ассоциируется с высокой кровопотерей, более высоким риском неблагоприятных церебральных событий и раневых осложнений, но превосходит ЧКВ по достижению полной реваскуляризации и характеризуется более длительной свободой от повторной реваскуляризации [7–11].
Со стремлением к снизить травматичность АКШ, улучшить качество жизни и объединить в одной технике преимущества как открытой, так и рентгенэн-доваскулярной хирургии разработаны гибридные методики реваскуляризации миокарда с использованием минимально инвазивного доступа при многососудистом поражении коронарных артерий. К таким методикам относится и MICS-CABG (англ. Minimally Invasive Multivessel Coronary Artery Bypass Grafting — многососудистое аутоартериальное коронарное шунтирование без искусственного кровообращения через левостороннюю мини-торакотомию). На рис. 1 представлена данная технология.
Исследования показали, что многососудистое аутоартериальное коронарное шунтирование без искусственного кровообращения через левостороннюю мини-торакотомию так же эффективно, как и АКШ через стернотомию [12–15]. При многососудистом аутоартериальном коронарном шунтировании без искусственного кровообращения через левостороннюю мини-торакотомию полная реваскуляризация миокарда достигается более чем в 95 % случаев, поскольку методика позволяет получить доступ к передней, боковой и нижней стенкам сердца с механической поддержкой функции сердца или без нее [12]. Полнота процедуры определялась реваскуляризацией всех эпикардиальных КА с диа-
Рис. 2. Ангиограмма левой коронарной артерии (стрелками указаны стенозы)
Примечание.
ПНА — передняя нисходящая артерия;
ДВ — диагональная ветвь; ВТК — ветвь тупого края.
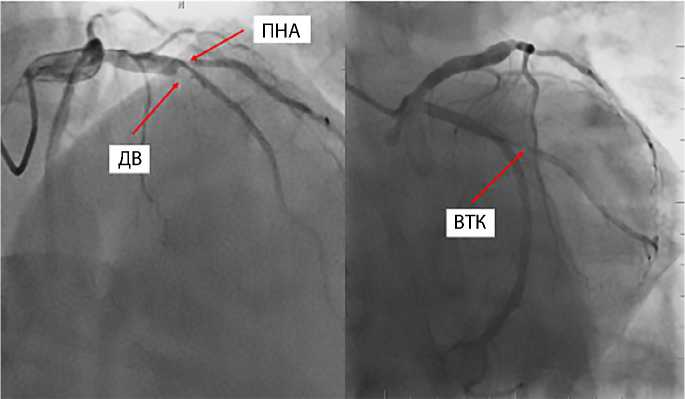
метром ≥ 1,5 мм и стенозами по диаметру более 50 % как минимум в одной ангиографической проекции и/или реваскуляризацией в системе передней нисходящей и огибающей артериям при изолированном поражении ствола левой коронарной артерии.
Цель данной работы — представление и обсуждение первого опыта многососудистого аутоартериального коронарного шунтирования без искусственного кровообращения через левостороннюю мини-торакотомию в сочетании с ЧКВ в рамках гибридной малоинвазивной стратегии лечения пациента.
Клинический случай
В отделение кардиохирургии НИИ КПССЗ поступил пациент В. (55 лет) для планового оперативного вмешательства. Диагноз на момент поступления: ишемическая болезнь сердца. Стенокардия II функционального класса. Хроническая сердечная недостаточность I ст., II функционального класса. Гипер- тоническая болезнь III ст., риск 4. Дислипидемия. Церебральный атеросклероз. Стеноз внутренней сонной артерии слева гемодинамически не значимый 30 %.
Сопутствующий: хроническая обструктивная болезнь легких, вне обострения. Дыхательная недостаточность 0–I ст. Скользящая грыжа пищеводного отверстия диафрагмы. Недостаточность кардии 3 ст. Поверхностный гастрит. Дуодено-гастральный рефлюкс. Вторичный дуоденит.
Общее состояние пациента относительно удовлетворительное. По данным коронароангиографии при сбалансированном типе коронарного кровотока выявлено многососудистое поражение КА с гемодинамически значимым поражением передней нисходящей и диагональной артерий, первой ветви тупого края. Результаты стенозов и ангиограммы с визуализацией стенотических поражений КА представлены в табл. 1 и на рис. 2.
Табл. 1. Результаты коронарографии
|
Локализация Передняя нисходящая артерия |
Сегмент Стеноз, % Длина, мм Диаметр после вмешательства, мм Проксимальный 30 Средний 90 12 2,75 |
|
Первая диагональная ветвь Огибающая артерия Первая ветвь тупого края Правая коронарная артерия |
Устье 90 2,0 Проксимальный 85 18 3,5 Устье 99 Проксимальный 60 20 2,5 |
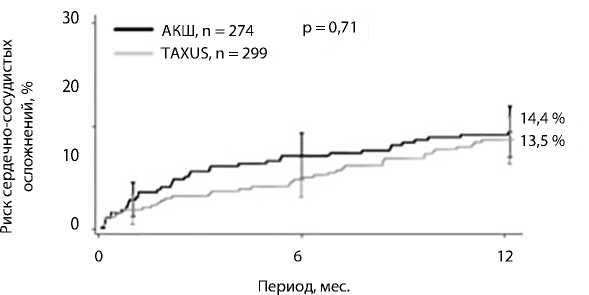
Рис. 3. Риск сердечно-сосудистых осложнений при чрескожном коронарном вмешательстве (TAXUS) и аортокоронарного шунтирования (АКШ) у пациентов со значением индекса SYNTAX Score от 0 до 22 баллов
Правая КА имела пограничный стеноз при сбалансированном типе КА и не требовала хирургической коррекции.
Тяжесть коронарного поражения оценивалась по шкале SINTAX Score и составила 13 баллов, что соответствует легкой тяжести коронарного атеросклероза. На рис. 3 отражен риск сердечно-сосудистых осложнений у пациентов с поражениями такого типа при ЧКВ и аортокоронарном шунтировании.
Предоперационная характеристика пациента представлена ниже.
SYNTAX Score, баллов13
EuroSCORE II, %0,6
Скорость клубочковой фильтрации90
(по Кокрофту – Голту), мл/мин
Фракция выброса левого желудочка, %68
Стеноз внутренней сонной артерии слева, %30
Оценка риска неблагоприятного исхода КШ помимо шкалы SYNTAX Score проводилась по шкале EuroSCORE II и составила 0,6 %, что относится к низкому риску. Сократительная способность миокарда левого желудочка соответствовала нормальным значениям. Почечная функция также была в норме. Имел место гемодинамически незначимый стеноз внутренней сонной артерии, не требовавший коррекции. Заслуживала внимания хроническая обструктивная болезнь легких в анамнезе.
С учетом периоперационной характеристики пациента и европейских клинических рекомендаций данному пациенту в равной степени можно было выполнить реваскуляризацию с помощью ЧКВ и КШ (класс рекомендаций и уровень доказанности IA). Однако пациент имел риск послеоперационного диастаза грудины из-за усугубления обструктивной болезни легких, а также неблагоприятную анатомию устьевого поражения и кальциноза КА, препятствующих адекватному выполнению стентирования. Мультидисциплинарная команда определила тактику гибридной реваскуляризации миокарда — многососудистое аутоартериальное коронарное шунтирование без искусственного кровообращения через левостороннюю мини-торакотомию с использованием бимаммарного КШ с передней нисходящей артерией и диагональной ветвью на работающем сердце, а также ЧКВ со стентированием первой ветви тупого края в плановом порядке. Нужно отметить, что данная технология в НИИ КПССЗ применялась впервые.
25.03.2020 г. выполнен первый этап операции — бимаммарное КШ с передней нисходящей артерией и диагональной ветвью на работающем сердце из мини-доступа (рис. 4).
В условиях однолегочной вентиляции проведена мини-торакотомия в 5-м межреберье лате-ральнее среднеключичной линии протяженностью 10 см. С использованием эндоскопической видеоассистенции и малоинвазивного ретрактора грудной клетки ThoraTrak MICS Retractor System (Medtronic, США) методом скелетезирования выделена ЛВГА диаметром 3 мм на протяжении от устья до бифуркации на мышечно-диафрагмальную и поверхностную эпигастральную. Визуальный поток из ЛВГА удовлетворительный. Следом из этого доступа по аналогичной методике выделена ПВГА
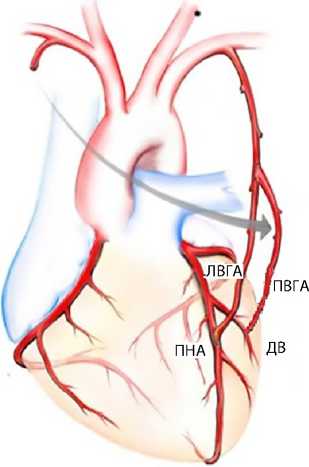
Рис. 4. Бимаммарное коронарное шунтирование [16, статья открытого доступа, распространяется по лицензии Creative Commons Attribution 4.0 .]
Примечание. ПНА — передняя нисходящая артерия;
ДВ — диагональная ветвь; ЛВГА — левая внутригрудная артерия; ПВГА — правая внутригрудная артерия.
диаметром 3 мм. Перикардиотомия, передняя нисходящая артерия в зоне отхождения ДВ диаметром 2 мм, ДВ диаметром 1,75 мм. Правая вну-тригрудная артерия клипирована проксимально, сформирован искусственный Y-образный кондуит с ЛВГА конец-в-бок непрерывным обвивным швом с использованием шовного материала пролен 8/0, игла 6,5 мм, 3/8. Визуальный поток по обоим коленам удовлетворительный. При помощи малоинвазивной системы стабилизации и позиционирования Octopus Nuvo Tissue Stabilizer (Medtronic, США) производилась фиксация эпикарда над передней нисходящей артерией. Произведена продольная артериотомия, установлен интракоронарный шунт 2,0 (18 мин). Сформирован анастомоз ЛВГА и передней нисходящей артерии по аналогичной методу. Пуск кровотока по ВГА. Далее, фиксация эпикарда над ДВ по аналогичной технике. Продольная артериотомия, установка интракоронарного шунта 1,75 (16 мин). Сформирован анастомоз ПВГА и диагональной ветви. Пуск кровотока по шунту. Флоуме-трия каждого шунта ЛВГА с передней нисходящей артерией, ПВГА с диагональной ветвью. Для описа- ния кровотока использованы параметры: средняя объемная скорость кровотока, которая должна быть не менее 15 мл/мин. Индекс пульсации, не превышающий 5. Диастолическое наполнение шунта не оценено. Флуометрия проведена после инактивации гепарина протамина сульфатом при стабильных параметрах гемодинамики, систолическое артериальное давление не ниже 100 мм рт. ст., частота сердечных сокращений 80–100 уд/мин, удовлетворительная. Ишемических явлений за время операции не было. Гемостаз. Активный дренаж в левую плевральную полость. Счет материалов и инструментов правильный. Послойные швы на рану. Асептическая повязка. Интраоперационные характеристики бимаммарного КШ представлены ниже.
Интракоронарный шунт, мин34
Флоуметрия левой внутригрудной артерии 50 с передней нисходящей артерией, мл/мин
Индекс пульсации2,3
Флоуметрия правой внутригрудной артерии 40 с диагональной ветвью, мл/мин
Индекс пульсации1,7
Кровопотеря, мл300
Агрегатограмманорма
Длительность операции, мин325
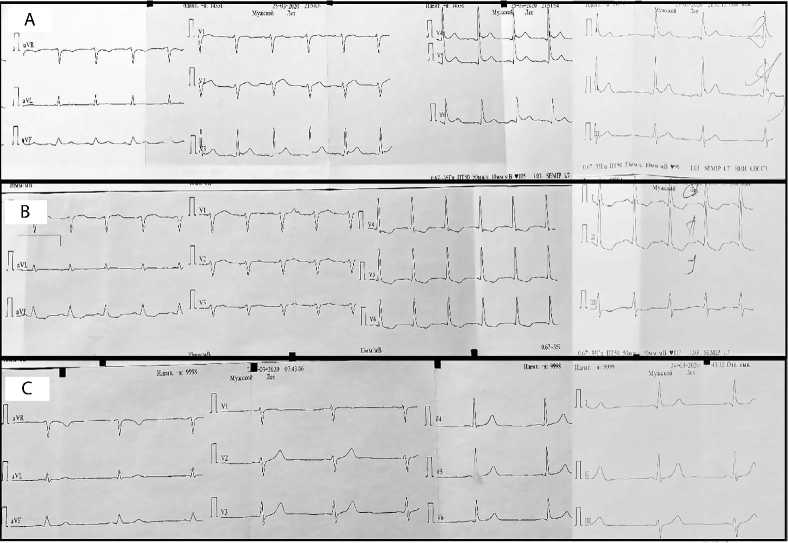
Длительность интракоронарного шунта составила 34 мин. Избыточной кровопотери не отмечено, несмотря на отсутствие отмены перед операцией ацетилсалициловой кислоты. Однако через 2 ч после окончания операции при наблюдении за пациентом в отделении реанимации зарегисти-рованы изменения по электрокардиографии (ЭКГ) в виде косонисходящей депрессии сегмента ST в стандартных и грудных отведениях. Субэндокардиальная ишемия задне-нижней стенки, верхушки, передне-боковой стенки левого желудочка (рис. 5). Лабораторно увеличение кардиомаркеров: повышение тропонина Т до 0,31 нг/мл (при референсных значениях до 0,10 нг/мл). Коагулограмма в норме (табл. 2).
Пациент имел стабильную гемодинамику без потребности в кардиотонической поддержке. По данным эхокардиографии снижение сократительной способности миокарда и появление новых
Рис. 5. Исходная электрокардиография (А);
ишемические изменения после операции (B);
нормализация реполяризации миокарда после реоперации (C)
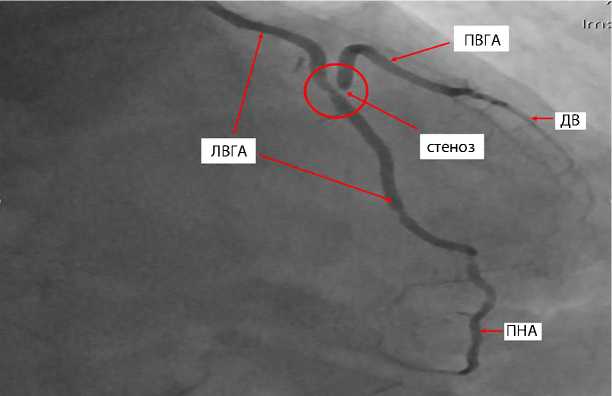
очагов с нарушенной локальной сократимостью не отмечены. Тем не менее с учетом ЭКГ и пограничного уровеня кардиоспецифических ферментов, с целью диагностики ранней дисфункции шунтов выполнена коронарошунтография. Нативные КА без отрицательной динамики, но выявлен стеноз шунта ПВГА – диагональная ветвь на 99 % в зоне Y-образного анастомоза ПВГА с левой внутригрудной артерией. Спазм шунта исключен путем селективного введения вазодилататора (нитроглицерин 100 мкг). На рис. 6 представлена коронарошунтография с дисфункцией шунта. Возможной причиной стеноза анастомоза левой внутригрудной артерии с ПВГА являлся перегиб или перекрут шунта вследствие изменения конфигурации после закрытия доступа и перехода на двулегочную искусственную вентиляцию легких.
Через 3,5 ч после первичной операции и через 1,5 ч после выявления ишемических изменений на ЭКГ экстренно выполнена повторная операция с целью ревизии анастомоза. Y-кондуит левая внутригрудная артерия – правая внутригрудная артерия без макроскопических особенностей. Проведена флуометрия проблемного анастомоза: выявлен низкий поток, индекс пульсации > 6, что означало наличие технических проблем с анастомозом. Принято решение о коррекции анастомоза. В результате скорость потока по флоуметрии возросла до 50 мл/мин, индекс пульсации снизился до 2. Длительность повторной операции составила 75
Табл. 2. Коагулограмма
|
Показатель |
Значение |
Референсное значение |
|
Международное нормализованное отношение |
1,10 |
0,85–1,25 |
|
Протромбиновый индекс, % |
82,7 |
70–130 |
|
Протромбиновое время, с |
13,8 |
14–16 |
|
Фибриноген, г/л |
2,5 |
2–4 |
|
Активированное частичное тромбопластиновое время, с |
30,9 |
26–36 |
Рис. 6. Шунтография: субтотальный стеноз анастомоза правой внутригруд-ной артерии с левой внутригрудной артерией обведен кругом
Примечание. ПНА — передняя нисходящая артерия; ДВ — диагональная ветвь; ЛВГА — левая внутригрудная артерия; ПВГА — правая внутригруд-ная артерия.
мин, кровопотеря не превысила 100 мл, показатели системной красной крови в нормальных значениях, максимальные значения тропонина Т 0,51 нг/мл. По данным ЭКГ отмечено купирование ишемии на основании совокупных клинических данных, указаний на течение острого инфаркта миокарда нет.
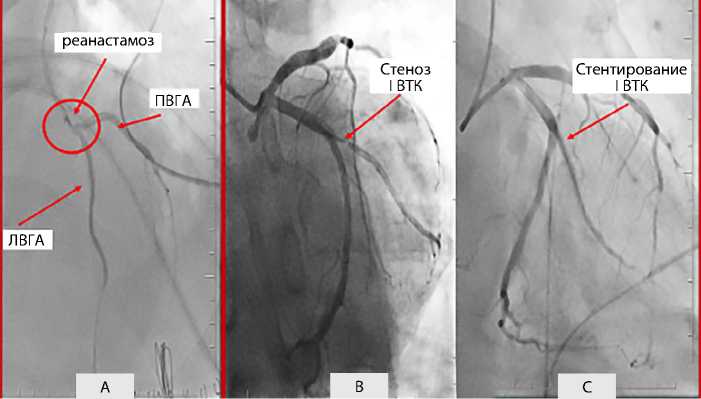
Через 24 ч выполнена контрольная шунтография и второй этап гибридной полной реваскуляризации миокарда (ЧКВ со стентированием первой ветви тупого края) с предварительным назначением нагрузочной дозы клопидогрела 600 мг. На рис. 7 представлены контрольная шунтография и стентирование первой ветви тупого края.
По результатам коронарошунтографии: зона повторной реконструкции анастомоза без особенностей, компрометации коронарного кровотока нет, шунты полностью функционировали. Следом выполнено успешное стентирование первой ветви тупого края двумя стентами Xience Prime (Abbott Vascular, США) нового поколения с лекарственным покрытием диметром 2,5 мм. Вмешательство прошло без особенностей. Осуществлен перевод пациента из отделения реанимации и интенсивной терапии в палату общего профиля.
Суммарно потери по дренажу составили 350 мл: в 1-е сут. 150 мл геморрагического характе-
Рис. 7. Контрольная шунтография: зона повторного наложения анастомоза обведена кругом (А); стеноз первой ветви тупого края (B); стентирование первой ветви тупого края (C) Примечание. I ВТК — первая ветвь тупого края; ЛВГА — левая внутригруд-ная артерия; ПВГА — правая внутригрудная артерия.
ра и 200 мл на 2-е сут., но с серозным компонентом на фоне антитромбоцитарной терапии. Клопидо-грел не повлиял значимо на темп отделяемого, а последующие 200 мл дренажных потерь серозного характера можно было объяснить экссудацией плевральной полости на дренаж.
На 5-е сут. произведен контроль лабораторных и инструментальных методов обследований. Сократительная способность миокарда левого желудочка возросла до 65 %. Жидкости в полости перикарда и плевральных полостях нет. Ритм синусовый, сегмент ST на изолинии. Патологических изменений со стороны легких нет. Интенсивность боли по визуально-аналоговой шкале равна 2, что соответствует слабой боли. Лабораторные показатели в пределах нормальных значений. На 8-е послеоперационные сутки после удаления швов больной выписан на амбулаторный этап с рекомендациями наблюдения кардиологом поликлиники. Также отслеживалось состояние пациента в отдаленном периоде наблюдения (через 60 дней) по телефону: общее состояние удовлетворительное, не отмечал возврат стенокардии и ограничения физической нагрузки.
Обсуждение
Главным преимуществом гибридной технологии является сочетание преимуществ двух методов реваскуляризации (АКШ и ЧКВ) с достижением полной реваскуляризации миокарда. Однако возможным ограничением является техническая сложность хирургического этапа при применении нестандартных техник, что показано в представленном случае. Опрос, проведенный в европейских клиниках в 2002 г., показал, что всего 10 % кардиохирургов имеют опыт и способны выполнить хирургический этап — многососудистое аутоартериальное коронарное шунтирование без искусственного кровообращения через левостороннюю мини-торакотомию [17]. Конечно, для облегчения освоения и рутинного применения малоинвазивного КШ разработано множество устройств и ассистентов хирурга. Наиболее высокотехнологичным методом малоинвазивной реваскуляризации миокарда является робот-ассистированное полностью эндоскопическое коронарное шунтирование (англ. Total Endoscopic Coronary Artery Bypass,
TECAB). Несмотря на очевидные достоинства и технологичность, этот метод не применятся широко в кардиохирургической практике в первую очередь из-за высокой стоимости [18]. В подробном обзоре этапов развития техник КШ отечественные авторы пришли к заключению, что с использованием достаточно современных систем и ассистентов для малоинвазивной коронарной хирургии существенным ограничением является техническая сложность процедуры при множественном поражении коронарных артерий. Однако в процессе разработки и внедрения малоинвазивной технологии отмечены улучшение качества процедуры и минимизация осложнений [19]. Ключевой является кривая обучения, в процессе которого могут быть технические ошибки, которые иногда сложно верифицировать во время вмешательства, даже с использованием интраоперационных методов оценки качества функции шунтов [20]. В этой связи особое значение приобретает мониторинг возможной ишемии миокарда при помощи стандартных клинических методов: ЭКГ, динамика кардиоспеци-фических ферментов, эхокардиография с оценкой глобальной и локальной сократительной способности миокарда [21].
В представленном клиническом случае ранняя послеоперационная диагностика дисфункции анастомоза оказалась своевременной, что позволило выполнить реоперацию в кратчайший срок (через 3,5 ч после первичной операции и через 1,5 ч после выявления признаков ишемии миокарда на ЭКГ). Выявление признаков ишемии миокарда при коронарошунтографии позволило своевременно предположить дисфункцию шунта, что актуально в случае нестандартных техник АКШ на этапе освоения. Комплекс диагностических и лечебных мероприятий позволил своевременно выполнить реоперацию и избежать развития острого инфаркта миокарда. Кроме этого, использованный алгоритм действий не привел к увеличению срока пребывания в отделении реанимации и стационаре, несмотря на нестандартное течение послеоперационного периода при использовании сложной техники аортокоронарного шунтирования.
Другой важной особенностью представленного клинического случая являлось применение не просто нестандартной малоинвазивной техники
АКШ — многососудистого аутоартериального коронарного шунтирования без искусственного кровообращения через левостороннюю мини-торакотомию в объеме бимаммарного КШ, — а сочетание данного вида операции с чрескожным коронарным вмешательством. Это позволило выполнить полную реваскуляризацию миокарда при использовании двух минимально инвазивных техник. Выполнение многососудистого аутоартериального коронарного шунтирования без искусственного кровообращения через левостороннюю мини-торакотомию первым и ЧКВ вторым этапами позволило нивелировать периоперационные геморрагические риски, связанные с назначением двойной антитромбо-цитарной терапии, которая была назначена после открытой операции, но перед ЧКВ, что соотносится с результатами ранее опубликованных исследований [22].
Таким образом, на данном клиническом примере продемонстрировано успешное применение нестандартной гибридной технологии полной реваскуляризации миокарда с использованием в качестве первого этапа многососудистого аутоартериального коронарного шунтирования без искусственного кровообращения через левостороннюю мини-торакотомию в виде бимаммарного КШ и ЧКВ со стентированием с применением стентов с лекарственным покрытием современных генераций. Ключевым аспектом, позволившим успешно реализовать первый опыт сложной операции, стало выявление ишемии миокарда в раннем послеоперационном периоде и активная инвазивная тактика с выполнением коро-нарошунтографии и реоперации.
Заключение
Гибридная реваскуляризация в виде многососудистого аутоартериального коронарного шунтирования без искусственного кровообращения через левостороннюю мини-торакотомию (бимам-марное КШ) и ЧКВ со стентированием с использованием стентов с лекарственным покрытием новых генераций является потенциально возможной альтернативой традиционному многососудистому АКШ, превосходя его малой инвазивностью. С учетом технической сложности и кривой обучения существует риск осложнений, в связи с чем важны настороженность кардиокоманды и качественная своевременная диагностика дисфункции шунта с выполнением реоперации в кратчайший срок.
Список литературы Клинический случай многососудистого минимально инвазивного коронарного шунтирования в рамках гибридной полной реваскуляризации миокарда
- Authors/Task Force members, Windecker S., Kolh P., Alfonso F., Collet J.-P., Cremer J., Falk V., Filippatos G., Hamm C., Head SJ., Jüni P., Kappetein A.P., Kastrati A., Knuuti J., Landmesser U., Laufer G., Neumann F.-J., Richter D.J., Schauerte P., Uva M.S., Stefanini G.G., Taggart D.P., Torracca L., Valgimigli M., Wijns W., Witkowski A. 2014 ESC/EACTS Guidelines on myocardial revascularization: The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS) Developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI). Eur Heart J. 2014;35(37):2541-2619. PMID: 25173339. https://doi.org/10.1093/eurheartj/ehu278
- Makikallio T., Holm N.R., Lindsay M., Spence M.S., Erglis A., Menown I.B.A., Trovik T., Eskola M., Romppanen H., Kellerth T., Ravkilde J., Jensen L.O., Kalinauskas G., Linder R.B.A., Pentikainen M., Hervold A., Banning A., Zaman A., Cotton J., Eriksen E., Margus S., Sorensen H.T., Nielsen P.H., Niemelä M., Kervinen K., Lassen J.F., Maeng M., Oldroyd K., Berg G., Walsh SJ., Hanratty C.G., Kumsars I., Stradins P., Steigen T.K., Fröbert O., Graham A.N.J., Endresen P.C., Corbascio M., Kajander O., Trivedi U., Hartikainen J., Anttila V., Hildick-Smith D., Thuesen L., Christiansen E.H., NOBLE study investigators. Percutaneous coronary angioplasty versus coronary artery bypass grafting in treatment of unprotected left main stenosis (NOBLE): a prospective, randomised, open-label, non-inferiority trial. Lancet. 2016;388(10061):2743-2752. PMID: 27810312. https:// doi.org/10.1016/S0140-6736(16)32052-9
- Stone G.W., Sabik J.F., Serruys P.W., Simonton C.A., Généreux P., Puskas J., Kandzari D.E., Morice M.-C., Lembo N., Brown W.M. 3rd, Taggart D.P., Banning A., Merkely B., Horkay F., Boonstra P.W., van Boven A.J., Ungi I., Bogats G., Mansour S., Noiseux N., Sabaté M., Pomar J., Hickey M., Gershlick A., Buszman P., Bochenek A., Schampaert E., Pagé P., Dressler O., Kosmidou I., Mehran R., Pocock S.J., Kappetein A.P., EXCEL Trial Investigators. Everolimus-eluting stents or bypass surgery for left main coronary artery disease. N Engl J Med. 2016;375(23):2223-2235. PMID: 27797291. https://doi.org/10.1056/NEJMoa1610227
- Buszman P.E., Buszman P.P., Banasiewicz-Szkrobka I., Milewski K.P., Zurakowski A., Orlik B., Konkolewska M., Trela B., Janas A., Martin J.L., Kiesz R.S., Bochenek A. Left Main stenting in comparison with surgical revascularization: 10-year outcomes of the (Left Main Coronary Artery Stenting) LE MANS Trial. JACC Cardiovasc Interv. 2016;9(4):318-327. PMID: 26892080. https://doi.org/10.1016/j.jcin.2015.10.044
- Ahn J.-M., Roh J.-H., Kim Y.-H., Park D.-W., Yun S.-C., Lee P.H., Chang M., Park H.W., Lee S.-W., Lee C.W., Park S.-W., Choo S.J., Chung C.H., Lee J.W., Lim D.-S., Rha S.-W., Lee S.-G., Gwon H.-C., Kim H.-S., Chae I.-H., Jang Y., Jeong M.-H., Tahk S.-J., Seung K.B., Park S.-J. Randomized trial of stents versus bypass surgery for left main coronary artery disease: 5-year outcomes of the PRECOMBAT Study. J Am Coll Cardiol. 2015;65(20):2198-2206. PMID: 25787197. https://doi.org/10.1016/j.jacc.2015.03.033
- Morice M.-C., Serruys P.W., Kappetein A.P., FeldmanT.E., Stahle E., Colombo A., Mack M.J., Holmes D.R., Choi J.W., Ruzyllo W., Religa G., Huang J., Roy K., Dawkins K.D., Mohr F. Five-year outcomes in patients with left main disease treated with either percutaneous coronary intervention or coronary artery bypass grafting in the synergy between percutaneous coronary intervention with TAXUS and cardiac surgery trial. Circulation. 2014;129(23):2388-2394. PMID: 24700706. https://doi.org/10.1161/CIRCULATIONAHA.113.006689
- Putzu A., Gallo M., Martino E.A., Ferrari E., Pedrazzini G., Moccetti T., Cassina T. Coronary artery bypass graft surgery versus percutaneous coronary intervention with drug-eluting stents for left main coronary artery disease: A metaanalysis of randomized trials. Int J Cardiol. 2017;241:142-148. PMID: 28438354. https://doi.org/10.1016/Uicard.2017.04.015
- De Rosa S., Polimeni A., Sabatino J., Indolfi C. Long-term outcomes of coronary artery bypass grafting versus stent-PCI for unprotected left main disease: A meta-analysis. BMC Cardiovasc Disord. 2017;17(1):240. PMID: 28877676, PMCID: PMC5588710. https://doi.org/10.1186/s12872-017-0664-5
- Garg A., Rao S.V., Agrawal S., Theodoropoulos K., Mennuni M., Sharma A., Garg L., Ferrante G., Meelu O.A., Sargsyan D., Reimers B., Cohen M., Kostis J.B., Stefanini G.G. Meta-Analysis of randomized controlled trials of percutaneous coronary intervention with drug-eluting stents versus coronary artery bypass grafting in left main coronary artery disease. Am J Cardiol. 2017;119(12):1942-1948. PMID: 28433215. https:// doi.org/10.1016/i.amicard.2017.03.019
- Lee C.W., Ahn J.-M., Cavalcante R., Sotomi Y., Onuma Y., Suwannasom P.,Tenekecioglu E.,Yun S.-C., Park D.-W., Kang S.-J., Lee S.-W., Kim Y.-H., Park S.-W., Serruys P.W., Park S.-J. Coronary artery bypass surgery versus drug-eluting stent implantation for left main or multivessel coronary artery disease: A meta-analysis of individual patient data. JACC Cardiovasc Interv. 2016;9(24):2481-2489. PMID: 28007199. https://doi. org/10.1016/i.icin.2016.10.008
- Nerlekar N., Ha F.J., Verma K.P., Bennett M.R., Cameron J.D., Meredith I.T., Brown A.J. Percutaneous coronary intervention using drug-eluting stents versus coronary artery bypass grafting for unprotected left main coronary artery stenosis: A meta-analysis of randomized trials. Circ Cardiovasc Interv. 2016;9(12):e004729. PMID: 27899408. https://doi. org/10.1161/CIRCINTERVENTI0NS.116.004729
- McGinn J.T. Jr, Usman S., Lapierre H., Pothula V.R., Mesana T.G., Ruel M. Minimally invasive coronary artery bypass grafting: dual-center experience in 450 consecutive patients. Circulation. 2009;120(11 Suppl):S78-S84. PMID: 19752390. https://doi.org/10.1161/CIRCULATI0NAHA.108.840041
- Hoff S.J., Ball S.K., Leacche M., Solenkova N., Umakanthan R., Petracek M.R., Ahmad R., Greelish J.P., Walker K., Byrne J.G. Results of completion arteriography after minimally invasive off-pump coronary artery bypass. Ann Thorac Surg. 2011;91(1):31-36. PMID: 21172481. https://doi.org/10.1016/i. athoracsur.2010.09.057
- Chan V., Lapierre H., Sohmer B., Mesana T.G., Ruel M. Handsewn proximal anastomoses onto the ascending aorta through a small left thoracotomy during minimally invasive multivessel coronary artery bypass grafting: a stepwise approach to safety and reproducibility. Semin Thorac Cardiovasc Surg. 2012;24(1):79-83. PMID: 22643668. https://doi.org/10.1053/!. semtcvs.2011.12.010
- Mack M., Acuff T., Yong P., Jett G.K., Carter D. Minimally invasive thoracoscopically assisted coronary artery bypass surgery. Eur J Cardiothorac Surg. 1997;12(1 ):20-24. PMID: 9262076. https://doi.org/10.1016/s1010-7940(97)00141-3
- Raja S.G. Total arterial coronary grafting: outcomes, concerns and controversies. Vessel Plus. 2019;(3):23. http://dx.doi. org/10.20517/2574-1209.2019.05
- D'Ancona G., Vassiliades T.A., Boyd W.D., Donias H.W., Stahl K.D., Karamanoukian H. Is hybrid coronary revascularization favored by cardiologists or cardiac surgeons? Heart Surg Forum. 2002;5(4):393-395. PMID: 12538124
- Жбанов И.В., Киладзе И.З., Урюжников В.В., Шабалкин Б.В. Миниинвазивная коронарная хирургия. Кардиология и сердечно-сосудистая хирургия. 2019;12(5):377-385. [Zhbanov I.V., Kiladze I.Z., Uryuzhnikov V.V., Shabalkin B.V. Minimally invasive coronary artery bypass surgery. Russian Journal of Cardiology and Cardiovascular Surgery = Kardiologiya i serdechno-sosudistaya khirurgiya. 2019;12(5):377-385. (In Russ.)] http://dx.doi.org/10.17116/kardio201912051377
- Зеньков А.А., Островский Ю.П., Выхристенко К.С., Лойко Н.Г. Сравнительный анализ результатов миниинвазивной реваскуляризации миокарда, коронарного шунтирования на работающем сердце и с искусственным кровообращением. Новости хирургии. 2014;22(1):33-43. [Ziankou A.A., Ostrovskij U.P., Vuhristenko K.S., Lojko N.G. Comparative analysis of the results of minimally invasive myocardial revascularization and coronary artery bypass grafting on the beating heart and with artificial blood circulation. Novosti Khirurgii. 2014;22(1):33-43. (In Russ.)] http://dx.doi. org/10.18484/2305-0047.2014.1.33
- Holzhey D.M., Jacobs S., Walther T., Mochalski M., Mohr F.W., Falk V. Cumulative sum failure analysis for eight surgeons performing minimally invasive direct coronary artery bypass. J Thorac Cardiovasc Surg. 2007;134(3):663-669. PMID: 17723815. https://doi.org/10.1016/Utcvs.2007.03.029
- Thygesen K., Alpert J.S., Jaffe A.S., Chaitman B.R., Bax J.J., Morrow D.A., White H.D., Executive Group on behalf of the Joint European Society of Cardiology (ESC)/American College of Cardiology (ACC)/American Heart Association (AHA)/World Heart Federation (WHF) Task Force for the Universal Definition of Myocardial Infarction. Fourth Universal Definition of Myocardial Infarction (2018). J Am Coll Cardiol. 2018;72(18):2231-2264. PMID: 30153967. https://doi. org/10.1016/j.jacc.2018.08.1038
- Шилов А.А., Кочергин Н.А., Ганюков В.И., Козырин К.А., Барбараш Л.С. Гибридная стратегия реваскуляризации миокарда в сравнении с аортокоронарным шунтированием у пациентов с многососудистым поражением коронарного русла при стабильной ишемической болезни сердца, тридцатидневные результаты. Комплексные проблемы сердечно-сосудистых заболеваний. 2016;5(3):16-20. [Shilov A.A., Kochergin N.A., Ganyukov V.I., Kozyrin K.A., Barbarash L.S. Hybrid strategy of revascularization compared with coronary artery bypass grafting in patients with multivessel coronary disease with stable coronary artery disease, thirty results. Complex Issues of Cardiovascular Diseases. 2016;5(3):16-20. (In Russ.)] https://doi.org/10.17802/2306-1278-2016-3-16-20


