Клинический случай повторного применения PARP-ингибиторов у больной с MBRCA-ассоциированным раком яичников
Автор: Виллерт А.Б., Коломиец Л.А., Фесик Е.А., Иванова А.А., Юнусова Н.В., Чуруксаева О.Н.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 4 т.21, 2022 года.
Бесплатный доступ
Актуальность. Серозная карцинома высокой степени злокачественности (Hg) - наиболее распространенный подтип рака яичника. Частота герминальных мутаций BRCA1,2 наибольшая при Hg серозном раке яичников. Пациентки с герминальными мутациями генов BRCA более склонны реагировать на химиотерапию на основе платины. Клинические исследования демонстрируют эффективность paRp-ингибиторов в лечении BRCA -ассоциированного рака яичника. Повторное назначение курсов поддерживающей терапии paRp-ингибиторами после ответа на химиотерапию на основе препаратов платины демонстрирует увеличение выживаемости без прогрессирования независимо от BRCA -статуса и является актуальным для изучения с точки зрения понимания развития молекулярных механизмов резистентности к препаратам платины и ингибиторам paRp, а также с позиций разработки новых методов преодоления резистентности. Описание клинического случая. Данное наблюдение BRCA -ассоциированного наследственного рака яичников демонстрирует эффективность и хорошую переносимость paRp-ингибитора в поддерживающем режиме после терапии первого рецидива на протяжении 37 мес, а также повторное назначение paRp-ингибиторов после лечения второго рецидива. Курс повторной терапии был непродолжительным и сопровождался развитием множественной лекарственной устойчивости. Общая выживаемость составила 112 мес. Заключение. Наличие мутаций генов BRCA1,2 является обоснованием для поддерживающей терапии paRp-ингибиторами, которые рассматриваются в качестве дополнительной опции поддерживающей терапии, улучшающей результаты лечения рака яичников. Повторное назначение paRp-ингибиторов при последующих рецидивах рака яичников рассматривается в качестве возможной терапевтической опции. Расшифровка молекулярных механизмов устойчивости к paRp-ингибиторам имеет значение для разработки новых методов преодоления химиорезистентности, повторного восстановления чувствительности опухоли к препаратам платины или paRp-ингибиторам.
Рак яичников, платиночувствительный рецидив, brca1, brca2, мутация, повторный курс терапии parp-ингибиторами
Короткий адрес: https://sciup.org/140295745
IDR: 140295745 | УДК: 618.11-006.6-08 | DOI: 10.21294/1814-4861-2022-21-4-156-164
Текст научной статьи Клинический случай повторного применения PARP-ингибиторов у больной с MBRCA-ассоциированным раком яичников
Рак яичников (РЯ) является 5-м по распространенности и 4-м по частоте причин смерти типом рака у женщин и наиболее летальным гинекологическим злокачественным новообразованием. Больше половины впервые выявленных больных умирают в течение первых двух лет. Даже при локализованных формах РЯ после комбинированного лечения 25–40 % пациенток погибают в дальнейшем от рецидивов заболевания [1]. Хотя последние данные свидетельствуют, что уровень заболеваемости РЯ начал снижаться с середины 1980-х гг., уменьшаясь с 2007–2016 гг. со скоростью 1,6 % в год, а смертность от РЯ начала снижаться с начала 2000-х гг., с 2008–2017 гг. со скоростью 2,3 % в год, перспектива значимо влиять на эти показатели пока невысокая. Это связано с тем, что программы скрининга при этой патологии не эффективны, подходы к лечению серьезно не изменились за текущие десятилетия. Основу лечения РЯ составляют первичная циторедуктивная операция с последующей химиотерапией комбинацией производных платины (цисплатин или карбоплатин) и таксанов. В то же время наметились пути улучшения результатов лечения этой категории больных, прежде всего, это касается наследственного РЯ.
Роль генетического фактора в этиологии РЯ имеет особую значимость. При наличии генетической предрасположенности предполагаемый риск развития РЯ для женщины в популяции составляет примерно 1 из 54. У женщин с родственницами, заболевшими РЯ или раком молочной железы первой степени родства, риск заболеть РЯ увеличивается более чем в 2 раза по сравнению с женщинами без семейного анамнеза. На синдром рака молочной железы и яичников (breast-ovarian cancer syndrom) приходится 90–95 % всех случаев наследственного рака, большинство из которых связано с мутациями генов BRCA1,2 . Частота мутаций в генах BRCA у больных РЯ на территории РФ варьирует в пределах от 4,1 до 25 %. Последние данные свидетельствуют, что частота BRCA1/2m в российской популяции достигает 28,4 % [2–6].
Средний возраст диагностики РЯ у пациенток с мутацией BRCA1 на 5–10 лет меньше, чем средний возраст диагностики у пациенток с BRCA дикого типа (wtBRCA) (хотя пациентки с BRCA2m не демонстрируют столь значимых различий возраста, по сравнению с wtBRCA) [6–8]. Показаны значительные различия в ответе на лечение и в выживаемости между популяциями больных РЯ mBRCA и wtBRCA, в т. ч. при одинаковом объеме операции [9, 10]. Есть данные однофакторного анализа, что для mBRCA больных РЯ поздняя стадия опухоли и субоптимальное удаление опухоли значимо связаны с уменьшением выживаемости. При многофакторном анализе только оптимальность первичной циторедуктивной операции имеет независимое прогностическое влияние на выживаемость. Показатели выживаемости для mBRCA пациенток при неоптимальной циторедукции аналогичны таковым у больных, отрицательных по мутациям, но с оптимально удаленной опухолью [9]. Данные исследований демонстрируют улучшение выживаемости у носителей мутаций BRCA2, которые имели наибольшие показатели выживаемости, за ними следуют носители мутации BRCA1, а далее – носители немутированного гена (wtBRCA) [11–15].
Известно, что пациентки с герминальными мутациями генов BRCA более склонны реагировать на химиотерапию на основе платины, проводимую в первичном лечении либо в лечении рецидивов. Эти больные имеют тенденцию сохранять чувствительность к платине в течение более длительного времени, чем пациентки без мутации BRCA [9, 16]. Среди пациенток с рецидивом заболевания носители герминальной мутации BRCA имеют более высокий уровень ответа и на ряд не платиносодержащих химиотерапевтических средств, чем пациентки без мутации, в т.ч. на пегилирован-ный липосомальный доксорубицин (56,5 против 19,5 %), трабектин (47,8 против 31,2 %) и циклофосфамид, что приводит к увеличению продолжительности жизни [17, 18]. В клинической практике у больных РЯ с герминальными BRCA -мутациями с большей вероятностью повторно назначаются платиносодержащие схемы химиотерапии.
Наблюдение за объективным ответом на терапию препаратами платины во второй линии у пациенток с положительной мутацией и ранним рецидивом после первичного лечения поставило под сомнение обычно используемое определение устойчивости к препаратам платины, т.е. прогрессирование в течение 6 мес после химиотерапии первой линии [19, 20]. Высокий уровень ответа на терапию рецидива препаратами платины свидетельствует о целесообразности их использования, пока не будет наблюдаться явное прогрессирование опухоли [9].
Генетическая составляющая представляет собой основу, определяющую успех в лечении больных РЯ: оправданность поддерживающего лечения у BRCA-мутированных пациенток [9]. Несмотря на то, что наличие мутаций генов BRCA1,2 считается прогностическим биомаркером ответа на лечение [21], до внедрения в клиническую практику ингибиторов поли-АДФ-рибозо-полимеразы (PARP) знание статуса BRCA пациентки оказывало незначительное влияние на тактику лечения РЯ. Все формы РЯ, за исключением клинических исследований, проведенных в течение последних 20 лет, рассматривались как единое целое. Данные представления изменились в результате клинических исследований, демонстрирующих эффективность PARP-ингибитора олапариба [22–24].
Белки, кодируемые геном BRCA , участвуют в репарации двунитевых разрывов ДНК по механизму гомологичной рекомбинации, обеспечивая целостность генома. Мутации в генах BRCA1/2 приводят к нарушению BRCA -ассоциированного механизма репарации ДНК. Белки суперсемейства PARP участвуют в репарации однонитевых разрывов ДНК. Механизм действия ингибиторов PARP запускает процесс синтетической летальности. Синтетическая летальность является основой терапевтического подхода, который избирательно летален для опухолевых клеток, несущих оба дефекта систем репарации, но не токсичен для незлокачественных клеток, создавая тем самым значимое терапевтическое окно. О синтетической летальности, возникающей при обусловленных мутациями потерях функций генов BRCA1 , или BRCA2 и PARP-ингибировании впервые сообщено в 2005 г. [25]. В декабре 2014 г. олапариб был одобрен EMA (European Medicines Agency/Европей-ское медицинское агентство) для использования в качестве поддерживающей терапии у пациенток с рецидивом HG серозного РЯ с BRCA 1/2m (герминальной или соматической), чувствительным к платине [26]. После одобрения олапариба клиническая польза была продемонстрирована как при mBRCA , так и при wtBRCA при применении других лицензированных ингибиторов PARP – ни-рапариба и рукапариба [27, 28]. В последующем в исследовании SOLO2 олапариб сравнивали с плацебо в качестве поддерживающей терапии после завершения платиновой терапии платиночувствительного рецидива. Олапариб достоверно увеличил медиану времени до прогрессирования с 5,5 мес до 19,1 мес, что соответствовало снижению относительного риска прогрессирования на 70 % (HR=0,30; p<0,0001) [29]. На основании этого олапариб был зарегистрирован в России и рекомендован в качестве поддерживающей терапии платиносодержащей химиотерапии по поводу платиночувствительного рецидива.
Клиническое наблюдение
Больная П., 44 лет, находится под наблюдением в НИИ онкологии Томского НИМЦ с июля 2011 г. По месту жительства 15.07.11 выполнена оптимальная циторедуктивная операция в объеме экстирпации матки с придатками, оментэктомии. Гистологически данные за серозную карциному высокой степени злокачественности (НG). Установлен диагноз: РЯ Ic cтадии (Т1сNxM0) (рис. 1). Проведено 6 курсов адъювантной химиотерапии по схеме цисплатин 75 мг/м2 + циклофосфан 750 мг/м2 каждые 3 нед.
Через 39 мес после завершения первичного лечения выявлен рецидив в виде объемного образования малого таза, размером 22×19×20 мм, лимфоаденопатии наружных подвздошных лимфоузлов (до 7 мм) (рис. 2). Уровень СА-125 в плазме крови на момент выявления рецидива повысился незначительно: с 9 Ед/мл до 13,2 Ед/мл, НЕ4 – 92,8 ммоль/л. При молекулярно-генетическом тестировании методом Real-Time ПЦР выявлена мутация BRCA1 5382ins C (рис. 3). Проведено 6 курсов химиотерапии карбоплатином AUC6 каждые 3 нед с полным клиническим ответом (рис. 4).
Учитывая наличие герминальной мутации гена BRCA1 и полный клинический ответ на препараты платины, через 8 нед после завершения противорецидивного лечения начата поддерживающая терапия PARP-ингибитором. На фоне приема олапариба в дозе 400 мг × 2 раза/день не отме-
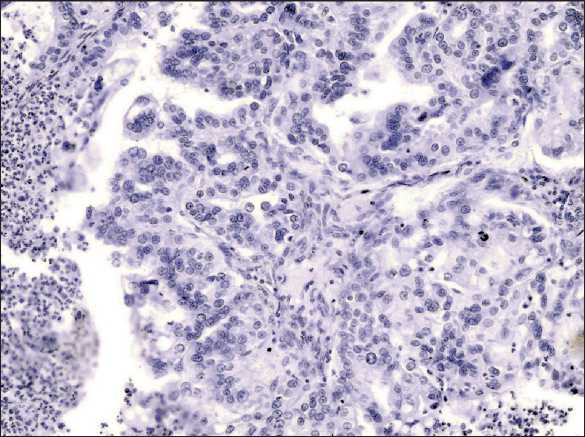
Рис. 1. Микрофото. Опухоль представлена железисто-криброзными структурами, построенными крупными умеренно полиморфными опухолевыми клетками с нормохромными ядрами, одним-двумя ядрышками с немногочисленными патологическими митозами.
Окраска гематоксилином и эозином, ×40
Fig. 1. Microphoto. The tumor consists of glandular-cribriform structures formed by large moderately polymorphic tumor cells with normochromic nuclei, one or two nucleoli with a few pathological mitoses. Hematoxylin and eosin staining, ×40
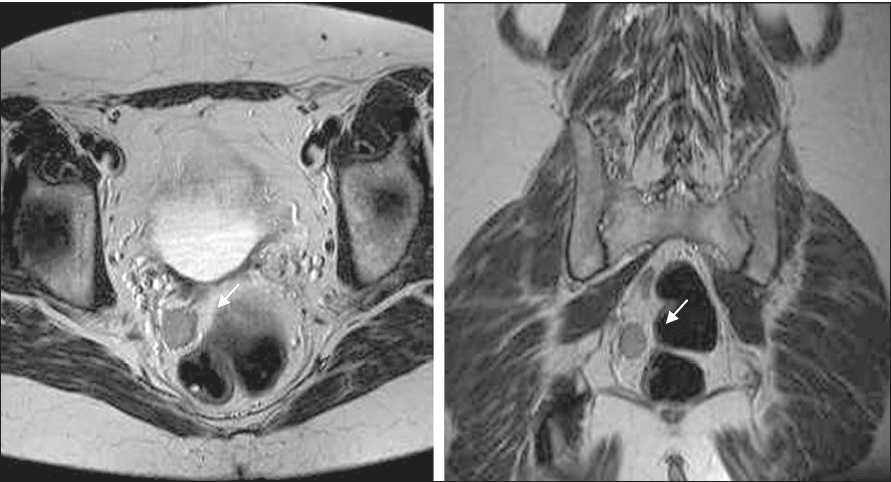
Рис. 2. МРТ. В области культи влагалища справа на границе со стенкой прямой кишки определяется рецидивное объемное образование солидной структуры с неровными, четкими контурами, активно накапливающее контраст
Fig. 2. MRI shows a recurrent tumor of a solid structure with uneven, clear contours in the region of the vaginal stump on the right, at the border with the wall of the rectum
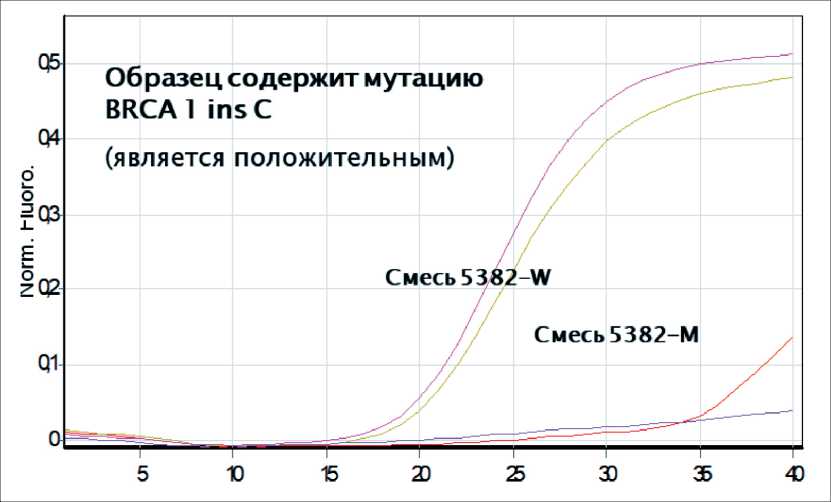
Рис. 3. Результат Real-Time ПЦР: Образец положительный (содержащий мутацию) – при использовании смеси праймеров 5382-W и 5382-М появление кривых амплификации, пересекающих порог флюоресценции с разницей не более чем в 1 цикл
Fig. 3. Real-Time PCR: Positive sample (containing a mutation): when using 5382-W and 5382-M primers, amplification curves crossing the fluorescence threshold with a difference of no more than 1 cycle appear
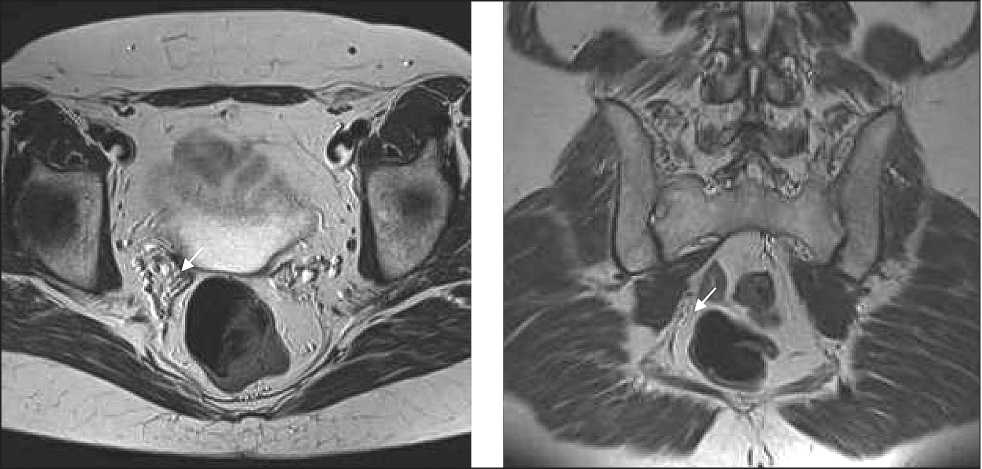
Рис. 4. МРТ. Признаки регресса рецидивного объемного образования малого таза Fig. 4. MRI shows signs of regression of recurrent pelvic tumor (a, b).
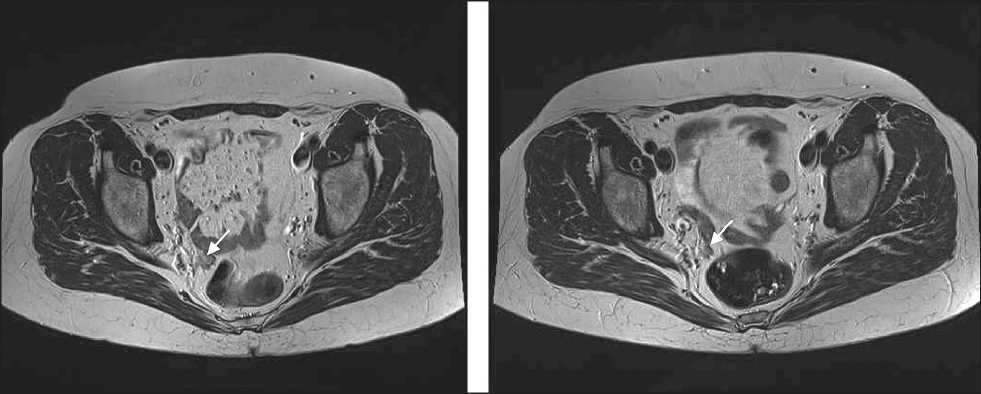
Рис. 5. МРТ. Признаки рецидивного объемного образования малого таза в области культи влагалища с распространением на параректальную клетчатку
Fig. 5. MRI. Signs of recurrent pelvic tumor in the area of the vaginal stump with spread to pararectal tissue
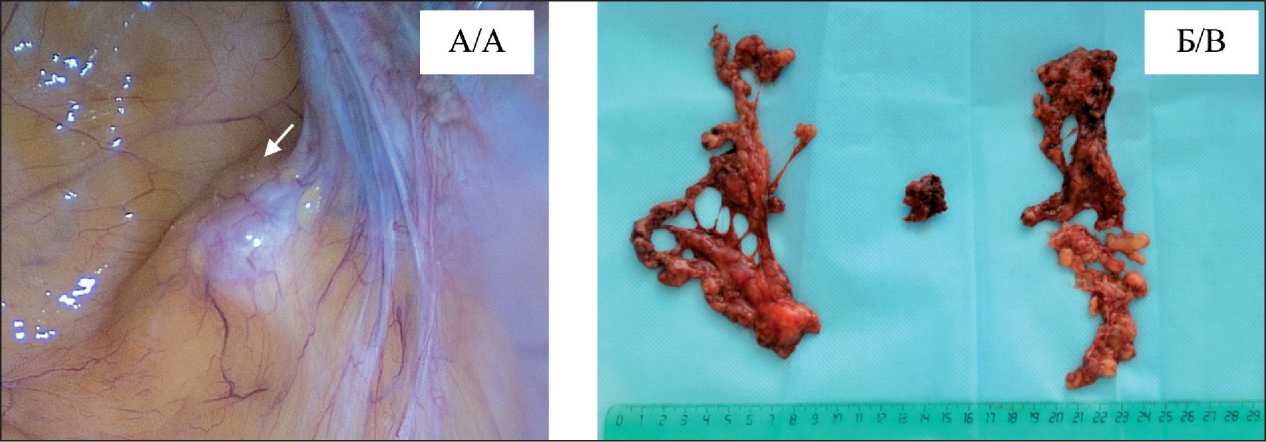
Рис. 6. Этап вторичной циторедуктивной операции: А – вид опухоли при лапароскопии, ревизии: опухоль в виде солидного участка до 12 мм расположена в подвздошной области справа; Б – макропрепарат: опухоль представлена узловым образованием плотной консистенции, тазовая клетчатка с лимфоузлами без признаков метастатического поражения
Fig. 6. Secondary cytoreductive surgery: A – laparoscopic view: solid tumor ≤12 mm, located in the right iliac region; B – macrospecimen: the tumor with hard consistency; pelvic lymph nodes without signs of metastases
чено значимых нежелательных явлений, признаки вегетососудистой дистонии по смешанному типу наблюдались только в начале лечения. Продолжительность лечения PARP-ингибитором – 37 мес. В ноябре 2018 г. пациентка отметила дискомфорт внизу живота. При УЗИ и МРТ органов малого таза выявлены признаки 2-го рецидива. Размеры рецидивной опухоли в малом тазу – 17×11×12 мм, также при МРТ наблюдались признаки подвздошной лимфоаденопатии (рис. 5). Уровень сывороточных маркеров сохранялся в пределах нормы
(Са-125 – 3,14 Ед/мл, HE4 – 76 ммоль/л). Проведено 2 курса противорецидивной химиотерапии – карбоплатин AUC5, паклитаксел 175 мг/м2 каждые 3 нед. По результатам МРТ-контроля выявлены признаки частичного ответа – уменьшение опухоли до 10×9×11 мм. После 2 курсов системной терапии 16.01.19 выполнена вторичная циторедуктивная операция в объеме лапароскопии, удаления рецидивной опухоли, тазовой лимфодис-секции, R0 (рис. 6). По данным гистологического исследования – серозная карцинома High grade (G3)
без метастазов в лимфатические узлы. Далее проведено 3 курса химиотерапии по прежней схеме с полной регрессией по данным инструментальных методов.
Общая выживаемость на данном этапе составила 93 мес. С учетом полного ответа на лечение 22.03.19 вновь начата поддерживающая терапия олапарибом в дозе 800 мг/сут ежедневно. Однако после 3 мес приема PARP-ингибитора в июне 2019 г. выявлено прогрессирование заболевания в виде нескольких рецидивных образований в малом тазу (20×11 и 15×9 мм) без клинических проявлений и без повышения сывороточных опухолевых маркеров (CA-125 –3,14 Ед/мл, HE4 – 79,4 ммоль/л). Прием олапариба был прекращен. Системная химиотерапия проводилась в связи с прогрессированием заболевания, нарастанием кан-цероматоза, появлением и нарастанием асцита. В последующем больная получила несколько линий химиотерапии без эффекта и была переведена на симптоматическую терапию. Общая выживаемость составила 112 мес.
Обсуждение
Поддерживающая терапия PARP-ингибиторами у больных РЯ с мутациями генов BRCA является эффективным способом увеличения успешности лечения при отсутствии значимого влияния на качество жизни, что подтверждает и данное клиническое наблюдение. Возможность повторного назначения PARP-ингибиторов больным с рецидивирующим течением РЯ активно изучается. В первом исследовании, посвященном изучению эффективности повторных курсов терапии ингибиторами PARP, показано, что у пациенток, которым ранее назначались данные препараты, резистентность при их повторном применении не развивалась, и поэтому они могли получать пользу от повторного назначения ингибиторов PARP. Это было небольшое ретроспективное исследование, в которое включены 22 пациентки случая BRCAm РЯ. Больные повторно лечились одним из 3 одобренных FDA ингибиторов PARP: олапарибом (n=6), нирапарибом (n=10) и рукапарибом (n=6). После повторного лечения частичный ответ получен у 3 (13,6 %), стабилизация – у 13 (59,1 %) больных, в 3 (13,6 %) случаях болезнь прогрессировала [30].
В 2018 г. опубликованы предварительные [31] и недавно – окончательные, результаты двойного слепого исследования III фазы OReO/ENGOT Ov-38 (NCT03106987), которые свидетельствуют, что повторное назначение поддерживающей терапии олапарибом (Lynparza) после ответа на химиотерапию на основе препаратов платины приводило к увеличению выживаемости без прогрессирования у пациенток с рецидивами, независимо от BRCA-статуса [32]. В исследование были включены 220 пациенток, которые ранее получали 1 линию поддерживающей терапии ингибиторами PARP продолжительностью не менее 18 мес после химиотерапии первой линии или не менее 12 мес после химиотерапии второй или более поздней линии и продемонстрировали ответ на противорецидивную химиотерапию на основе препаратов платины. В исследование включено 112 больных с рецидивами РЯ mBRCA и 108 пациенток с рецидивами РЯ wtBRCA, каждая из групп была рандомизированы 2:1 для терапии олапарибом или плацебо. Медиана продолжительности предшествующей терапии PARP-ингибиторами среди mBRCA больных составляла от 18,3 до 21,2 мес, среди wtBRCA больных – от 12,4 до 12,6 мес. Соответственно, в когорте mBRCA и wtBRCA ранее назначаемыми ингибиторами PARP были олапариб (91 vs 21,5 %), нирапариб (4,5 vs 61 %), рукапариб (3 vs 13,5 %). велипариб (0 vs 2 %), слепая терапия (0 vs 3,5 %) и плацебо (по 1,5 % в каждом случае). Статус дефицита гомологичной рекомбинации (HRD) был положительным примерно у 40 % wtBRCA пациенток и был неизвестен примерно в четверти случаев. Через 12 мес после рандомизации показатели ВБП в группе mBRCA больных составили 19 % по сравнению с 0 % в группе плацебо, в группе wtBRCA больных – 14 % и 0 % соответственно. Преимущество олапариба в отношении ВБП наблюдалось во всех подгруппах и не зависело от статуса HRD, за исключением пациенток, которые получали первичное лечение PARP-ингибиторами в течение короткого времени. Авторы подчеркивают важность определения молекулярных предикторов при осуществлении выбора между схемами системной терапии и терапией ингибиторами PARP.
Эта область является приоритетной для активного изучения именно сейчас, после уже доказанной клиническими исследованиями эффективности терапии PARP-ингибиторами. Имеется пока единственное проспективное рандомизированное клиническое исследование III фазы OReO, поставившее задачу выяснить, полезно ли повторное введение PARP-ингибиторов mBRCA больным [32]. У большинства пациентов с HG РЯ неизбежно реализуется врожденная или приобретенная резистентность к PARP-ингибиторам [34]. Описаны различные гетерогенные механизмы, лежащие в ее основе, к ним относятся снижение внутриклеточных концентраций препарата из-за активизации множественных насосов выброса лекарственных средств из клетки, потеря экспрессии или инактивирующие мутации в белке PARP, восстановление HR посредством реверсивных мутаций BRCA и эпигенетической активизации BRCA1, защита репликативной вилки, изменения в микроокружении опухоли и др. [33, 34].
Расшифровка молекулярных механизмов устойчивости к PARP- ингибиторам имеет первостепенное значение для разработки новых методов преодоления химиорезистентности, повторного восстановления чувствительности опухоли к препаратам платины или PARP-ингибиторам [33, 34]. Многообещающими стратегиями являются ингибирование ATR, эпигенетическая ресенсибилизация посредством ингибирования DNMT, ингибирование контрольных точек клеточного цикла, комбинации с антиангиогенной терапией, ингибирование BET и др. Трансляционные исследования для выяснения механизмов резистентности должны быть включены в будущие клинические испытания, поскольку понимание этих биологи- ческих механизмов имеет решающее значение для разработки новых терапевтических подходов в лечении распространенного и рецидивного РЯ [33]. Наличие мутаций генов BRCA1,2 является обоснованием для дополнительной опции – поддерживающей терапии PARP-ингибиторами, улучшающей результаты лечения не только первичного и рецидивного рака яичника, но и при повторном использовании препарата.
Список литературы Клинический случай повторного применения PARP-ингибиторов у больной с MBRCA-ассоциированным раком яичников
- Максимов С.Я., Хаджимба А.С., Ильин А.А., Соболев И.В. Роль повторных лапаротомий в лечении больных злокачественными опухолями яичников. Практическая онкология. 2014; 15(4): 176-85. [Maksimov S.Ya., Khadzhimba A.S., Il'in A.A., Sobolev I.V. The role of repeated laparotomies in the treatment of patients with malignant ovarian tumors. Practical Oncology. 2014; 15(4): 176-85. (in Russian)].
- PorhanovaN.V., SokolenkoA.P., SherinaN.Y., PonomariovaD.N., Tkachenko N.N., Matsko D.E., ImyanitovE.N. Ovarian cancer patient with germline mutations in both BRCA1 and NBN genes. Cancer Genet Cyto-genet. 2008; 186(2): 122-4. doi: 10.1016/j.cancergencyto.2008.06.012.
- Смирнова Т.Ю., Любченко Л.Н., ПоспеховаН.И., Портной С.М., Жорданина К.И., Гарькавцева Р.Ф., Карпухин А.В. Рак молочной железы и яичников. Роль наследственных факторов. Tumors of the female reproductive system. 2007; 4: 90-6. [Smirnova T.Yu., Lyubchenko L.N., Pospekhova N.I., Portnoi S.M., Zhordanina K.I., Gar'kavtseva R.F., Karpukhin A.V. Breast and ovarian cancer. The role of hereditary traits. Tumors of the female reproductive system. 2007; 4: 90-6. (in Russian)].
- Федорова О.Е., Любченко Л.Н., Паяниди Ю.Г., Казубская Т.П., Амосенко Ф.А., Гарькавцева Р.Ф., Заседателев А.С., Наседкина Т.В. Использование биочипов при изучении распространенных мутаций в генах BRCA1/2 и CHEK2 у больных органоспецифическим раком яичников и первично-множественными злокачественными новообразованиями с поражением яичников (российская популяция). Молекулярная биология. 2007; 41(1): 37-42. [Fedorova O.E., Lyubchenko L.N, Payanidi Yu.G., Kazubskaya T.P., Amosenko FA., Gar'kav-tseva R.F., Zasedatelev A.S., Nasedkina T.V. Biochip analysis of BRCA1/2 and CHEK2 common mutations in ovarian cancer and primary multiple tumors involving the ovaries (Russian population). Molecular Biology. 2007; 41(1): 37-42. (in Russian)].
- Анисименко М.С., Афанасьева Н.А., Часовникова О.Б., Красильников С.Э., ГуляеваЛ.Ф., Коваленко С.П. Анализ встречаемости мутации 5382insC в гене BRCA1 у больных раком яичников в Сибирском регионе. Сибирский онкологический журнал. 2013; 52(4): 39-42. [Anisimenko M.S., Afanasieva N.A., Chasovnikova O.B., Krasilnikov S.E., GulyaevaL.F., Kovalenko S.P. The incidence of mutation BRCA1 5382INSC in ovarian cancer patients in Siberian region, Russia. Siberian Journal of Oncology. 2013; 52(4): 39-42. (in Russian)].
- TyulyandinaA., Gorbunova V., Khokhlova S., KolomietsL. Profile of BRCA1/BRCA2 mutations in Russian ovarian cancer population detected by NGS and MLPA analysis: Interim results of OVATAR study. Proc Am Assoc Cancer Res. 2018. 59: 320. doi: 0.1200/jm.2019.37.15_suppl. e13111.
- Zhang S., Royer R., Li S., McLaughlin J.R., RosenB., RischH.A., Fan I., Bradley L., Shaw P.A., Narod S.A. Frequencies of BRCA1 and BRCA2 mutations among 1,342 unselected patients with invasive ovarian cancer. Gynecol Oncol. 2011; 121(2): 353-7. doi: 10.1016/j. ygyno.2011.01.020.
- Pal T., Permuth-Wey J., Betts J.A., Krischer J.P., Fiorica J., ArangoH., LaPolla J., HoffmanM., MartinoM.A., WakeleyK., Wilbanks G., Nicosia S., Cantor A., Sutphen R. BRCA1 and BRCA2 mutations account for a large proportion of ovarian carcinoma cases. Cancer. 2005; 104(12), 2807-16. https://doi.org/10.1002/cncr.21536.
- KentwellM., Dow E., Antill Y., Wrede C.D., McNally O., Higgs E., Hamilton A., Ananda S., Lindeman G.J., Scott C.L. Mainstreaming cancer genetics: A model integrating germline BRCA testing into routine ovarian cancer clinics. Gynecol Oncol. 2017; 145(1): 130-6. doi: 10.1016/j. ygyno.2017.01.030.
- Alsop K., Fereday S., Meldrum C., deFazio A., Emmanuel C., George J., Dobrovic A., Birrer M.J., Webb P.M., Stewart C., Friedlander M., Fox S., Bowtell D., Mitchell G. BRCA mutation frequency and patterns of treatment response in BRCA mutation-positive women with ovarian cancer: a report from the Australian Ovarian Cancer Study Group. J Clin Oncol. 2012; 30(21): 2654-63. doi: 10.1200/jm.2011.39.8545. 2012. Erratum in: J Clin Oncol. 2012; 30(33): 4180.
- PlaskocinskaI., ShipmanH., Drummond J., ThompsonE., Buchanan V., Newcombe B., Hodgkin C., Barter E., Ridley P., Ng R., Miller S., Dann A., Licence V., Webb H., Tan L.T., Daly M., Ayers S., Rufford B., EarlH., Parkinson C., Duncan T., Jimenez-LinanM., Sagoo G.S., Abbs S., Hulbert-WilliamsN., PharoahP., Crawford R., Brenton J.D., TischkowitzM. New paradigms for BRCA1/BRCA2 testing in women with ovarian cancer: results of the Genetic Testing in Epithelial Ovarian Cancer (GTEOC) study. J Med Genet. 2016; 53(10): 655-61. doi: 10.1136/jmedgenet-2016-103902.
- Yang D., Khan S., Sun Y., Hess K., Shmulevich I., Sood A.K., Zhang W. Association of BRCA1 and BRCA2 mutations with survival, chemotherapy sensitivity, and gene mutator phenotype in patients with ovarian cancer. JAMA. 2011; 306(14): 1557-65. doi: 10.1001/jama.2011.1456. Erratum in: JAMA. 2012 Jan 25; 307(4): 363.
- BoltonK.L., Chenevix-Trench G., Goh C., Sadetzki S., Ramus S.J., Karlan B.Y., Lambrechts D., Despierre E., Barrowdale D., McGuffog L., Healey S., Easton D.F., Sinilnikova O., Benítez J., García M.J., Neuhausen S., GailM.H., HartgeP., PeockS., FrostD., EvansD.G., EelesR., Godwin A.K., Daly M.B., Kwong A., Ma E.S., Lázaro C., Blanco I., Montagna M., D'Andrea E., Nicoletto M.O., Johnatty S.E., Kj&r S.K., Jensen A., H0gdall E., Goode E.L., Fridley B.L., Loud J.T., Greene M.H., MaiP.L., Chetrit A., LubinF., Hirsh-Yechezkel G., Glendon G., Andrulis I.L., Toland A.E., Senter L., Gore M.E., Gourley C., Michie C.O., Song H., Tyrer J., WhittemoreA.S., McGuire V., Sieh W., Kristoffersson U., OlssonH., Borg Ä., Levine D.A., Steele L., Beattie M.S., Chan S., Nussbaum R.L., Moysich K.B., Gross J., Cass I., Walsh C., Li A.J., Leuchter R., Gordon O., Garcia-Closas M., Gayther S.A., Chanock S.J., Antoniou A.C., Pharoah P.D.; EMBRACE; kConFab Investigators; Cancer Genome Atlas Research Network. Association between BRCA1 and BRCA2 mutations and survival in women with invasive epithelial ovarian cancer. JAMA. 2012; 307(4): 382-90. doi: 10.1001/jama.2012.20.
- Liu J., Cristea M.C., Frankel P., Neuhausen S.L., Steele L., En-gelstaedter V., Matulonis U., Sand S., Tung N., Garber J.E., Weitzel J.N. Clinical characteristics and outcomes of BRCA-associated ovarian cancer: genotype and survival. Cancer Genet. 2012; 205(1-2): 34-41. doi: 10.1016/j.cancergen.2012.01.008.
- Candido-dos-Reis F.J., Song H., Goode E.L., Cunningham J.M., Fridley B.L., Larson M.C., Alsop K., Dicks E., Harrington P., Ramus S.J., de Fazio A., Mitchell G., Fereday S., Bolton K.L., Gourley C., Michie C., Karlan B., Lester J., Walsh C., Cass I., Olsson H., Gore M., Benitez J.J., Garcia M.J., Andrulis I., Mulligan A.M., Glendon G., Blanco I., Lazaro C., Whittemore A.S., McGuire V., Sieh W., Montagna M., Alducci E., Sadetzki S., Chetrit A., Kwong A., Kjaer S.K., Jensen A., H0gdall E., Neuhausen S., NussbaumR., DalyM., GreeneM.H., MaiP.L., Loud J.T., MoysichK., Toland A.E., Lambrechts D., Ellis S., FrostD., Brenton J.D., TischkowitzM., Easton D.F., Antoniou A., Chenevix-Trench G., Gayther S.A., Bowtell D., Pharoah P.D.; for EMBRACE; kConFab Investigators; Australian Ovarian Cancer Study Group. Germline mutation in BRCA1 or BRCA2 and ten-year survival for women diagnosed with epithelial ovarian cancer. Clin Cancer Res. 2015; 21(3): 652-7. doi: 10.1158/1078-0432.CCR-14-2497.
- 16.FoxE., McCuaig J, Demsky R., Shuman C., Chitayat D., MagantiM., Murphy J., Rosen B., Ferguson S., Randall Armel S. The sooner the better: Genetic testing following ovarian cancer diagnosis. Gynecol Oncol. 2015; 137(3): 423-9. doi: 10.1016/j.ygyno.2015.03.057.
- Tan D.S., Rothermundt C., Thomas K., Bancroft E., Eeles R., Shan-ley S., Ardern-Jones A., Norman A., Kaye S.B., Gore M.E. "BRCAness" syndrome in ovarian cancer: a case-control study describing the clinical features and outcome of patients with epithelial ovarian cancer associated with BRCA1 and BRCA2 mutations. J Clin Oncol. 2008; 26(34): 5530-6. doi: 10.1200/JC0.2008.16.1703.
- Adams S.F., MarshE.B., Elmasri W., HalberstadtS., Vandecker S., Sammel M.D., Bradbury A.R., Daly M., Karlan B., Rubin S.C. A high response rate to liposomal doxorubicin is seen among women with BRCA mutations treated for recurrent epithelial ovarian cancer. Gynecol Oncol. 2011; 123(3): 486-91. doi: 10.1016/j.ygyno.2011.08.032.
- LorussoD., Scambia G., Pignata S., SorioR., Amadio G., Lepori S., Mosconi A., Pisano C., Mangili G., Maltese G., Sabbatini R., Artioli G., Gamucci T., Di Napoli M., Capoluongo E., Ludovini V., Raspagliesi F., Ferrandina G. Prospective phase II trial of trabectedin in BRCA-mutated and/or BRCAness phenotype recurrent ovarian cancer patients: the MITO 15 trial. Ann Oncol. 2016; 27(3): 487-93. doi: 10.1093/annonc/mdv608.
- Eisenhauer E.A., Vermorken J.B., van Glabbeke M. Predictors of response to subsequent chemotherapy in platinum pretreated ovarian cancer: a multivariate analysis of 704 patients [seecomments]. Ann Oncol. 1997; 8(10): 963-8. doi: 10.1023/a:1008240421028.
- Cannistra S.A. Cancer of the ovary. N Engl J Med. 2004; 351(24): 2519-29. doi: 10.1056/NEJMra041842. Erratum in: N Engl J Med. 2005; 352(1):104.
- George A., Kaye S., Banerjee S. Delivering widespread BRCA testing and PARP inhibition to patients with ovarian cancer. Nat Rev Clin Oncol. 2017; 14(5): 284-96. doi: 10.1038/nrclinonc.2016.191.
- Fong P.C., Yap T.A., Boss D.S., Carden C.P., Mergui-Roelvink M., Gourley C., De Greve J., Lubinski J., Shanley S., Messiou C., A 'Hern R., Tutt A., Ashworth A., Stone J., Carmichael J., Schellens J.H., de Bono J.S., Kaye S.B. Poly(ADP)-ribose polymerase inhibition: frequent durable responses in BRCA carrier ovarian cancer correlating with platinum-free interval. J Clin Oncol. 2010; 28(15): 2512-9. doi: 10.1200/ JCO.2009.26.9589.
- SwisherE.M., LinK.K., Oza A.M., Scott C.L., GiordanoH., Sun J., Konecny G.E., Coleman R.L., Tinker A.V., O'Malley D.M., Kristeleit R.S., Ma L., Bell-McGuinn K.M., Brenton J.D., Cragun J.M., Oaknin A., Ray-Coquard I., HarrellM.I., Mann E., Kaufmann S.H., Floquet A., LearyA., Harding T.C., Goble S., Maloney L., Isaacson J., Allen A.R., Rolfe L., Yelensky R., Raponi M., McNeish I.A. Rucaparib in relapsed, platinum-sensitive high-grade ovarian carcinoma (ARIEL2 Part 1): an international, multicentre, open-label, phase 2 trial. Lancet Oncol. 2017; 18(1): 75-87. doi: 10.1016/S1470-2045(16)30559-9.
- Ledermann J., Harter P., Gourley C., Friedlander M., Vergote I., Rustin G., Scott C.L., Meier W., Shapira-Frommer R., Safra T., Matei D., Fielding A., Spencer S., Dougherty B., Orr M., Hodgson D., Barrett J.C., Matulonis U. Olaparib maintenance therapy in patients with platinum-sensitive relapsed serous ovarian cancer: a preplanned retrospective analysis of outcomes by BRCA status in a randomised phase 2 trial. Lancet Oncol. 2014; 15(8): 852-61. doi: 10.1016/S1470-2045(14)70228-1.
- Farmer H., McCabe N., Lord C.J., Tutt A.N., Johnson D.A., Richardson T.B., Santarosa M., Dillon K.J., Hickson I., Knights C., Martin N.M., Jackson S.P., Smith G.C., Ashworth A. Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy. Nature. 2005; 434(7035): 917-21. doi: 10.1038/nature03445.
- The European Medicines Agency [Internet]. 2014. URL: http:// www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/ medicines/003726/human_med_001831.jsp&mid=WC0b01ac058001d124 [cited 2022 Jan 11].
- Mirza M.R., Monk B.J., Herrstedt J., Oza A.M., Mahner S., Redondo A., Fabbro M., Ledermann J.A., Lorusso D., Vergote I., Ben-BaruchN.E., Marth C., MqdryR., ChristensenR.D., Berek J.S., D0rumA., Tinker A.V., du Bois A., González-Martín A., Follana P., Benigno B., Rosenberg P., Gilbert L., Rimel B.J., Buscema J., Baiser J.P., Agarwal S., Matulonis U.A.; ENGOT-OV16/NOVA Investigators. Niraparib Maintenance Therapy in Platinum-Sensitive, Recurrent Ovarian Cancer. N Engl J Med. 2016; 375(22): 2154-64. doi: 10.1056/NEJMoa1611310.
- Coleman R.L., Oza A.M., Lorusso D., Aghajanian C., Oaknin A., Dean A., Colombo N., Weberpals J.I., Clamp A., Scambia G., Leary A., Holloway R.W., Gancedo M.A., Fong P.C., Goh J.C., O'Malley D.M., ArmstrongD.K., Garcia-Donas J., Swisher E.M., Floquet A., Konecny G.E., McNeish I.A., Scott C.L., Cameron T., Maloney L., Isaacson J., Goble S., Grace C., Harding T.C., Raponi M., Sun J., Lin K.K., Giordano H., Ledermann J.A.; ARIEL3 investigators. Rucaparib maintenance treatment for recurrent ovarian carcinoma after response to platinum therapy (ARIEL3): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2017; 390(10106): 1949-61. doi: 10.1016/S0140-6736(17)32440-6. Erratum in: Lancet. 2017; 390(10106): 1948.
- Essel K.G., Behbakht K., Lai T., Hand L., Evans E., Dvorak J., Ding K., Konecny G., Moore K.N. PARPi after PARPi in epithelial ovarian cancer. Gynecol Oncol Rep. 2021; 35: 100699. doi: 10.1016/j. gore.2021.100699.
- Pujade-Lauraine E., Ledermann J.A., Selle F., Gebski V., Pen-son R.T., Oza A.M., Korach J., Huzarski T., Poveda A., Pignata S., Friedlander M., Colombo N., Harter P., Fujiwara K., Ray-Coquard I., Banerjee S., Liu J., Lowe E.S., BloomfieldR., Pautier P.; SOLO2/ENGOT-Ov21 investigators. Olaparib tablets as maintenance therapy in patients with platinum-sensitive, relapsed ovarian cancer and a BRCA1/2 mutation (SOLO2/ENGOT-Ov21): a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol. 2017; 18(9): 1274-84. doi: 10.1016/S1470-2045(17)30469-2.
- Pujade-Lauraine E., Selle F., Scambia G., Asselain B., Marme F., Lindemann K., Colombo N., Madry R., Glasspool R.M., Dubot C., Oaknin A., Zamagni C., Heitz F., Gladieff L., Rubio-Perez M.J., Scollo P., Blakeley C., Shaw B., Ray-Coquard I.L., Redondo A. Maintenance ola-parib rechallenge in patients (pts) with ovarian carcinoma (OC) previously treated with a PARP inhibitor (PARPi): phase IIIb OReO/ENGOT Ov-38 trial. Annals of Oncology. 2021; 32: 1308-9. doi: 10.1016/j. annonc.2021.08.2110.
- McMullen M., Karakasis K., Madariaga A., Oza A.M. Overcoming Platinum and PARP-Inhibitor Resistance in Ovarian Cancer. Cancers (Basel). 2020; 12(6): 1607. doi: 10.3390/cancers12061607.
- Chiappa M., Guffanti F., Bertoni F., Colombo I., Damia G. Overcoming PARPi resistance: Preclinical and clinical evidence in ovarian cancer. Drug Resist Updat. 2021; 55: 100744. doi: 10.1016/j. drup.2021.100744.


