Клинический случай протезирования митрального клапана через 38 лет после имплантации шарового протеза в аортальную позицию
Автор: Ю.В. Желтовский, В.И. Батеха, Е.В. Пешков, В.А. Подкаменный
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Случаи из клинической практики
Статья в выпуске: 1 т.26, 2022 года.
Бесплатный доступ
Внедрение в клиническую практику шаровых протезов стало началом новой эпохи в лечении клапанной патологии сердца. При высоких долговечности и износостойкости такие протезы имели большие габариты и массу, повышенный градиент давления, риск тромбоза клапана и системных эмболий. С появлением более совершенных дисковых конструкций применение шаровых протезов завершилось. В литературе отмечают рост повторных вмешательств после имплантации шаровых протезов в отдаленном периоде из-за порока другого клапана. Необходимость замены шарового протеза без его дисфункции на современные механический или биологический во время вмешательства на другом клапане обсуждается. В сообщении представлено клиническое наблюдение повторной операции у пациента 55 лет с ревматическим стенозом митрального и функциональной недостаточностью трикуспидального клапана через 38 лет после имплантации шарового протеза в аортальную позицию. По данным эхокардиографии, пиковый трансмитральный градиент 16 мм рт. ст., средний — 5,5, площадь 1,3 см2, регургитация 3-й ст. На трикуспидальном клапане регургитация 3-й ст. Удовлетворительные гемодинамические показатели работы шарового протеза (максимальная скорость кровотока 2,65 м/с, пиковый градиент 30 мм рт. ст., средний — 18, регургитации нет), отсутствие клапанозависимых осложнений позволили ограничиться протезированием митрального и пластикой трикуспидального клапанов без замены аортального протеза, что сократило продолжительность операции и снизило риск осложнений. Осмотр пациента через 2 года после операции, его активный образ жизни, удовлетворительные гемодинамические параметры при обследовании подтверждают правильность тактики. Результат доказывает возможность хирургического лечения митрального порока в отдаленные сроки после протезирования аортального клапана хорошо функционирующим шаровым протезом без его замены.
Дефект аортального клапана, длительное наблюдение, имплантация протеза, повторная операция, протезирование шарового клапана, протезирование митрального клапана
Короткий адрес: https://sciup.org/142231155
IDR: 142231155 | DOI: 10.21688/1681-3472-2022-1-83-89
Текст научной статьи Клинический случай протезирования митрального клапана через 38 лет после имплантации шарового протеза в аортальную позицию
Желтовский Ю.В., Батеха В.И., Пешков Е.В., Подкаменный В.А. Клинический случай протезирования митрального клапана через 38 лет после имплантации шарового протеза в аортальную позицию. Патология кровообращения и кардиохирургия. 2022;26(1):83-89.
В 1952 г. C.A. Hufnagel впервые протезировал функцию клапана сердца, имплантировав искусственный протез в нисходящую аорту 30-летней женщине с недостаточностью аортального клапана [1]. После того как D.E. Harken в 1958 г. выполнил первую субкоронарную имплантацию искусственного клапана [2], были созданы различные конструкции, среди которых шаровые протезы (ШП) относили к числу самых надежных [3].
Отечественные ШП разработали в лаборатории Кирово-Чепецкого химического завода в 1962 г. Через год Г.М. Соловьев успешно имплантировал искусственный клапан в митральную позицию, через два — в аортальную [3]. Однако ШП вызывали гемодинамические проблемы, гемолиз и тромбозы, связанные с малой площадью эффективного отверстия, большими габаритами и турбулентным потоком крови. С появлением более совершенных дисковых конструкций применение ШП завершилось [3].
В публикациях, посвященных отдаленным результатам и качеству жизни больных после коррекции пороков сердца ШП, отмечают техническую сложность повторных операций с высокой госпитальной летальностью [4]. Около 8,8 % повторных вмешательств проводят из-за порока ранее не оперированных клапанов [5]. Анализ отдаленных результатов имплантации ШП и повторных операций на клапанном аппарате сердца показал, что однозначного решения нет и судьбу имплантированного ШП определяют в каждом случае индивидуально.
Клинический случай
Пациент 55 лет поступил в отделение кардиохирургии № 1 Иркутской областной клинической больницы с жалобами на одышку при незначительной физической нагрузке. Из анамнеза: в 1978 г. в 17-летнем возрасте в Иркутском кардиохирурги- ческом центре перенес протезирование аортального клапана по поводу недостаточности ревматической этиологии ШП АКЧ-02-2 (Кирово-Чепецкий химический завод, Кирово-Чепецк, СССР) в условиях искусственного кровообращения и глубокой гипотермии (хирург В.И. Астафьев). Через 2 мес. после операции значительные физические нагрузки переносил удовлетворительно. Постоянно принимал непрямые пероральные антикоагулянты: до 2004 г. фенилин, после — варфарин. При эхокардиографии (ЭхоКГ) отмечали удовлетворительную функцию искусственного клапана. С 2004 г. на контрольных осмотрах не был, объясняя это хорошим самочувствием. С 2012 г. появилась одышка при физической нагрузке и в положении лежа. Госпитализации предшествовали значительное снижение толерантности к физической нагрузке и отеки нижних конечностей.
Данные инструментальных исследований
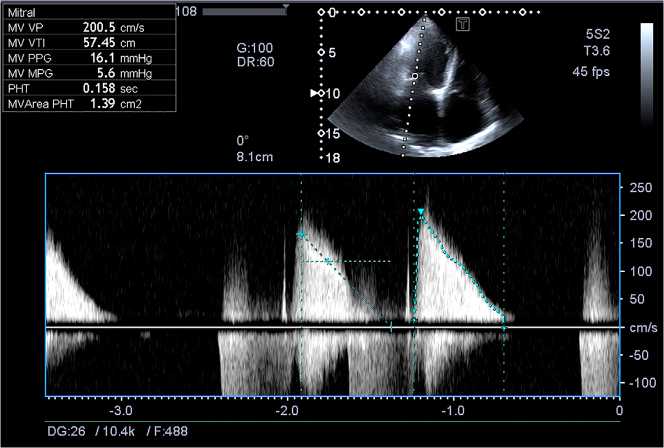
По данным ЭхоКГ: утолщение створок митрального клапана и подклапанных структур с ограничением их подвижности. Пиковый трансмитральный градиент 16 мм рт. ст., средний — 5,5 мм рт. ст. Площадь митрального отверстия 1,3 см2 (рис. 1). Регургитация на митральном клапане 3-й ст., соотношение площади регургитации к площади левого предсердия 40 %. ШП аортального клапана функционирует удовлетворительно: максимальная скорость кровотока 2,65 м/с, пиковый градиент давления 30 мм рт. ст., средний — 18 мм рт. ст. Площадь протеза 1,95 см2. Регургитация не определяется. Подвижность запирательного элемента в полном объеме. На обойме участки кальциноза. На трикуспидальном клапане регургитация 3-й ст. (vena contracta 7,4 мм). Конечный диастолический объем левого желудочка 165 мл, конечный систолический — 65 мл, фракция выброса 59 %. Расчетное давление в правом желудочке 60 мм рт. ст. При коронарографии патологии коронарного русла не обнаружили (рис. 2).
Рис. 1. Допплерография трансмитрального потока в апикальном 4-камерном сечении
Хирургическое лечение
Предложили хирургическое лечение порока митрального и функциональной недостаточности трикуспидального клапанов. За 4 дня до операции отменили варфарин, назначили низкомолекулярный нефракционированный гепарин.
С учетом интимного соприкосновения перикарда с грудиной по данным компьютерной томографии перед стернотомией выполнили канюляцию общей бедренной артерии. В переднем средостении выраженный спаечный процесс. Длительный кардиолиз с освобождением магистральных сосудов и правых отделов сердца. Искусственное кровообращение по схеме: бедренная артерия – полые вены. Дренаж левых отделов сердца через верхнюю правую легочную вену. Кардиоплегия в корень аорты до остановки сердца, затем ретроградно (кустодиол).
Доступ к митральному клапану через межпредсердную перегородку. При ревизии выраженный фиброз его створок и сращения хордопапиллярного аппарата, отверстие щелевидной формы 20 × 6 мм. Клапан иссекли с сохранением основания задней створки без нарушения целостности подклапанных структур. Имплантировали механический протез «МЕДИНЖ-2» № 27 (ЗАО НПП «МедИнж», Пенза, Россия) П-образными швами на тефлоновых прокладках. После герметизации левого предсердия выполнили пластику трикуспидального клапана опорным полужестким кольцом с управляемой формой «МЕДИНЖ» № 36 П-образными швами на тефлоновых прокладках. При гидравлической пробе регургитации на трикуспидальном клапане нет. Продолжительность искусственного кровообращения 175 мин, пережатия аорты — 72 мин.
Рис. 2. Селективная коронарография правой (А) и левой (В) коронарных артерий. В проекции аортального клапана — тень металлического корпуса шарового протеза АКЧ-02-2
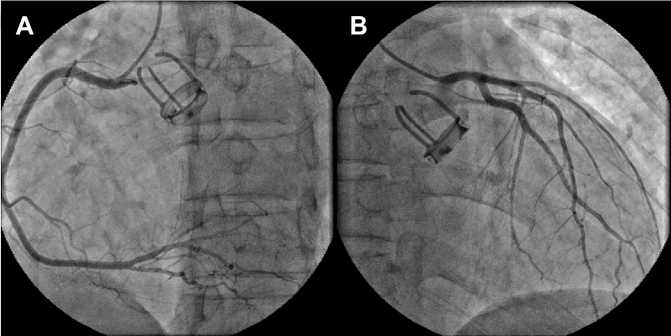
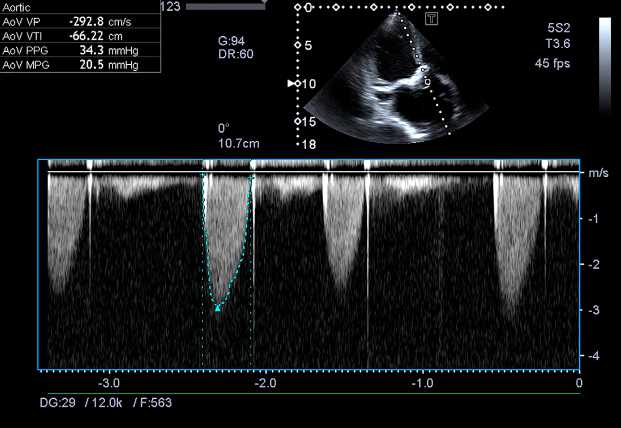
Рис. 3. Трансаортальная постоянно-волновая допплерография.
Пиковый градиент 34 мм рт. ст., средний — 20 мм рт. ст.
Динамика и исход
Ранний послеоперационный период протекал с явлениями умеренной сердечной недостаточности. На контрольной ЭхоКГ гемодинамические показатели механических протезов клапанов сердца удовлетворительные. Пациента выписали из стационара на 20-е сут. после операции. При осмотре через 2 года жалоб не предъявлял. Ведет активный образ жизни. По данным ЭхоКГ, функция искусственного аортального клапана по-прежнему удовлетворительная (рис. 3). Пиковый трансмитральный градиент 12 мм рт. ст., средний — 5 мм рт. ст. При допплерографии минимальная транспротезная регургитация. Градиент давления на трикуспидальном клапане 4 мм рт. ст. Регургитация 1-й ст. Снизилась степень легочной гипертензии (с 60 до 35 мм рт. ст.), уменьшился объем левого желудочка (конечный диастолический объем с 165 до 124 мл).
Обсуждение
По данным длительного наблюдения 2 247 пациентов, перенесших протезирование аортального клапана ШП Starr – Edwards (Edwards Lifesciences, Ирвин, США) в период между 1960 и 1997 гг., выживаемость в течение 10 лет составляла 53 %, 20 лет — 23 %, 30 лет — 8 % и после 40 лет — 4 % [6]. Риск жизнеугрожающей тромбоэмболии после имплантации механического протеза аортального клапана составляет 1 % в год у пациентов, принимающих вар-фарин. Риск тромбоэмболии у больных с ШП вдвое выше, чем с двустворчатым механическим клапаном [7].
M. Tochii и соавт. считают, что ШП необходимо менять через 20 лет после имплантации для поддержания хорошей гемодинамики и снижения частоты осложнений, связанных с износом его ткани [8]. Учитывая возможность разрушения тканевого покрытия протеза, G.E. Hatton и соавт. рекомендуют профилактическую замену при наличии эмболических инсультов независимо от антикоагулянтного контроля [9]. Трудность диагностики износа ткани при помощи ЭхоКГ обусловлена значительными артефактами запирательного элемента, препятствующими измерению истинного осевого потока через клапан [8].
Другие авторы придерживаются менее агрессивной тактики относительно ранее имплантированного ШП и предлагают индивидуально определять вариант операции. По мнению O.L. Gödje и соавт., профилактическая замена ШП при удовлетворительных результатах ЭхоКГ в отдаленном периоде необоснованна, но может быть выполнена при повторной операции на сердце по другим показаниям [10]. V. Tarzia и соавт. через 37 лет после имплантации ШП Starr – Edwards в митральную позицию, несмотря на его удовлетворительную функцию, протезировали аортальный и репроте-зировали митральный клапаны двустворчатыми конструкциями, чтобы улучшить гемодинамику на фоне легочной гипертензии и снизить рекомендуемые значения международного нормализованно- го отношения из-за частых сопутствующих кишечных кровотечений в анамнезе [11].
K. Antończyk и соавт. наблюдали пациента через 28 лет после коррекции митрального порока ШП. По данным ЭхоКГ установили критический стеноз аортального, недостаточность трикуспидального клапанов, параклапанную фистулу митрального протеза. Выявленный на операции кальциноз фиброзного кольца митрального клапана затруднял его замену. Фистулу закрыли отдельными П-образными швами на прокладках, выполнили протезирование аортального и пластику трикуспидального клапанов. Авторы разделяют мнение о необходимости профилактической замены ШП. С другой стороны, ушивание фистулы явилось альтернативой технически трудновыполнимой операции [12].
С.И. Бабенко и соавт. выполнили ушивание па-рапротезной фистулы и супракоронарное протезирование аорты через 27 лет после имплантации ШП в аортальную позицию [13]. N. Piazza и J. Gregoire провели пластику трикуспидального клапана через 38 лет после митрально-аортального протезирования ШП Starr – Edwards, удовлетворительную функцию которых подтвердили данными зондирования и ЭхоКГ [14]. В клиническом наблюдении M. Amrane и соавт. через 50 лет после имплантации ШП Starr – Edwards в аортальную позицию выполнили коррекцию митрального порока двустворчатым механическим протезом в сочетании с трикуспидальной аннулопластикой опорным кольцом [15]. Это позволило значительно снизить время пережатия аорты и риск госпитальной летальности.
Гемодинамическое преимущество современных дисковых конструкций над ШП благоприятно отражается на течении послеоперационного периода и качестве жизни. С другой стороны, техническая сложность повторных многоклапанных операций сопровождается более высокой госпитальной летальностью [4]. Обсуждают роль запирательного элемента ШП в формировании турбулентных потоков крови и их влияние на расширение восходящей аорты в отдаленном периоде, ассоциированное с риском ее расслоения [16; 17].
В нашем наблюдении у пациента отсутствуют клапанозависимые осложнения на протяжении 38 лет. Результаты ЭхоКГ свидетельствуют об удовлетворительных гемодинамических показателях работы ШП, компьютерной томографии — о нормальном диаметре восходящей аорты. С учетом долгосрочного удовлетворительного функционирования ШП АКЧ-02-2 и риска его эксплантации из-за кальцино- за обоймы и узкого диаметра фиброзного кольца приняли решение о протезировании митрального и пластике трикуспидального клапанов без замены шарового протеза.
При планировании повторной операции целесообразно рассмотреть прекращение пожизненной антикоагулянтной терапии, рекомендованной для пациентов с механическими протезами клапанов сердца, и их замену на биологические. В обсуждаемой клинической ситуации возраст пациента (менее 60 лет), высокая приверженность лечению и удержание достигнутого уровня антикоагулянтной терапии длительное время позволили сделать выбор в пользу механических протезов [18].
Заключение
В клиническом наблюдении удовлетворительные гемодинамические показатели работы ШП АКЧ-02-2 и отсутствие клапанозависимых осложнений на протяжении 38 лет позволили ограничиться коррекцией сопутствующего порока без замены аортального протеза. Это сократило время операции, снизило риск интра- и послеоперационных осложнений, которые присущи повторному многоклапанному протезированию [4; 5]. Активный образ жизни пациента, удовлетворительные гемодинамические параметры при обследовании через 2 года после вмешательства подтверждают правильность выбранной тактики.
Список литературы Клинический случай протезирования митрального клапана через 38 лет после имплантации шарового протеза в аортальную позицию
- Hufnagel C.A., Harvey W.P. The surgical correction of aortic regurgitation preliminary report. Bull Georgetown Univ Med Cent. 1953;6(3):60-61. PMID: 12997885.
- Harken D.E., Taylor W.J., Lifemine A.A., Lunzer S., Low H.B., Cohen M.L., Jacobey J.A. Aortic valve replacement with a caged ball valve. Am J Cardiol. 1962;9:292-299. PMID: 13904712. https://doi.org/10.1016/0002-9149(62)90047-4
- Вербовая Т.А., Гриценко В.В., Глянцев С.П., Давыден¬ко В.В., Белевитин А.Б., Свистов А.С., Евдокимов С.В., Никифоров В.С. Отечественные механические протезы клапанов сердца (прошлое и настоящее создания и клинического применения). СПб.: Наука, 2011. [Verbovaya T.A., Gritsenko V.V., Glyantsev S.P., Davydenko V.V., Belevitin A.B., Svistov A.S., Evdokimov S.V., Nikiforov V.S. Domestic mechanical prostheses of heart valves (past and present of development and clinical application). Saint-Petersburg: Nauka Publ.; 2011. (In Russ.)]
- Casselman F.P., La Meir M., Jeanmart H., Mazzarro E., Coddens J., Van Praet F., Wellens F., Vermeulen Y., Vanermen H. Endoscopic mitral and tricuspid valve surgery after previous cardiac surgery. Circulation. 2007;116(11Suppl):I270-I275. PMID: 17846316. https://doi.org/10.1161/CIRCULATIONAHA.106.680314
- Иванов В.А., Гавриленко А.В., Мьйо С.Х., Евсеев Е.П., Айдамиров Я.А. Повторные операции на клапанах сердца (обзор литературы). Кардиология и сердечно-сосудистая хирургия. 2015;2:49-53. [Ivanov V.A., Gavrilenko A.V., M'yo S.Kh., Evseev E.P., Aydamirov Ya.A. Repeated heart valve surgery (review). Kardiologiya i Serdechno-Sosudistaya Khirurgiya = Russian Journal of Cardiology and Cardiovascular Surgery. 2015;2:49-53. (In Russ.)] https://doi.org/10.17116/kardio20158249-53
- Gao G., Wu Y., Grunkemeier G.L., Furnary A.P., Starr A. Forty-year survival with the Starr-Edwards heart valve prosthesis. J Heart Valve Dis. 2004;13(1):91-96. PMID: 14765846.
- Cannegieter S.C., Rosendaal F.R., Briët E. Thromboembolic and bleeding complications in patients with mechanical heart valve prostheses. Circulation. 1994;89(2):635-641. PMID: 8313552. https://doi.org/10.1161/01.CIR.89.2.635
- Tochii M., Takagi Y., Kaneko K., Ishida M., Akita K., Higuchi Y., Ando M. Excellent durability of Starr-Edwards ball valves implanted in the aortic and mitral positions for 27 years: report of a rare surgical case. Ann Thorac Cardiovasc Surg. 2013;19(1):76-78. PMID: 22785448. https://doi.org/10.5761/atcs.cr.11.01870
- Hatton G.E., Tanaka A., Estrera A.L. Ascending aortic aneurysm repair 44 years after Starr-Edwards caged-ball aortic valve replacement. Eur J Cardiothorac Surg. 2018;54(5):962-963. PMID: 29697781; PMCID: PMC7675331. https://doi.org/10.1093/ejcts/ezy161
- Gödje O.L., Fischlein T., Adelhard K., Nollert G., Klinner W., Reichart B. Thirty-year results of Starr-Edwards prostheses in the aortic and mitral position. Ann Thorac Surg. 1997;63(3):613-619. PMID: 9066373. https://doi.org/10.1016/s0003-4975(96)00945-9
- Tarzia V., Bottio T., Testolin L., Gerosa G. Extended (31 years) durability of a Starr-Edwards prosthesis in mitral position. Interact Cardiovasc Thorac Surg. 2007;6(4):570-571. PMID: 17669941. https://doi.org/10.1510/icvts.2006.146399
- Antończyk K., Paluszkiewicz L., Koertke H., Gummert J. Paraprosthetic leak closure 28 years after mitral caged-ball Starr-Edwards implantation. Interact Cardiovasc Thorac Surg. 2013;17(2):428-430. PMID: 23599186; PMCID: PMC3715180. https://doi.org/10.1093/icvts/ivt174
- Бабенко С.И., Муратов Р.М., Амирагов Р.И., Сачков А.С. Случай ушивания парапротезной фистулы и супракоронарного протезирования восходящей аорты через 27 лет после имплантации шарового протеза в аортальную позицию. Грудная и сердечно-сосудистая хирургия. 2012;4:48-50. [Babenko S.I., Muratov R.M., Amiragov R.I., Sachkov A.S. A case of paraprosthetic fistula closure and supracoronary replacement of the ascending aorta in 27 years after implantation of ball-valve mechanical prosthesis in aortic position. Grudnaya i Serdechno-Sosudistaya Hhirurgiya = Russian Journal of Thoracic and Cardiovascular Surgery. 2012;4:48-50. (In Russ.)]
- Piazza N., Gregoire J. Images in clinical medicines. Starr-Edwards heart valves. N Engl J Med. 2008;358(21):e24. PMID: 18499563. https://doi.org/10.1056/NEJMicm071210
- Amrane M., Soulat G., Carpentier A., Jouan J. Starr-Edwards aortic valve: 50+ years and still going strong: a case report. Eur Heart J Case Rep. 2017;1(2):ytx014. PMID: 31020072; PMCID: PMC6176978. https://doi.org/10.1093/ehjcr/ytx014
- Presbitero P., Aruta E., Rabajoli F., Agaccio G., Donegani E., Orzan F., Malara D., Di Summa M., Morea M. [Aortic dissection after aortic valve replacement: clinical and anatomic features]. G Ital Cardiol. 1992;22(8):941-947. PMID: 1478394. (In Ital.)
- Чарчян Э.Р., Белов Ю.В., Скворцов А.А., Хачатрян З.Р. Острое расслоение А-типа и гигантская аневризма восходящего отдела аорты через 32 года после протезирования аортального клапана шаровым протезом. Грудная и сердечно-сосудистая хирургия. 2015;57(5):41-45. [Charchyan E.R., Belov Yu.V., Skvortsov A.A., Khachatryan Z.R. Acute aortic dissection type a and giant ascending aortic aneurysm 32 years after aortic valve replacement using ball-cage valve prosthesis. Grudnaya i Serdechno-Sosudistaya Hhirurgiya = Russian Journal of Thoracic and Cardiovascular Surgery. 2015;57(5):41-45. (In Russ.)]
- Baumgartner H., Falk V., Bax J.J., De Bonis M., Hamm C., Holm P.J., Iung B., Lancellotti P., Lansac E., Rodriguez Muñoz D., Rosenhek R., Sjögren J., Tornos Mas P., Vahanian A., Walther T., Wendler O., Windecker S., Zamorano J.L., ESC Scientific Document Group. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2017;38(36):2739-2791. PMID: 28886619. https://doi.org/10.1093/eurheartj/ehx391


