Клинический случай распространенной, резистентной к лечению, герминогенной опухоли яичника (опухоли желточного мешка) с успешно реализованной фертильностью через 20 лет после комбинированного лечения
Автор: Ульрих Е.А., Чекина Ю.А., Сафронова К.В., Телетаева Г.М., Джарбаева А.Д., Урманчеева А.Ф.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 5 т.23, 2024 года.
Бесплатный доступ
Актуальность. Опухоли желточного мешка (ОЖМ) относятся к редким злокачественным герминогенным новообразованиям яичников, чаще всего встречающимся у молодых пациенток, заинтересованных в сохранении фертильности. Отличительными особенностями ОЖМ являются большие размеры, преимущественно односторонний характер поражения и повышенная выработка альфа-фетопротеина, который можно использовать в качестве важного диагностического критерия данного заболевания. Из всех герминогенных опухолей ОЖМ характеризуется наименее благоприятным прогнозом. Приоритетными задачами лечения ОЖМ являются не только улучшение прогноза и качества жизни, но и возможность осуществления пациенткой ее репродуктивных планов в будущем. Описание клинического случая. Представлен клинический случай агрессивного течения опухоли желточного мешка в яичнике у 15- летней девушки, потребовавшей неоднократных операций, повторных смен курсов лекарственной терапии с применением высокодозных схем и трансплантации костного мозга.
Герминогенные опухоли, опухоль желточного мешка, агрессивное заболевание, альфа-фетопротеин, сохранение фертильности, высокодозная химиотерапия, современные медицинские технологии
Короткий адрес: https://sciup.org/140307917
IDR: 140307917 | УДК: 618.341-006.04-059 | DOI: 10.21294/1814-4861-2024-23-5-176-184
Текст научной статьи Клинический случай распространенной, резистентной к лечению, герминогенной опухоли яичника (опухоли желточного мешка) с успешно реализованной фертильностью через 20 лет после комбинированного лечения
Герминогенные опухоли яичников (ГОЯ) представляют собой гистологически гетерогенную группу новообразований, происходящих из первичных зародышевых клеток (примордиальных половых клеток) эмбрионального яичника и занимающих 2-е место по частоте встречаемости среди новообразований яичников после опухолей эпителиального происхождения [1]. Примерно 95 % герминогенных опухолей яичников являются доброкачественными (зрелые тератомы), злокачественные же формы встречаются гораздо реже и, по различным данным, составляют лишь 2–3 % от числа всех злокачественных новообразований яичников [2]. Герминогенные опухоли яичников могут встречаться во всех возрастных группах, включая постменопаузальный период, однако пик заболеваемости отмечается у девочек-подростков и женщин в возрасте до 20 лет, поэтому некоторыми авторами рекомендуется в первую очередь исключать именно герминогенные опухоли яичников при обнаружении новообразования в полости малого таза у молодых девушек [3]. Ранняя диагностика и эффективное лечение имеют особенное значение у юных пациенток, так как дают возможность сохранить фертильность, улучшить общий прогноз и качество жизни [4].
Наиболее распространенными гистологическими подтипами злокачественных герминогенных опухолей являются дисгерминомы, к более редким относят незрелые тератомы, опухоли желточного мешка и смешанные опухоли зародышевых клеток; к крайне редким – эмбриональные карциномы, хориокарциномы и струму яичников (зрелую тератому яичника, которая содержит 50 % или более ткани щитовидной железы) [1, 3].
Опухоли желточного мешка (также известные как опухоли эндодермального синуса) составляют 20 % от всех злокачественных герминогенных опухолей яичников и представляют собой примитивную герминогенную опухоль, гистологически отражающую эндодермальную внеэмбриональную дифференцировку (вторичный желточный мешок и аллантоис) или, реже, эндодермальные соматические ткани (кишечник, печень и мезенхиму) [5].
Представлен клинический случай герминоген-ной опухоли яичника (опухоли желточного мешка) крайне агрессивного течения у 15-летней пациентки с неоднократными рецидивами, резистентностью к лечению, потребовавшей неоднократных операций, системной лекарственной терапии, в том числе высокодозной, с последующей аутологичной трансплантацией костного мозга, но с сохранением и дальнейшим осуществлением репродуктивной функции.
Клинический случай
Впервые пациентка Р. обратилась за медицинской помощью в 2001 г. в возрасте 15 лет по поводу болей в эпигастрии. В городской детской больнице было проведено инструментальное обследование в объеме УЗИ и МРТ органов малого таза, при котором выявлено кистозно-солидное образование, исходящее из правого яичника, локализованное в брюшной полости, размерами до 20 см (рис. 1). По данным лабораторных исследований отмечался повышенный уровень АФП – 48 000 нг/мл (N<13 Нг/мл). Показатели СА-125 и ХГЧ были в пределах референсных значений.
Пациентка была госпитализирована в детское отделение НИИ онкологии им. Н.Н. Петрова. Операция выполнена в июле 2001 г. в объеме лапаротомии, правосторонней аднексэктомии, резекции левого яичника, оментэктомии. В протоколе операции было отмечено, что «…в брюшной полости умеренное количество серозно-геморрагического выпота, правый яичник увеличен до 20 см, левый – кистозно изменен до 6 см, с однокамерной кистой; почки, забрюшинные лимфоузлы без особенностей, в большом сальнике два плотных узла до 1 см…». По результатам гистологического исследования определена опухоль эндодермального синуса правого яичника (желточного мешка) с метастазами в большой сальник.
Далее, с августа по декабрь 2001 г., пациентке проводилось 3 курса лекарственной противоопухолевой терапии по схеме «PEI»: этопозид (600 мг), цисплатин (90 мг), ифосфамид (9,6 г). После 2-го и 3-го курса осуществлялся контроль за уровнем АФП, он составлял 105 и 8,5 МЕ/мл соответственно (снижение показателя более чем в 450 и 5,5 тыс. раз от исходного), но уже по результатам от 04.12.01 АФП был равен 81,9 МЕ/мл (N<13 МЕ/мл). Отмечалось, что каждый курс полихимиотерапии (ПХТ) сопровождался развитием такого осложнения, как анорексия. В декабре 2001 г. проведен 4-й курс ПХТ по «ЕР»: этопозид 120 мг ×3 + цисплатин 30 мг ×3 (ифосфамид исключен).
Окончательный диагноз: Герминогенная опухоль яичника (опухоль желточного мешка) IIIC pT3сN0М0. Органосохраняющая операция: правосторонняя аднексэктомия, оментэктомия от июля 2001 г., ПХТ: 3 PEI и 1 EP до декабря 2001 г.
В октябре 2002 г., спустя 10 мес после первичного лечения, пациентка вновь обратилась с жалобами на боли внизу живота и его увеличение в объеме в течение 2 нед. При осмотре живот болезненный, с признаками асцита. При гинекологическом исследовании в малом тазу выявлен опухолевый конгломерат, размерами до 15 см, включающий в себя левые придатки и матку.
В ноябре 2002 г., в возрасте 16 лет, пациентка госпитализирована во взрослое онкогинекологиче-ское отделение, где выполнена повторная операция в объеме: неполная циторедукция (эвакуация асцита, ревизия, левосторонняя аднексэктомия, метастазэктомии). Из протокола операции: «…в брюшной полости и малом тазу 7 л серозной жидкости, левый яичник увеличен до 12 см, кистозносолидного строения, обнаружены опухолевые узлы от 1 до 3 см по поверхности печени, висцеральной и париетальной брюшине, в позадиматочном пространстве узел до 4 см… выполнена эвакуация асцита, удаление левого яичника, удаление отдельных париетальных метастазов…». По результатам цитологического исследования жидкости –
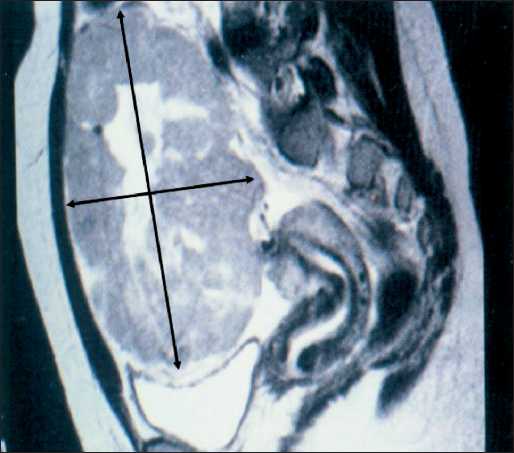
Рис. 1. МРТ органов малого таза. Дата исследования: июль 2001 г. Примечание: рисунок выполнен авторами
Fig. 1. MRI of the pelvis. Date of the study: July 2001. Note: created by the authors

Рис. 2. УЗИ органов малого таза. Дата исследования: март 2003 г. Примечание: рисунок выполнен авторами
Fig. 2. Pelvic ultrasound. Date of the study: March 2003. Note: created by the authors
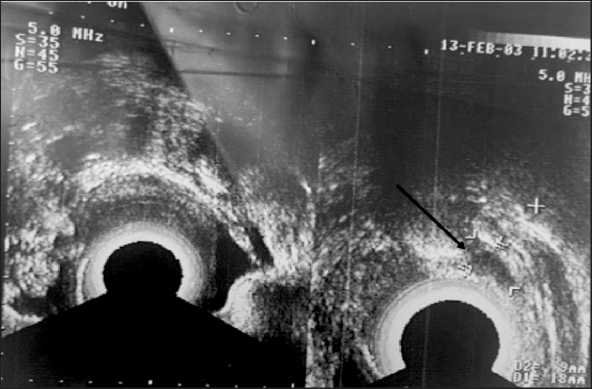
Рис. 3. УЗИ органов малого таза.
Дата исследования: февраль 2003 г. Примечание: рисунок выполнен авторами
Fig. 3. Pelvic ultrasound. Date of the study: February 2003. Note: created by the authors
комплексы опухолевых клеток. Гистологическое исследование: опухоль эндодермального синуса левого яичника с выраженными дистрофическими изменениями опухолевых клеток.
После операции проведено 5 курсов ПХТ по схеме VAC (Винкристин 1,5 мг ×2, Циклофос-фан 200 мг ×5, Актиномицин D – 0,5 ×5) до мая 2003 г. с эффектом «стабилизация». По данным УЗИ от марта 2003 г. (рис. 2): «… кзади и слева от матки уменьшение гипоэхогенного узла до 10х8 мм (положительная динамика, ранее 20х10 мм от февраля 2003 г. (рис. 3), ранее 27×25 мм от января 2003 г. (рис. 4))».
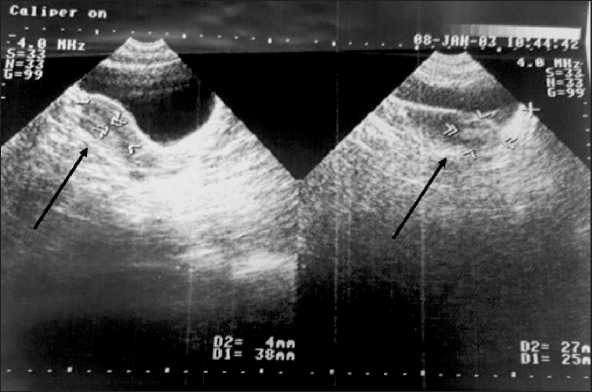
Рис. 4. УЗИ органов малого таза. Дата исследования: январь 2003 г. Примечание: рисунок выполнен авторами
Fig. 4. Pelvic ultrasound. Date of the study: January 2003. Note: created by the authors
С подозрением на прогрессирование заболевания в июне 2003 г. пациентка госпитализируется в Больницу Санта-Орсола-Мальпиги в Италии (S. Orsola-Malpighi, г. Болонья). При обследовании выявлены асцит, канцероматоз, рост опухолевого узла в позадиматочном пространстве (по данным УЗИ от июня 2003: «..кзади слева от матки на фоне жидкости визуализируется образование 38×24 мм, по эхоструктуре близко к опухолевой измененной ткани яичника» (рис. 5)). С июня по октябрь 2003 г. больной проводилось 6 курсов лекарственной противоопухолевой терапии по схеме «Цисплатин 75 мг/м2, Таксотер 75 мг/м2».
Следующим этапом в ноябре 2003 г. выполнена диагностическая лапаротомия (second-look): ревизия, удаление «остаточной опухоли в дугласовом пространстве, удаление перитонеальных очагов», множественная биопсия брюшины, тазовая и па-рааортальная лимфаденэктомия. По заключению гистологического исследования: полный патомор-мофоз, мелкие очаги сальных желез.
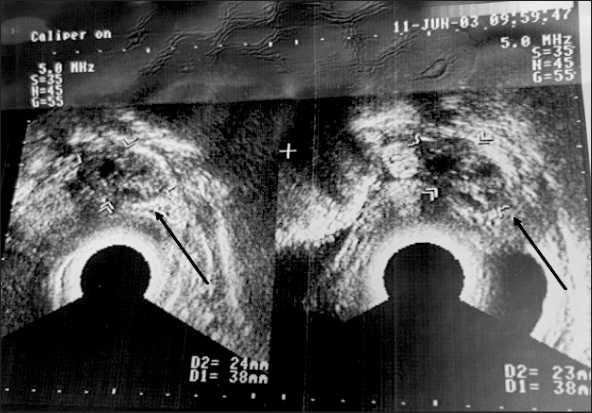
Рис. 5. УЗИ органов малого таза. Дата исследования: июнь 2003 г. Примечание: рисунок выполнен авторами Fig. 5. Pelvic ultrasound. Date of the study: June 2003. Note: created by the authors
Через 4 мес – рецидив, сопровождавшийся повышением уровня АФП. Проведено 3 курса вы-сокодозной химиотерапии по схеме «ТЕСb» (таксотер 85 мг/м2, карбоплатин (AUC 15), этопозид 900 мг/м2) с последующей аутологичной трансплантацией костного мозга. При контрольном исследовании: нормализация уровня АФП – 6 нг/мг (N<13 НГ/мл). С июня 2004 г. – полная клиническая ремиссия, на момент которой возраст пациентки – 18 лет.
Далее пациентка наблюдалась с диагнозом: Герминогенная опухоль яичника (опухоль желточного мешка) IIIC pT3cN0М0, состояние после комбинированного лечения: органосохраняющая операция – правосторонняя аднексэктомия, оментэктомия от июля 2001 г. Адъювантная ПХТ: 3PEI и 1 EP до декабря 2001 г. (б-й 15 лет). Рецидив, асцит 10.2002 г. (через 10 мес). Операция: неполная циторедукция – левосторонняя аднексэктомия, метастазэктомия от декабря 2002 г., ПХТ: 5 циклов VAC до 05.2003 г. Прогрессирование. 06.2003 г. ПХТ: 6 ТР (таксотер, цисплатин), операция (second-look) от ноября 2003 г. Рецидив 03.2004 г. 3 цикла высокодозной ПХТ TECb, с последующей трансплантацией ау- тологичных гемопоэтических стволовых клеток (06.2004). Клиническая ремиссия.
В 2014 г. (через 10 лет лечения) в возрасте 26 лет пациентка обратилась в ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» для обследования, по результатам которого не выявлено признаков рецидива заболевания, не обнаружено противопоказаний к реализации фертильности с помощью ВРТ с гормональной гиперстимуляцией. В связи с субъективными опасениями рецидива и отсутствием необходимости беременности пациентка только в 2023 г., в возрасте 35 лет (через 19 лет после лечения злокачественной опухоли яичника), впервые обратилась к репродуктологам с целью реализации фертильности. По направлению репро-дуктологов обратилась за повторной консультацией онкологов в ФГБУ «НМИЦ им. В.А. Алмазова», которые не выявили противопоказаний к беременности. Из гинекологического анамнеза: menarche с 13 лет. Беременности – 0. Диагноз: Бесплодие I. Показатели АМГ (12.2022) 0,2 нг/мл. Затем проведены процедуры подготовки к ЭКО. Аспирация ооцитов невозможна ввиду отсутствия фолликулов яичника. Для подготовки эндометрия применены эстрогены по программе ВРТ. Выполнено ЭКО донорской яйцеклеткой. Дата переноса – май 2023 г.: 5-дневный эмбрион. Повторно консультирована врачом-онкологом уже с «положительным» тестом от июня 2023. Противопоказаний для беременности и родов нет.
Пациентка в I триместре беременности обратилась к акушеру-гинекологу перинатального центра ФГБУ «НМИЦ им. В.А. Алмазова». По данным I и II скрининговых УЗИ: определяется один живой плод. Врожденные аномалии развития не выявлены. Учитывая высокий риск ВТЭО (RCOG, 2015), пациентке после консультации врачом-гематологом ФГБУ «НМИЦ им. В.А. Алмазова» было показано введение низкомолекулярных гепаринов, как их профилактики с 28-й нед гестации и до родов.
Абсолютных противопоказаний для родоразре-шения через естественные родовые пути не было, однако беременность завершилась путем операции кесарева сечения в феврале 2024 г. по акушерским показаниям в ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет», патологий новорожденного выявлено не было. Послеродовый период протекал без осложнений.
Обсуждение
Опухоли желточного мешка (ОЖМ) яичника, также известные как опухоли эндодермального синуса, представляют собой редкие образования (менее 1 % всех случаев рака яичников), встречающиеся преимущественно у девочек-подростков и женщин репродуктивного возраста [1–4].
Генетические мутации, лежащие в основе этих новообразований, на данный момент изучены не до конца. В исследовании X. Zong et al. [6] с целью понимания ключевых молекулярных аберраций ОЖМ провели секвенирование всего экзома и РНК на 41 клиническом образце опухолей от 30 пациентов с ОЖМ, среди которых были как хи-миочувствительные, так и химиорезистентные пациенты, у которых возник рецидив заболевания в течение шести месяцев после первоначального лечения. Полученные результаты показали, что двумя наиболее часто мутирующими генами являются KIT и KRAS. Кроме того, для ОЖМ оказались характерны редкие мутации TP53, а потенциальными генами-драйверами могут являться ампли-фицированные ZNF217, CDKN1B. Авторы также полагают, что химиорезистентность ОЖМ была связана с микросателлитной нестабильностью, а сверхэкспрессия OVOL2 потенциально играет роль в резистентности к цисплатину посредством влияния на опухолевый апоптоз.
Как правило, к одним из первых симптомов ОЖМ относится наличие боли в животе, острый характер которой в редких случаях может приводить к необходимости экстренного хирургического вмешательства [7]. Другими клиническими проявлениями могут быть: асцит, вздутие живота, лихорадка и аномальные маточные кровотечения, что может свидетельствовать о высокой степени злокачественности новообразования [8].
В большинстве описанных случаев ОЖМ имеют большие размеры (от 5 до 50 см), легко определяемые при пальпации в полости малого таза в проекции придатков с одной стороны – двусторонние образования встречаются редко [7, 8]. Для инструментальной диагностики ОЖМ используют такие методы, как УЗИ, КТ или МРТ, с помощью которых возможно визуализировать как само образование, распространяющееся в брюшную полость, так и отдаленные метастазы [9].
С целью изучения сонографических признаков ОЖМ P. Anfelter et al. [10] проведено ретроспективное многоцентровое исследование, включавшее 21 пациентку с гистологически подтвержденным диагнозом ОЖМ яичников и имевшую данные трансвагинального УЗИ. После описания с помощью терминологии IOTA авторы выяснили, что чаще всего новообразования являлись односторонними, крупными, многокамерно-солидными или солидными с мелкозернистой слабогиперэхоген-ной солидной тканью и богатой васкуляризацией. Кроме этого, опухоли желточного мешка могут иметь очаги кровоизлияний, разрывы капсулы и расширенные внутриопухолевые сосуды [9].
Опухоли желточного мешка ассоциированы с повышенной выработкой альфа-фетопротеина, благодаря чему этот уникальный маркер является важным диагностическим критерием и параметром мониторинга опухолей желточного мешка, а его высокая специфичность позволяет предположить диагноз ОЖМ даже до гистологического подтверждения и, следовательно, предварительно планировать объем хирургического вмешательства у молодых женщин [11].
В настоящее время, согласно практическим рекомендациям RUSSCO и Ассоциации онкологов России, первым этапом лечения злокачественных ГОЯ является хирургическое вмешательство, предпочтительно лапаротомным доступом [12], с последующей адъювантной химиотерапией [13]. Объем лечения зависит от стадии заболевания, которая определяется по тем же критериям, что и при эпителиальных опухолях яичников [12, 13].
Важной задачей лечения пациенток репродуктивного возраста является сохранение фертильности. Односторонняя сальпингоофорэктомия, взятие смывов брюшины и тщательный осмотр брюшной полости считаются адекватными процедурами для сохранения потенциала фертильности, что подтверждают данные ретроспективного исследования лечения герминогенных опухолей яичников I стадии, проведенного в Великобритании, в котором проанализированы результаты наблюдения за 86 пациентками, лечившимися в 4 крупных гинекологических онкологических центрах страны в течение 12 лет [14]. Общая 5-летняя выживаемость составила 96,6 %, 5-летняя безрецидивная выживаемость – 81,8 %, при этом авторы отмечают, что хирургическое стадирование не влияло на данные показатели вне зависимости от гистологического типа опухоли.
Оментэктомия не повышала выживаемость и не влияла на фертильность и в другом ретроспективном многоцентровом исследовании с участием 268 пациенток с клинически ранними (I, II) злокачественными герминогенными опухолями яичников, 187 (69,8 %) из которых была проведена резекция сальника [15]. По результатам работы коэффициенты беременности и живорождения составили 80,3 и 66,7 % соответственно.
В то же время отсутствие хирургического стадирования относилось к одному из факторов, влияющих на рецидив заболевания (помимо гистологического типа опухоли, отсроченного или неадекватного лечения и наличия остаточной опухоли) [16]. Авторы провели ретроспективный анализ влияния клинико-патологических и связанных с лечением факторов на выживаемость пациенток со злокачественными ГОЯ. Среди 253 пациенток, проходивших лечение с 2000 по 2019 г., 5-летняя безрецидивная выживаемость составила 71,3 %, а 5-летняя общая выживаемость – 88,1 %. В то же время среди пациенток, получивших своевременное и адекватное лечение, выживаемость составила 91,0 % по сравнению с 78,3 % у пациенток, у которых лечение было неполным или отсроченным.
Золотым стандартом химиотерапии первой линии является схема с блеомицином, этопозидом и цисплатином (BEP), в то же время схема EP (этопозид и цисплатин) может рассматриваться у пациентов с противопоказаниями к блеомицину или его непере- носимостью [17]. Ввиду высокой, потенциально опасной для жизни, токсичности схемы BEP, способной приводить к развитию легочного фиброза, гипертонии, необратимым повреждениям слуха, хронической болезни почек, феномену Рейно и вторичным онкологическим заболеваниям, C. Newton et al. [18] изучена возможность назначения схем пониженной токсичности, применяемых в педиатрической практике, – с использованием более низких дозировок препаратов либо заменой цисплатина карбоплатином (схема JEB: карбоплатин, этопозид и блеомицин). Данное крупное многоцентровое когортное исследование проводилось в 4 крупных онкологических центрах Великобритании в течение 12 лет и включало 138 пациенток с герминогенными опухолями яичников, в том числе и с ОЖМ (n=23). Авторы показали высокие уровни выживаемости, снижение рецидивов/прогрессирования заболевания и возможность безопасно избегать платиносодержащую химиотерапию на I стадии.
Также с целью изучения возможности применения исключительного хирургического лечения J. Y . Park et al. [19] осуществлен ретроспективный анализ данных 31 пациентки со злокачественными ГОЯ I стадии, которым проводилось только сохраняющее фертильность хирургическое вмешательство с последующим наблюдением. По результатам работы у 7 (22,6 %) пациенток развился рецидив заболевания, что потребовало повторного оперативного лечения с последующей химиотерапией по схеме BEP. По данным авторов, 10-летняя без-рецидивная выживаемость составила 77 %, а общая 10-летняя выживаемость – 97 %.
С целью изучения долгосрочных прогнозов применения BEP в Японии T. Kojimahara et al. [20] провели на данный момент крупнейшее в стране ретроспективное многоцентровое исследование для изучения прогностических факторов у 33 пациенток с ОЖМ, из которых 73 % получали лечение по схеме BEP в качестве адъювантной химиотерапии. Данные авторов указывают на то, что эффективность химиотерапии BEP у молодых японских пациенток сопоставима с эффективностью химиотерапии у пациенток европеоидной расы. В данной работе 5-летняя выживаемость при стадии I или II составила 100 %, при стадии III или IV – 72 %. Для пациенток на стадиях I–III 5-летняя выживаемость составила 91 %. Кроме того, из 28 пациенток, перенесших операцию по сохранению фертильности, информация о сохранении менструальной функции была доступна у 24 пациенток, 20 (83 %) из которых были потенциально фертильными, а у 3 (11 %) из них 5 беременностей завершились рождением живых детей. К основным прогностическим факторам благоприятных исходов авторы отнесли стадию заболевания, диаметр опухоли и остаточные образования, минимизация которых улучшает прогноз.
Выживаемость и репродуктивные исходы у молодых женщин с поздними стадиями заболева- ния оценивали J.Y. Park et al. [21]. В исследование включена 171 пациентка, каждой из которых была проведена операция по сохранению фертильности. В результате 5-летняя безрецидивная выживаемость для стадии I составила 84 %, для стадии II–IV – 89 %; 5-летняя общая выживаемость для I стадии составила 99 %, для II–IV стадий – 91 %. Репродуктивно-акушерские исходы удалось оценить у 124 пациенток, 20 из которых планировали беременность. В 15 (75 %) случаях удалось добиться 21 беременности, 13 (65 %) пациенток родили 20 здоровых детей.
В 2017 г. D. Nasioudis et al. [22] провели анализ Национальной базы данных рака США, где представлена наибольшая когорта женщин с диагнозом ОЖМ, и пришли к выводу, что лучшая 5-летняя выживаемость наблюдалась у подростков (94,4 %) и молодых женщин (89,3 %), в особенности у тех, кто получал адъювантную химиотерапию. Помимо этого, не выявлено различий в общей выживаемости между женщинами, перенесшими гистерэктомию, и женщинами, которые от нее отказались (87,1 vs 94,4 % соответственно), что делает сохранение матки возможным у пациенток, заинтересованных в будущей фертильности [23]. Помимо этого, по данным литературы, уровень бесплодия среди женщин, пытающихся зачать ребенка после лечения злокачественных ГОЯ, колеблется от 5 до 10 %, что соответствует фоно- вому уровню заболеваемости бесплодием среди здоровой популяции [24].
Список литературы Клинический случай распространенной, резистентной к лечению, герминогенной опухоли яичника (опухоли желточного мешка) с успешно реализованной фертильностью через 20 лет после комбинированного лечения
- Euscher E.D. Germ Cell Tumors of the Female Genital Tract. Surg Pathol Clin. 2019; 12(2): 621-49. https://doi.org/10.1016/j.path.2019.01.005.
- Reid B.M., Permuth J.B., Sellers T.A. Epidemiology of ovarian cancer: a review. Cancer Biol Med. 2017; 14(1): 9-32. https://doi.org/10.20892/j.issn.2095-3941.2016.0084.
- Solopova A.E., Sologub Yu.N., Makatsariya A.D., Ternovoi S.K. Germinogennye opukholi yaichnikov - sovremennye podkhody k diagnostike. Akusherstvo i ginekologiya. 2016; 12: 28-33. https://doi.org/10.18565/aig.2016.12.28-33.
- Dantkale K.S., Agrawal M. A Comprehensive Review of Current Trends in the Diagnosis and Treatment of Ovarian Germ Cell Tumors. Cureus. 2024; 16(1). https://doi.org/10.7759/cureus.52650.
- Soft Tissue and Bone Tumours: WHO Classifcation of Tumours (Medicine). 5th Edition, Vol. 3. World Health Organization, 2020.
- Zong X., Zhang Y., Peng X., Cao D., Yu M., Wang J., Li H., Guo X., Liang H., Yang J. Analysis of the genomic landscape of yolk sac tumors reveals mechanisms of evolution and chemoresistance. Nat Commun. 2021; 12(1): 3579. https://doi.org/10.1038/s41467-021-23681-0.
- Stefanelli E., Talarico V., Scavone M., Carboni E., Stranieri G., Galati M.C., Salerno D., Raiola G. Acute abdominal pain in an adolescent girl with an ovarian yolk sac tumor. Acta Biomed. 2019; 90(4): 599-602. https://doi.org/10.23750/abm.v90i4.9017.
- Safdar N.S., Stall J.N., Young R.H. Malignant Mixed Germ Cell Tumors of the Ovary: An Analysis of 100 Cases Emphasizing the Frequency and Interrelationships of Their Tumor Types. Am J Surg Pathol. 2021; 45(6): 727-41. https://doi.org/10.1097/PAS.0000000000001625.
- Radswiki T., Baba Y., Weerakkody Y., et al. Ovarian yolk sac tumor. [Internet]. Reference article. Radiopaedia.org. https://doi.org/10.53347/rID-15285. URL: https://radiopaedia.org/articles/ovarian-yolk-sac-tumour [cited 2024 Mar 22].
- Anfelter P., Testa A., Chiappa V., Froyman W., Fruscio R., Guerriero S., Alcazar J.L., Mascillini F., Pascual M.A., Sibal M., Savelli L., Zannoni G.F., Timmerman D., Epstein E. Imaging in gynecological disease (17): ultrasound features of malignant ovarian yolk sac tumors (endodermal sinus tumors). Ultrasound Obstet Gynecol. 2020; 56(2): 276-84. https://doi.org/10.1002/uog.22002. Erratum in: Ultrasound Obstet Gynecol. 2020; 56(6): 966. https://doi.org/10.1002/uog.23526.
- Eddaoualline H., Sami H., Rais H., Belbaraka R., El Omrani A., Khouchani M. Ovarian Yolk Sac Tumor: A Case Report and Literature Review. Clin Case Rep Int. 2018; 2: 1057.
- Neepitelial'nye opukholi yaichnikov. Klinicheskie rekomendatsii. Odobreno na zasedanii nauchno-prakticheskogo soveta Ministerstva zdravookhraneniya Rossiiskoi Federatsii (protokol ot 20.12.2019 g. №10/2-3-4). 2020. 71 s.
- Gutorov S.L., Novikova E.G., Rumyantsev A.A., Tryakin A.A., Tyulyandina A.S., Urmancheeva A.F., Khokhlova S.V. Zlokachestvennye neepitelial'nye opukholi yaichnikov: prakticheskie rekomendatsii. Chast' 1. Zlokachestvennye opukholi. 2023; 13(3s2-1): 216-34. https://doi.org/10.18027/2224-5057-2023-13-3s2-1-216-234.
- Graham R., MacDonald N.D., Lockley M., Miller R., Butler J., Murali K., Sarker S.J., Banerjee S., Stoneham S., Shamash J., Liberale V., Berney D.M., Newton C. Surgical management and outcomes for stage 1 malignant ovarian germ cell tumours: A UK multicentre retrospective cohort study. Eur J Obstet Gynecol Reprod Biol. 2022; 271: 138-44. https://doi.org/10.1016/j.ejogrb.2022.02.013.
- Liu P., Li Z., Cheng X., Gao Q., Che Y., Zhang Z., Chu R., Chen Z., Zhang Y., Wang Q., Dou Z., Wei Y., Cui Z., Wang J., Xie X., Ma D., Yang X., Kong B., Song K. Assessment of prognostic and reproductive outcomes of omentectomy for patients with clinically apparent early-stage (I, II) malignant ovarian germ cell tumours: A multicentre retrospective study. BJOG. 2022; 129(s2): 23-31. https://doi.org/10.1111/1471-0528.17325.
- Pallavi V.R., Kansal Y., Rathod P.S., Shobha K., Kundargi R., Bafna U.D., Devi U., Vijay C.R. Impact of Optimal Therapy and Prognostic Factors in Malignant Germ Cell Tumors of Ovary: 20 Years’ Institutional Experience. Indian J Surg Oncol. 2022; 13(3): 633-40. https://doi.org/10.1007/s13193-022-01537-3.
- Uccello M., Boussios S., Samartzis E.P., Moschetta M. Systemic anti-cancer treatment in malignant ovarian germ cell tumours (MOGCTs): current management and promising approaches. Ann Transl Med. 2020; 8(24): 1713. https://doi.org/10.21037/atm.2020.04.15.
- Newton C., Murali K., Ahmad A., Hockings H., Graham R., Liberale V., Sarker S.J., Ledermann J., Berney D.M., Shamash J., Banerjee S., Stoneham S., Lockley M. A multicentre retrospective cohort study of ovarian germ cell tumours: Evidence for chemotherapy de-escalation and alignment of paediatric and adult practice. Eur J Cancer. 2019; 113: 19-27. https://doi.org/10.1016/j.ejca.2019.03.001.
- Park J.Y., Kim D.Y., Suh D.S., Kim J.H., Kim Y.M., Kim Y.T., Nam J.H. Outcomes of Surgery Alone and Surveillance Strategy in Young Women With Stage I Malignant Ovarian Germ Cell Tumors. Int J Gynecol Cancer. 2016; 26(5): 859-64. https://doi.org/10.1097/IGC.0000000000000702.
- Kojimahara T., Nakahara K., Takano T., Yaegashi N., Nishiyama H., Fujimori K., Sato N., Terada Y., Tase T., Yokoyama Y., Mizunuma H., Shoji T., Sugiyama T., Kurachi H. Yolk sac tumor of the ovary: a retrospective multicenter study of 33 Japanese women by Tohoku Gynecologic Cancer Unit (TGCU). Tohoku J Exp Med. 2013; 230(4): 211-7. https://doi.org/10.1620/tjem.230.211.
- Park J.Y., Kim D.Y., Suh D.S., Kim J.H., Kim Y.M., Kim Y.T., Nam J.H. Analysis of outcomes and prognostic factors after fertility-sparing surgery in malignant ovarian germ cell tumors. Gynecol Oncol. 2017; 145(3): 513-8. https://doi.org/10.1016/j.ygyno.2017.03.023.
- Nasioudis D., Chapman-Davis E., Frey M.K., Caputo T.A., Holcomb K. Management and prognosis of ovarian yolk sac tumors; an analysis of the National Cancer Data Base. Gynecol Oncol. 2017; 147(2): 296-301. https://doi.org/10.1016/j.ygyno.2017.08.013.
- Nasioudis D., Frey M.K., Chapman-Davis E., Caputo T.A., Holcomb K. Fertility-preserving surgery for advanced stage ovarian germ cell tumors. Gynecol Oncol. 2017; 147(3): 493-6. https://doi.org/10.1016/j.ygyno.2017.10.010.
- Di Tucci C., Casorelli A., Morrocchi E., Palaia I., Muzii L., Panici P.B. Fertility management for malignant ovarian germ cell tumors patients. Crit Rev Oncol Hematol. 2017; 120: 34-42. https://doi.org/10.1016/j.critrevonc.2017.10.005.


