Клинический случай успешного лечения больного раком пищевода IV стадии
Автор: Хмелевская Валентина Николаевна, Исаев Павел Анатольевич, Гунько Иван Романович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 4 т.18, 2019 года.
Бесплатный доступ
Актуальность. Рак пищевода (РП) находится в первой десятке опухолей с высокой летальностью. В большинстве случаев на момент постановки диагноза уже имеется III-IV стадия опухолевого процесса. Лечение больных с распространенным опухолевым процессом - чрезвычайно сложная задача, для решения которой используется лучевая терапия в сочетании с химиотерапией. В клинике Медицинского радиологического научного Центра им. А.Ф. Цыба при лечении больных распространенным раком пищевода применяется методика дробления укрупненной дневной дозы (2,5 Гр) на 2 фракции (1-1,5 Гр) с интервалом между фракциями 4 ч. Больные значительно легче переносят лечение, а эффект реканализации пищевода и уменьшение боли при проглатывании пищи наступают значительно раньше, чем при конвенциональном облучении. Описание клинического случая. Больной обратился в МРНЦ им. А.Ф. Цыба в феврале 2015 г с жалобами на осиплость голоса и нарушение проходимости пищи. В результате комплексного обследования установлен диагноз рак шейного отдела пищевода с метастазами в лимфатические узлы шеи и в щитовидную железу T4N2M1, стеноз пищевода IV степени, протяженность опухоли 7,5 см. Опухоль признана неоперабельной, больному было рекомендовано лучевое лечение с паллиативной целью, выполнена гастростомия. Проведена лучевая терапия опухоли и метастазов в статическом режиме с 3 полей: с двух боковых размером 6*11 см и переднего поля 12*11 см 5 раз в неделю с дроблением дневной дозы. Суммарная очаговая доза составила 60 Гр. Получен полный положительный эффект лечения. Через 2 мес больному проведены 3 курса двухкомпонентной химиотерапии. В январе 2016 г. выполнена тиреоидэктомия с микрохирургическим невролизом гортанных нервов. Больной находится под наблюдением 3 года 7 мес после лечения, жалоб не предъявляет. Заключение. Применение нестандартных режимов фракционирования лучевой терапии в сочетании с химиотерапией позволяет получить удовлетворительные результаты лечения больных с распространенным раком пищевода.
Рак пищевода, комбинированное лечение, лучевая терапия, химиотерапия
Короткий адрес: https://sciup.org/140254269
IDR: 140254269 | УДК: 616.329-006.6-08-059 | DOI: 10.21294/1814-4861-2019-18-4-106-111
Текст научной статьи Клинический случай успешного лечения больного раком пищевода IV стадии
Рак пищевода (РП), составляющий не более 2–3 % в структуре онкологической заболеваемости в России, находится в первой десятке опухолей с высокой летальностью [1, 2]. На протяжении 2003–13 гг. абсолютное число выявленных случаев рака пищевода в Российской Федерации в среднем составило около 7500 ежегодно [3]. Сложность выявления рака пищевода заключается в том, что на ранних стадиях он никак себя не проявляет. Часто симптомы «малых признаков» остаются не замеченными пациентами. Больные обращаются за медицинской помощью лишь при нарушении проходимости пищи, когда опухоль занимает 50–75 % просвета пищевода [3]. Больные раком пищевода, – как правило, люди в возрасте 50–60 лет, имеющие тяжелые сопутствующие заболевания, кроме того, к моменту начала лечения III–IV стадия процесса имеется у 65–75 % пациентов. Поэтому около 70 % больных умирают в течение первого после установления диагноза года, 5-летняя выживаемость не превышает 4–25 % [4, 5]. Больные РП IV стадии составляют 32 % среди всех впервые выявленных опухолей пищевода, одногодичная летальность у них достигает 70,7 % [6].
Основным методом радикального лечения больных РП является хирургический. Однако результаты лечения в значительной степени зависят от протяженности опухоли. После хирургического лечения опухоли протяженностью более 6 см число осложнений и послеоперационная летальность увеличиваются в 2 раза [7]. К моменту установления диагноза 40–60 % пациентов уже не подлежат хирургическому лечению [8]. Оперативное вмешательство возможно лишь у 15–20 % больных с впервые установленным диагнозом. Так как в большинстве первичных случаев имеются опухоли протяженностью более 6 см и отдаленные метастазы, этим больных проводится консервативное лечение [9]. В последние годы все шире внедряется метод брахитерапии, которая применяется при раке грудного отдела пищевода, отличается высокой эффективностью и в 70 % случаев приводит к уменьшению дисфагии, а в 80 % случаев к достижению объективного ответа. Добавление к дистанционной лучевой терапии брахитерапии в дозе 14–15 Гр за 2–3 фракции без увеличения риска осложнений привело к росту двухлетней выживаемости с 12 до 36 % [10].
Используемая в последнее десятилетие реканализация стенозированного опухолью пищевода (аргоноплазменная коагуляция) с последующей сочетанной лучевой терапией обеспечивает выраженный клинический эффект у 79,5 % пациентов. У 89,3 % больных была восстановлена возможность перорального питания [11]. При этом 1-годичная выживаемость составляет 68,9 %, при сочетанной лучевой терапии – 58,8 %, двухлетняя выживаемость – 22,7 и 21,2 % соответственно.
Лучевая терапия является важной составляющей в лечении рака пищевода. Однако вопросы о способах и дозах лучевой терапии до последнего времени являются предметом дискуссии. Увеличение СОД выше 50 Гр не улучшает результаты лечения рака пищевода [10]. Оптимизацией лучевой терапии может быть использование нетрадиционных режимов фракционирования дозы излучения. Так, на основании анализа эффективности лучевой терапии 357 больных раком пищевода при различных вариантах ее проведения сделан вывод о том, что более высокие результаты лечения дает лучевая терапия в сочетанном варианте с брахитерапией и с локальной СВЧ-гипертермией. Облучение опухоли при гиперфракционном режиме также повышает результаты по сравнению с традиционным режимом [12].
В клинике Медицинского радиологического научного Центра им. А.Ф. Цыба при лечении больных распространенным раком пищевода применяется методика дробления укрупненной дневной дозы (2,5 Гр) на 2 фракции (1–1,5 Гр) с интервалом между фракциями 4 ч. Больные зна- чительно легче переносят лучевую терапию при дроблении дневной дозы, и эффект реканализации пищевода наступает значительно раньше, чем при конвенциональном облучении. Лечение по этой методике в сочетании с химиотерапией достаточно часто дает хорошие результаты. В качестве примера приводим историю болезни больного раком пищевода, получившего лечение в МРНЦ им. А.Ф. Цыба в 2015–16 гг.
Больной Ч., 1969 г.р., обратился на консультацию в клинику МРНЦ 04.02.15 с жалобами на осиплость голоса, кашель при проглатывании пищи, нарушение проходимости пищи, потерю веса на 8 кг. Со слов больного, в течение месяца беспокоит осиплость голоса и нарушение проходимости твердой пищи. Был обследован амбулаторно по месту жительства, но диагноз установить не удалось, поэтому был госпитализирован в Тульскую областную больницу 14.01.15, где при обследовании выявлена неоперабельная опухоль пищевода (гистологическое заключение (№ Г 870/15 от 09.02.15): плоскоклеточный рак с наклонностью к ороговению).
На консультации в МРНЦ им. А.Ф. Цыба из-за осиплости голоса больной был направлен к ЛОР-врачу. При осмотре на шее под шейным отделом трахеи была выявлена опухоль мягко-эластической консистенции размером 5×8 см, которая смещала трахею вперед и влево. На шее с двух сторон пальпировались лимфатические узлы. При фонации имелась ограниченная подвижность правой половины гортани. На основании этих данных больной госпитализирован в клинику МРНЦ 04.02.15 под наблюдение ЛОР-врача с предварительным диагнозом рак шейного отдела пищевода, метастазы в регионарные лимфатические узлы. Цитологическое заключение по пунктату лимфоузлов шеи (№ 545/15, 09.02.15): метастазы плоскоклеточного рака.
По данным КТ шеи с уровня воронки пищевода определяется дополнительное образование неоднородной структуры мягкотканной плотности максимальным поперечным размером 58×35 мм, протяженностью до 7,5 см (рис. 1). На фоне описанного образования просвет пищевода не визуализируется. Образование плотно прилежит к задней стенке трахеи, к задним поверхностям щитовидной железы, нельзя исключить вовлечения в процесс правой доли щитовидной железы. Общие сонные артерии прилежат к наружному краю образования. По ходу сосудистых пучков шеи определяются лимфатические узлы справа до 35×18 мм. КТ картина соответствует опухолевому образованию шейного отдела пищевода; увеличены лимфатические узлы шеи справа.
Больной направлен на консультацию в микрохирургическое отделение института им. П.А. Герцена для решения вопроса о целесообразности и возможности оперативного лечения. По заключению консилиума с учетом морфологии и распространения опухолевого процесса сТ4N2М0 необходимый объем хирургического лечения: ларингэктомия, тиреоидэктомия с возможной экстирпацией пищевода, двусторонней лимфаденэктомией, трахеостомией и гастростомией – не улучшит выживаемость пациента, целесообразнее провести химиолучевую терапию.
Больной переведен в радиологическое отделение 15.02.15 для курса лучевой терапии, где с целью уточнения распространенности опухолевого процесса проведена рентгенография пищевода (рис. 2), по данным которой в верхней трети пищевода определяется дефект наполнения, обусловленный неравномерной опухолевой инфильтрацией, протяженностью около 11 см, преимущественно по правой стенке нижележащие сегменты без особенностей. Заключение: опухолевое поражение верхней трети пищевода (трахеальный сегмент).
Бронхоскопия (16.02.15): голосовая щель асимметрична, правая половина гортани неподвижна при фонации. Элементы гортани хорошо дифференцируются. Подскладочный отдел, трахея, карина не изменены. При осмотре бронхов 1–2 порядка с обеих сторон органических изменений не выявлено. Заключение: правосторонний паралич гортани.
Под контролем УЗИ 19.02.15 выполнена пункция правой доли щитовидной железы. Цитологическое заключение (№ 752, 20.02.15): комплексы плоскоклеточного рака с наклонностью к ороговению.
Таким образом, установлен диагноз рак шейного отдела пищевода с метастазами в лимфатические узлы шеи и в щитовидную железу сТ4N2M1. Стеноз IV степени.
Проведена подготовка к лучевой терапии: СКТ-топометрия опухоли шеи с расчетом физикотехнических условий облучения и контролем полей облучения на симуляторе SLS-9. С 16.02.15 начата лучевая терапия опухоли пищевода с РОД 1,5 Гр, затем 2,5 Гр с дроблением дневной дозы на две фракции (1–1,5 Гр) 5 раз в нед. Несмотря на проведение лучевой терапии, нарастал стеноз пищевода. Встал вопрос о необходимости гастростомы. Лучевая терапия прекращена на СОД 9 Гр. 20.02.15 выполнена лапароскопически-ассистированная гастростомия. С 24.02.15 продолжена лучевая терапия. Лечение проводилось в статическом режиме с трех полей: с двух боковых, размером 6×11 см, и переднего поля, размером 12×11 см, 5 раз в нед. Суммарная очаговая доза составила 60 Гр.
В процессе лучевой терапии у больного стала восстанавливаться проходимость пищевода, больной начал принимать пищу естественным путем – сначала жидкую, затем кашицеобразную. К концу курса лучевой терапии он мог проглатывать жидкие каши, супы. В удовлетворительном состоянии был выписан из отделения. По данным контрольной рентгенографии через 2 мес после окончания лечения опухоль в пищеводе не определя- ется (рис. 3). Заключение: полный положительный эффект лечения.
Повторно больной госпитализирован в клинику МРНЦ им. А.Ф. Цыба в мае 2015 г. с диагнозом рак шейного отдела пищевода Т4bN1М1. Метастазы в лимфатические узлы шеи с двух сторон, правой паратрахеальной и надключичной областей, левой претрахеальной области. Метастазы в щитовидную железу. Стеноз 4 степени. Гастростомия 20.02.15. Лучевая терапия опухоли пищевода СОД 60 Гр. Практически полная регрессия новообразования пищевода.
При поступлении пациент жалоб не предъявляет, пищу принимает естественным путем, гастростомой не пользуется, проходимость пищевода хорошая. Значительно прибавил вес и озабочен этим, занимается спортом, чтобы похудеть. Настаивает на закрытии гастростомы, но по решению консилиума закрытие гастростомы отложено на 2–3 мес.
Контрольная СКТ шеи и органов грудной полости (21.05.15): отмечается стабилизация процесса по сравнению с данными обследования от 23.04.15; ранее описанные лимфатические узлы по ходу сосудистых пучков шеи сохраняются в прежних размерах (справа – до 8 мм, слева – до 6 мм), локализации и количестве. Новых увеличенных лимфатических узлов шеи нет. Образование на уровне воронки пищевода четко не определяется, максимальные поперечные размеры воронки пищевода прежние – 25×15 мм. Просвет пищевода (ниже воронки) дифференцируется четко. Очаговых и инфильтративных образований в легочной ткани обоих легких не выявлено. Увеличенных лимфоузлов в средостении не определяется. Заключение: новообразование шейного отдела пищевода без динамики. СКТ данных за прогрессирование опухолевого процесса не получено (рис. 4).
Для решения вопроса о целесообразности оперативного лечения пациент направлен на консультацию в институт им. П.А. Герцена. Решение консилиума: хирургическое лечение в настоящий момент нецелесообразно в связи с изначальной распространенностью опухолевого процесса. Пациенту рекомендовано химиотерапевтическое лечение по месту жительства по схеме: карбоплатин (АUC 6), паклитаксел (75 мг/м2), 3 курса с интервалом 21 день, с контрольным обследованием. Проведена химиотерапия: паклитаксел в дозе 330 мг + карбоплатин – 750 мг.
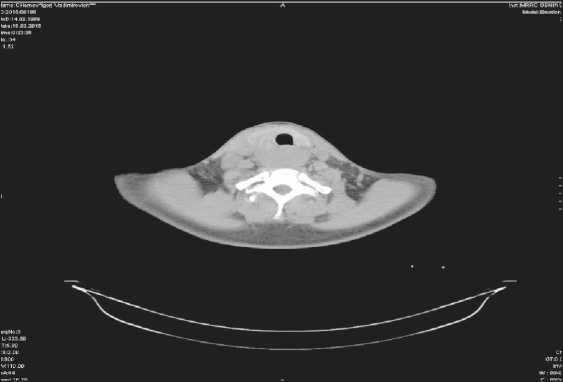
Рис.1. СКТ органов шеи с внутривенным контрастным усилением. Дата исследования 05.02.15
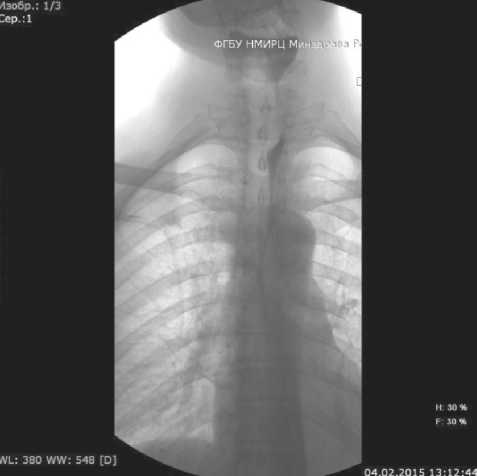
Рис.2. Обзорная рентгенограмма органов грудной клетки. Дата исследования 04.02.15
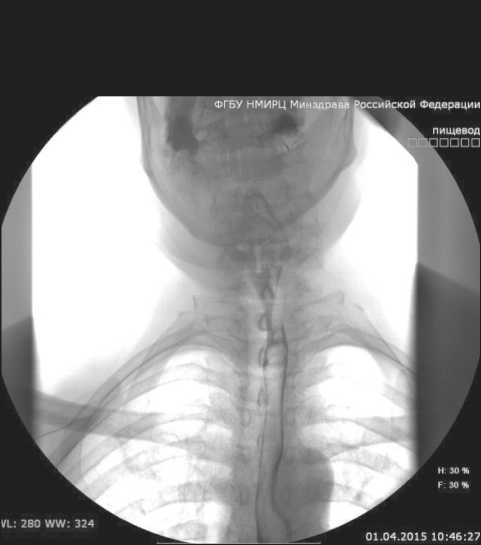
Рис. 3. Рентгенограмма пищевода. Дата исследования апрель 2015 г.
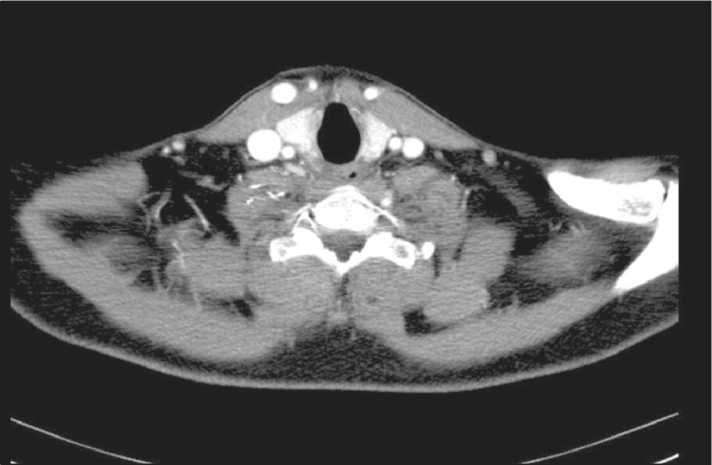
Рис. 4. СКТ шеи и органов грудной полости. Дата исследования 21.05.15
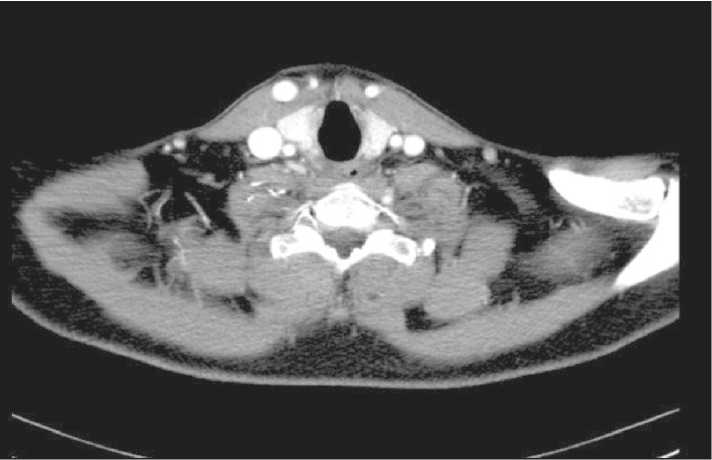
Рис. 5. СКТ органов шеи и грудной клетки с внутривенным контрастированием. Дата исследования 13.07.15
В июле 2015 г. на осмотре в клинике МРНЦ им. А.Ф. Цыба больной жалоб не предъявляет. Состояние удовлетворительное. Пищу принимает через рот, гастростомой не пользуется. Проходимость пищевода хорошая. Настаивает на закрытии гастростомы.
На серии КТ шеи и грудной клетки (13.07.15) по сравнению с данными обследования от 21.05.15 дополнительных образований, участков патологического накопления контрастного вещества в области начального отдела пищевода, увеличенных лимфатических узлов на шее, в верхнем средостении не определяется (рис. 5). Очаговых изменений в легких не выявлено. Заключение: КТ-данных за рецидив или прогрессирование опухолевого процесса не получено. Выполнено закрытие гастростомы 23.07.15. Послеоперационный период без осложнений. Больной выписан из стационара в удовлетворительном состоянии.
При контрольном обследовании 21.12.15 по данным УЗИ выявлено образование в щитовидной железе. Под УЗ-контролем выполнена тонкоигольная аспирационная биопсия. Цитологическое заключение (№ 5625, 21.12.15): плоскоклеточный рак. Больной госпитализирован в радиологическое отделение. Рентгенография органов грудной клетки (13.01.16): пищевод и кардия не изменены.
Признаков опухоли в верхней трети пищевода нет. Заключение: полная регрессия опухоли пищевода. СКТ органов шеи (11.01.16): по сравнению с данными обследования от 13.07.15 дополнительных образований, участков патологического накопления контраста в области начального отдела пищевода, увеличенных лимфатических узлов на шее не определяется. В области перешейка щитовидной железы определяется округлое, мягкотканное образование с неровными, четкими контурами, накапливающее контраст меньше, чем неизмененная ткань щитовидной железы, размерами 9×14 мм. Увеличенных лимфатических узлов, дополнительных образований в верхнем средостении нет. Заключение: образование в перешейке щитовидной железы. СКТ органов грудной полости (12.01.16): в легких и лимфатических узлах средостения патологических образований не выявлено.
Проведен консилиум для определения тактики дальнейшего лечения (13.01.16), на котором принято решение провести хирургическое лечение, объем которого будет определен во время операции.
Больной переведен в отделение радиохирургического лечения закрытыми радионуклидами. 19.01.16 выполнена тиреоидэктомия с микрохирургическим невролизом гортанных нервов. Селективная шейная диссекция. Послеоперационный период протекал без осложнений. На 8-е сут после операции больной был выписан из отделения.
Гистологическое заключение по операционному материалу (19.01.16): к ткани щитовидной железы прилежат два лимфатического узла с метастазами плоскоклеточного неороговевающего рака. На отдельных участках отмечается рост опухоли за пределы узлов и врастание ее в ткань железы. В жировой клетчатке, присланной отдельно, 5 лимфатических узлов, в 3 из которых метастазы аналогичного рака.
Дальнейшее наблюдение больного проводилось амбулаторно. На протяжении 2017–18 гг. проводилось комплексное обследование (с интервалом 1 раз в 3 мес), включающее визуальный осмотр, УЗИ шеи, ФГДС, СКТ шеи, грудной и брюшной полостей, анализы крови (клинический, биохимический, ТТГ, СЕА). При динамическом наблюдении признаков прогрессирования заболевания не выявлено. При телефонном контакте 14.09.18, пациент жалоб не предъявляет, работает и занимается спортом. Продолжительность наблюдения составляет 3 года 7 мес.
Таким образом, анализируя представленный клинический случай, следует отметить, что с помощью нестандартной методики лучевой терапии в сочетании с химиотерапией и последующего оперативного вмешательства, выполненного по поводу метастазов первичной опухоли, удалось получить удовлетворительные результаты лечения рака пищевода IV стадии.
Список литературы Клинический случай успешного лечения больного раком пищевода IV стадии
- Чиссов В.В., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2008 году (заболеваемость и смертность). М., 2010. 250
- Мерабишвили В.М. Динамика показателей деятельности онкологической службы Санкт-Петербурга по районам города в 2007-2009 г. СПб., 2010. 35
- Мельникова О.А. Рак пищевода: клиническая картина и стадирование заболевания. Практическая онкология. 2003; 4(2): 66-69
- Соколов В.В., Павлов П.В., Чиссов В.И., Вашакмадзе Л.А., Бойко А.В. Методы реканализации и стентирования при стенозирующем раке пищевода, желудка и 12-перстной кишки (обзор литературы). Сибирский онкологический журнал. 2012; 5: 64-73
- Стилиди И.С., Бохян В.Ю., Тер-Ованесов М.Д. Результаты и перспективы хирургического лечения больных раком грудного отдела пищевода. Практическая онкология. 2003; 4(2); 70-75


