Клинический случай успешного лечения инфекции COVID-19 в дебюте В-клеточного острого лимфобластного лейкоза
Автор: Александрова Туйара Никоновна, Мулина Инна Ивановна, Ядрихинская Вера Николаевна, Прядезникова Алина Михайловна, Санникова Анна Николаевна, Парфенова Светлана Николаевна, Соловьева Ирина Еремеевна, Терехова Лена Дмитриевна, Григорьев Геннадий Иванович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 6 т.20, 2021 года.
Бесплатный доступ
Актуальность. Новая коронавирусная инфекция в настоящий момент представляет глобальную угрозу. Больные онкологическими заболеваниями представляют группу риска инфицирования новой коронавирусной инфекцией, а также тяжелого течения и высокой летальности. Описание клинического случая. Представлен опыт лечения больного молодого возраста, у которого одновременно диагностированы новая коронавирусная инфекция и В-клеточный острый лимфобластный лейкоз. После верификации морфологического и иммунофенотипического варианта лейкоза была начата программная терапия по протоколу «ОЛЛ-2009» на фоне противовирусных, антибактериальных препаратов и заместительной терапии иммуноглобулинами. Развившаяся на фоне цитостатического лечения нейтропения привела к резкому ухудшению состояния с прогрессированием поражения легких и дыхательной недостаточности, что потребовало отмены введения цитостатических препаратов и перевода в отделение анестезиологии, реанимации и интенсивной терапии. Далее в условиях реанимационного отделения продолжена терапия дексаметазоном, а также массивная антибактериальная, противогрибковая терапия. В связи с увеличением поражения легких до 75 % и нарастанием дыхательной недостаточности начата неинвазивная вентиляция легких. На фоне проведенных мероприятий достигнута клинико-гематологическая ремиссия с восстановлением показателей гемограммы и последующим регрессом пневмонии. Однако наблюдалась длительная персистенция вируса в организме, в связи с чем тактика лечения острого лимфобластного лейкоза была пересмотрена. По рекомендации федерального центра пациент был переведен на поддерживающую терапию меркаптопурином и метотрексатом. После элиминации вируса на 56-й день от инициального положительного теста программная терапия продолжена согласно протоколу «ОЛЛ-2009». Заключение. Тактика лечения больных онкологическими заболеваниями, в том числе гемобластозами, в период пандемии должна подбираться индивидуально с оценкой потенциальной пользы и риска развития жизнеугрожающих осложнений.
Острый лимфобластный лейкоз, covid-19, инфекционные осложнения
Короткий адрес: https://sciup.org/140261346
IDR: 140261346 | УДК: 616.155.392+616.9]-08 | DOI: 10.21294/1814-4861-2021-20-6-151-157
Текст научной статьи Клинический случай успешного лечения инфекции COVID-19 в дебюте В-клеточного острого лимфобластного лейкоза
Новая коронавирусная инфекция (COVID-19), представляющая в настоящий момент глобальную угрозу, впервые зарегистрирована в конце декабря 2019 г. в провинции Ухань, Китай. Первые случаи «пневмонии неизвестной этиологии» характеризовались лихорадкой ≥ 38 °С, рентгенологическими признаками пневмонии, низким/ нормальным количеством лейкоцитов, лимфопенией и отсутствием ответа на стандартную антибактериальную терапию [1]. Секвенирование генома вируса, выделенного из бронхоальвеолярного лаважа больных с атипичной пневмонией, позволило идентифицировать новую коронавирусную инфекцию, названную 2019-nCoV [2]. Впоследствии Международный комитет по таксономии вирусов классифицировал новую коронавирусную инфекцию как SARS-CoV-2 [3]. С марта 2020 г. инфекция носит характер пандемии, затронувшей более 200 стран. По официальным данным, в настоящее время количество инфицированных лиц по всему миру превышает 120 млн, летальных исходов – 2 млн [4]. Больные онколо- гическими заболеваниями представляют группу риска инфицирования COVID-19 вследствие иммуносупрессивного состояния, вызванного как основным заболеванием, так и противоопухолевым лечением [5]. Кроме того, доказано, что среди больных онкологическими заболеваниями выше риск тяжелого течения заболевания и летальных исходов [6].
Представляем клинический случай успешного одновременного лечения COVID-19 и впервые выявленного В-клеточного острого лимфобластного лейкоза.
Мужчина, 29 лет, считает себя больным с 15 сентября 2020 г., когда впервые во время командировки за пределы России стали беспокоить общая слабость и головокружение. 22.09.20 во время обследования у терапевта выявлены бла-стоз периферической крови (лейкоциты – 13 × 109/л, бласты – 79 %), анемия тяжелой степени (эритроциты – 0,71 × 1012/л, гемоглобин – 26 г/л) и тромбоцитопения (тромбоциты – 42 × 109/л). Экстренно госпитализирован в терапевтическое отделение, где была проведена гемотрансфузион- ная симптоматическая терапия. Далее пациент направлен на обследование и лечение по месту жительства.
На первичном приеме у гематолога по месту жительства (5.10.20) сохраняются жалобы на выраженную слабость, головокружение, появились одышка при малейшей физической нагрузке и снижение остроты зрения. В гемограмме выявлены лейкопения – 2,6 × 109/л (бласты – 43 %, палочкоядерные нейтрофилы – 3 %, сегментоядерные нейтрофилы – 5 %, лимфоциты – 48 %, моноциты – 1 %), анемия тяжелой степени (эритроциты – 1,01 × 1012/л, гемоглобин – 25 г/л, гематокрит – 6,8 %), нарастание тромбоцитопении до 8 × 109/л. Пациент в экстренном порядке госпитализирован в обсервационное отделение, с предварительным забором мазков из рото- и носоглотки на исследование РНК SARS-CoV-2 методом обратной транскриптазно-полимеразной цепной реакции (ОТ-ПЦР). При поступлении состояние тяжелое (по шкале ECOG – 3), отмечались тяжелый анемический, геморрагический синдромы и лихорадка без видимых очагов инфекции. При осмотре: желтушность кожных покровов, петехиальные геморрагические высыпания на нижних конечностях, повышение температуры тела до 37,5 °С, тахипноэ до 22 в мин и тахикардия до 110 в мин. В первые сутки госпитализации на основании данных морфологического, иммунофенотипическо-го анализов костного мозга верифицирован диагноз В-клеточного острого лимфобластного лейкоза (В-ОЛЛ), ранний пре-В вариант с подчелюстной, подмышечной, паховой лимфаденопатией и ге-патоспленомегалией. По данным миелограммы на фоне гипоклеточного пунктата отмечается увеличение числа бластных клеток до 21,5 % с редукцией нормальных ростков кроветворения. В биохимическом анализе крови выявлено повышение уровня ЛДГ до 776,8 Ед/л (норма – 0–250), ферри- тина до 542,87 мкг/л (норма – 20–250). Уровень С-реактивного белка (СРБ) в пределах референсных значений. Стандартное цитогенетическое исследование костного мозга выявило моносомию по хромосоме 8 и 20 в размере трех метафазных пластинок, а также моносомию по хромосомам Y, 7, 11, 16 в единичном варианте. Транслокация (9; 22) методом флуоресцентной гибридизации in situ (FISH) не обнаружена. Цитоз в ликворе – 1 кл/мкл. При осмотре глазного дна выявлено преретиналь-ное кровоизлияние слева. В тот же период получен положительный результат ПЦР на COVID-19 со значением порогового цикла (Сt) 20,81, свидетельствующим о высокой вирусной нагрузке. По данным КТ от 5.10.20 на момент госпитализации свежих очаговых и инфильтративных изменений в легких не выявлено.
С 07.10.20, согласно рекомендациям гематологии Минздрава России, больному начата предфаза по протоколу ОЛЛ-2009 с дексаметазоном в дозе 10 мг/м2. При этом введение химиопрепаратов (даунорубицин, винкристин) рекомендовано начать с 15-го дня протокола. Одновременно, согласно актуальной версии временных методических рекомендаций Министерства здравоохранения РФ «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)» (версия 8.1 от 01.10.20), инициирована терапия COVID-19 препаратом фавипиравир, эмпирическая антибактериальная терапия (цефоперазон/сульбак-там) [7]. Проводились внутривенное введение иммуноглобулина, трансфузии компонентов крови и профилактика тромботических осложнений. На фоне проведенных мероприятий достигнута стойкая нормализация температуры тела.
На 5-й день предфазы наблюдалось развитие лейкопении до 0,9 × 109/л с абсолютным числом нейтрофилов 0,4 × 109/л (рис. 1). На 8-й день протокола по результатам контрольной миелограм-
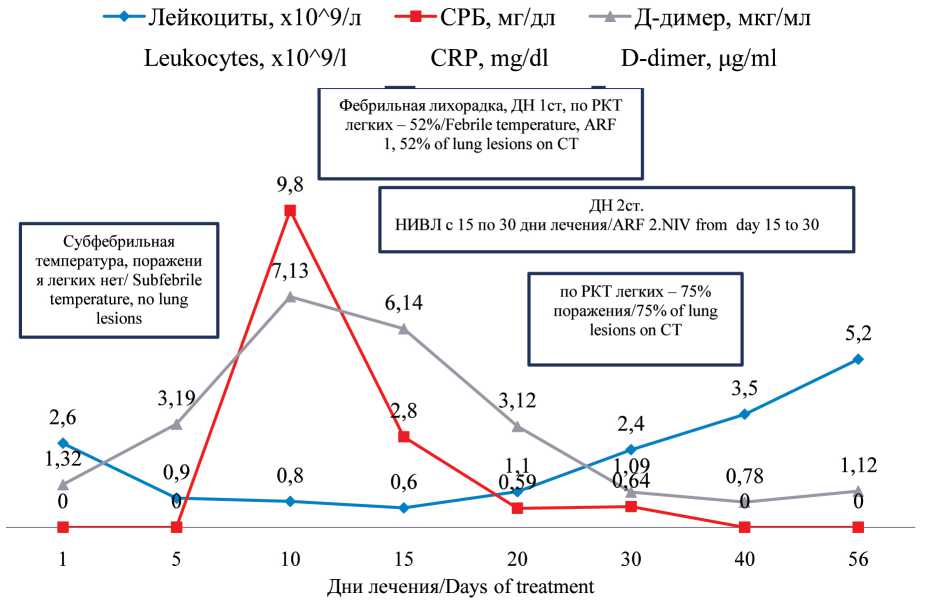
Рис. 1. Динамика клиниколабораторных показателей на фоне лечения. Примечания: СРБ – С-реактивный белок; РКТ – рентгеновская компьютерная томография; ДН – дыхательная недостаточность;
НИВЛ – неинвазивная искусственная вентиляция легких Pic. 1. Dynamic changes of clinical and laboratory findings during treatment. Notes: СRP – С-reactive protein; СT – computed tomography;
АRF – acute respiratory failure; NІV – non-invasive ventilation
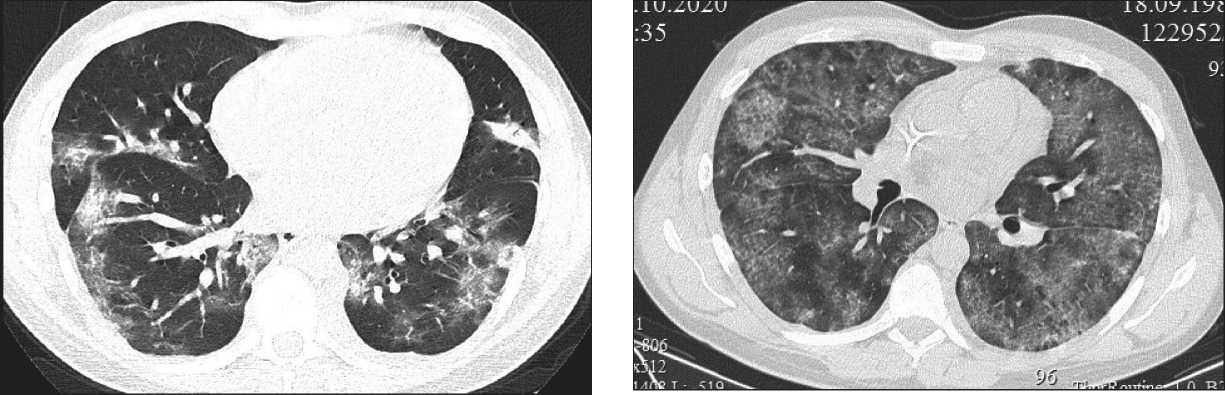
Рис. 2. РКТ легких от 17.10.20
Pic. 2. СT of the chest performed 17.10.20
мы сохраняется бластная инфильтрация костного мозга до 48 %. В дальнейшем на фоне развившейся нейтропении отмечается ухудшение состояния – появление фебрильной лихорадки, сухого кашля и признаков дыхательной недостаточности (ДН) (тахипноэ до 24 в мин, снижение сатурации кислорода (SpO2) до 93–95 %). ПЦР на SARS-CoV-2 от 16.10.20 – положительный. На 13-й день (18.10.20) от инициального положительного теста по данным КТ легких выявлены обширные сливные зоны уплотнения легочной ткани по типу матового стекла с признаками утолщения внутридолько-вого интерстиция с объемом поражения – 52 % (рис. 2). В общем анализе крови – трехростковая цитопения (лейкоциты – 0,8 × 109/л, гемоглобин – 74 г/л, тромбоциты – 37 × 109/л). Наблюдается повышение уровней маркеров воспаления: ферритин – 697,44 мкг/л, СРБ – 9,80 мг/дл (норма – 0–0,5). Коагулограмма: протромбиновый индекс – 78,87 %, фибриноген 18,05, МНО 1,20, протромбиновое время – 13,40, АЧТВ – 27,20 сек, Д-димер – 7,48 мкг/мл, антитромбин-III – 108 %. Уровень ЛДГ – 582,90 Ед/л. Микробиологические исследования из различных локусов не выявили роста патологической флоры. Учитывая отрицательную динамику, введение химиопрепаратов (даунорубицин, винкристин) на 15-й день отменено, продолжена терапия дексаметазоном и профилактика нейролейкоза. Кроме того, в связи с высокой вероятностью присоединения бактериальной и грибковой инфекции эскалирована противомикробная терапия – меропенем в комбинации с микафунгином. Дополнительно проведена трансфузия 1 дозы антиковидной плазмы и начата кислородная поддержка увлажненным кислородом через биназальные канюли. Несмотря на проведенные мероприятия, отмечалось прогрессирование ДН, обусловленное острым респираторным дистресс-синдромом (ОРДС). Появилась одышка в покое с частотой дыхательных движений (ЧДД) до 30 в мин, рвота съеденной пищей, носовое кровотечение. Зафиксированы снижение SpO2 до 80 %
Рис. 3. РКТ легких от 27.10.20
Pic. 3. СT of the chest performed 27.10.20
на фоне инсуффляции увлажненного кислорода, тахикардия до 124 в мин и повышение АД до 150/88 мм рт. ст. В связи с прогрессирующей ДН 20.10.20. пациент переведен в отделение анестезиологии, реанимации и интенсивной терапии, где начата неинвазивная искусственная вентиляция легких (НИВЛ).
На фоне проведенных мероприятий отмечается нормализация температуры тела и уровня СРБ, однако сохраняется ДН, требующая проведения НИВЛ. По данным РКТ легких от 27.10.20 отмечено прогрессирование поражения легких до 75 %, появление двустороннего плеврального выпота и выпота в полости перикарда (рис. 3). ПЦР на SARS-CoV-2 от 27.10.20 – положительный. В связи с выявленной отрицательной динамикой к лечению эмпирически добавлен ванкомицин.
С 03.11.20 отмечается постепенное восстановление показателей периферической крови с регрессом ДН и отменой НИВЛ. По результатам контрольной миелограммы (11.11.20) констатировано достижение клинико-гематологической ремиссии (бластные клетки – 1,25 %). 15.11.20 в связи с клиническим улучшением завершен курс антибактериальной, противогрибковой терапии, однако наблюдалась длительная персистенция вируса SARS-CoV-2 в пробах из рото- и носоглотки. В качестве возможной терапевтической тактики обсуждался вопрос повторной трансфузии антиковидной плазмы, однако 25.11.20 у пациента выявлена выработка антител к SARS-CoV2 (IgM – 15,07, IgG – 16,83), в связи с чем принято решение продолжить программную терапию ОЛЛ.
Больной повторно консультирован в НМИЦ гематологии Минздрава России, рекомендовано начало поддерживающей терапии меркаптопурином в дозе 25 мг/м2/день внутрь ежедневно, метотрексат – 30 мг/м2 внутривенно 1 раз в нед. Поддерживающая терапия начата 17.11.20, 30.11.20 впервые получен отрицательный результат ПЦР на SARS-CoV-2. На контрольной КТ легких (11.12.20) отмечено уменьшение ранее
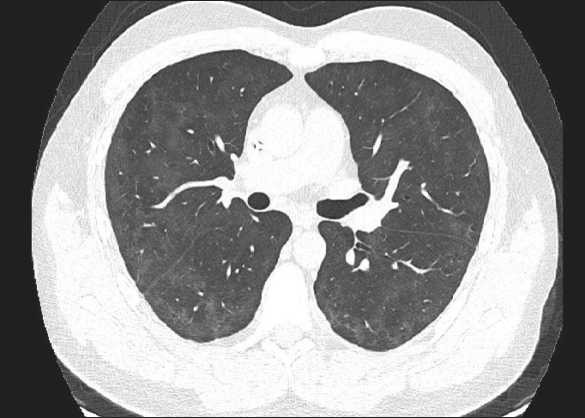
Рис. 4. РКТ легких от 11.12.20
Pic. 4. СT of the chest performed 11.12.20
выявляемых воспалительных изменений (рис. 4), с 16.12.20 пациенту продолжена терапия в соответствии с протоколом ОЛЛ-2009 с I фазы индукции ремиссии.
Обсуждение
Данное клиническое наблюдение описывает случай длительной персистенции вируса SARS-CoV-2 у больного В-клеточным ОЛЛ в течение 56 дней с момента инициального положительного теста. Клинические симптомы, наблюдавшиеся в дебюте (повышение температуры тела, слабость, одышка), были неспецифическими, характерными как для COVID-19, так и для острого лейкоза.
Тактика индукционной терапии ОЛЛ на фоне активной COVID-19 инфекции должна определяться индивидуально. К сожалению, на сегодняшний день единых рекомендаций по выбору режима химиотерапии не существует. В описанном клиническом случае на момент диагностики двух конкурирующих заболеваний инфекция COVID-19 протекала без поражения легких, поэтому принято решение инициировать программную терапию по протоколу ОЛЛ-2009. Однако в дальнейшем наблюдалось прогрессирующее ухудшение состояния с развитием двусторонней полисегментарной пневмонии и ОРДС, что потребовало отмены программной химиотерапии.
Согласно литературным данным, среднее время вирусовыделения в общей популяции составляет 18,4 дня [8], однако случаи отсроченной элиминации вируса не являются редкими [9–11]. Больные онкологическими заболеваниями, в том числе гемобластозами, представляют группу риска тяжелого течения COVID-19. Установлено, что показатели смертности онкогематологических больных превышают аналогичные показатели в общей популяции почти в 4 раза. По результатам многоцентрового ретроспективного когортного исследования (n=536) продемонстрировано, что у онкогематологических больных в 50 % случаев наблюдалось средне тяжелое течение COVID-19, в 36 % – тяжелое и в 14 % – крайне тяжелое [12]. Кроме того, дисфункция иммунной системы у этой группы больных создает условия для длительной репликации вируса [11]. В крупномасштабном итальянском исследовании продемонстрировано, что длительность выделения вируса прямо коррелирует с уровнем вирусной нагрузки на момент первичного тестирования [13]. К другим факторам, ассоциированным с длительным вирусовыделе-нием, относят тяжелое течение заболевания [8], высокую лихорадку и лечение глюкокортикостероидами [14].
Дексаметазон является важным компонентом лечения ОЛЛ. Европейское общество по трансплантации костного мозга при лечении больных ОЛЛ с конкурирующей COVID-19 инфекцией рекомендует назначение адекватных доз ГКС, особенно на этапах предфазы, индукции и консолидации ремиссии [15]. С одной стороны, применение дексаметазона у данного больного в краткие сроки позволило стабилизировать показатели периферической крови, уменьшить объем трансфузионной поддержки, а в дальнейшем было констатировано становление клинико-гематологической ремиссии. С другой – длительное применение ГКС, вероятно, является одним из факторов риска длительной персистенции вируса [16] и присоединения бактериальной и/или грибковой инфекции. Тем не менее с восстановлением уровня лейкоцитов отмечены четкая тенденция к клиническому улучшению и снижение уровня острофазовых маркеров воспаления.
Заключение
Применение адекватных доз дексаметазона у больных с впервые выявленным ОЛЛ и активной инфекцией COVID-19 тяжелого течения может являться основой для дальнейшей системной химиотерапии.
Список литературы Клинический случай успешного лечения инфекции COVID-19 в дебюте В-клеточного острого лимфобластного лейкоза
- Li Q., Guan X., Wu P., Wang X., Zhou L., Tong Y., Ren R., Leung K.S.M., Lau E.H.Y., Wong J.Y., Xing X., Xiang N., Wu Y., Li C., Chen Q., Li D., Liu T., Zhao J., Liu M., Tu W., Chen C., Jin L., Yang R., Wang Q., Zhou S., Wang R., Liu H., Luo Y., Liu Y., Shao G., Li H., Tao Z., Yang Y., Deng Z., Liu B., Ma Z., Zhang Y., Shi G., Lam T.T.Y., Wu J.T., Gao G.F., Cowling B.J., Yang B., Leung G.M., Feng Z. Early Transmission Dynamics in Wuhan, China, of Novel Coronavirus-Infected Pneumonia. N Engl J Med. 2020 Mar 26; 382(13): 1199–1207. doi: 10.1056/NEJMoa2001316.
- Zhu N., Zhang D., Wang W., Li X., Yang B., Song J., Zhao X., Huang B., Shi W., Lu R., Niu P, Zhan F., Ma X., Wang D., Xu W., Wu G., Gao G.F., Tan W.; China Novel Coronavirus Investigating and Research Team. A Novel Coronavirus from Patients with Pneumonia in China, 2019. N Engl J Med. 2020 Feb 20; 382(8): 727–33. doi: 10.1056/NEJMoa2001017.
- Coronaviridae Study Group of the International Committee on Taxonomy of Viruses. The species Severe acute respiratory syndrome-related coronavirus: classifying 2019-nCoV and naming it SARS-CoV-2. Nat Microbiol. 2020 Apr; 5(4): 536–44. doi: 10.1038/s41564-020-0695-z.
- Каприн А.Д., Гамеева Е.В., Поляков А.А., Корниецкая А.Л., Рубцова Н.А., Феденко А.А. Влияние пандемии COVID-19 на онкологическую практику. Сибирский онкологический журнал. 2020; 19(3): 5–22. [Kaprin A.D., Gameeva E.V., Polyakov A.A., Kornietskaya A.L., Rubtsova N.A., Feden-ko A.A. Impact of the COVID-19 pandemic on the oncological practice. Siberian Journal of Oncology. 2020; 19(3): 5–22. (in Russian)]. doi: 10.21294/1814-4861-2020-19-3-5-22.
- Liang W., Guan W., Chen R., Wang W., Li J., Xu K., Li C., Ai Q., Lu W., Liang H., Li S., He J. Cancer patients in SARS-CoV-2 infection: a nationwide analysis in China. Lancet Oncol. 2020 Mar; 21(3): 335–7. doi: 10.1016/S1470-2045(20)30096-6.
- Shimozaki K., Nakayama I., Takahari D. A Practical Approach to the Management of Patients with Gastrointestinal Cancer during the Novel Coronavirus Disease 2019(COVID-19)Pandemic-What Can Medical Oncologists Do? Gan To Kagaku Ryoho. 2021 Aug; 48(8): 1000–6.
- Временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)» Версия 8.1 (дата обращения: 01.10.2020). URL: https://static-0.minzdrav.gov.ru/system/attachments/attaches/000/052/219/original/Временные_МР_COVID-19_ %28v.8.1 %29.pdf?1601561462. [Temporary guidelines «Prevention, diagnosis and treatment of new coronavirus infection (COVID-19)» Version 8.1 URL: https://static-0.minzdrav.gov.ru/system/attachments/attaches/000/052/219/original/Временные_МР_COVID-19_%28v.8.1 %29.pdf?1601561462. (cited 01.10.2020). (in Russian)].
- Fontana L.M., Villamagna A.H., Sikka M.K., McGregor J.C. Understanding viral shedding of severe acute respiratory coronavirus virus 2 (SARS-CoV-2): Review of current literature. Infect Control Hosp Epidemiol. 2021 Jun; 42(6): 659–68. doi: 10.1017/ice.2020.1273.
- Wang J., Hang X., Wei B., Li D., Chen F., Liu W., Yang C., Miao X., Han L. Persistent SARS-COV-2 RNA positivity in a patient for 92 days after disease onset: A case report. Medicine (Baltimore). 2020 Aug 21; 99(34): e21865. doi: 10.1097/MD.0000000000021865.
- Li N., Wang X., Lv T. Prolonged SARS-CoV-2 RNA shedding: not a rare phenomenon. J Med Virol. 2020 Nov; 92: 2286–7. DOI:10.1002/jmv.25952.
- Avanzato V.A., Matson M.J., Seifert S.N., Pryce R., Williamson B.N., Anzick S.L., Barbian K., Judson S.D., Fischer E.R., Martens C., Bowden T.A., de Wit E., Riedo F.X., Munster V.J. Case Study: Prolonged Infectious SARS-CoV-2 Shedding from an Asymptomatic Immunocompromised Individual with Cancer. Cell. 2020 Dec 23; 183(7): 1901–12.e9. doi: 10.1016/j.cell.2020.10.049.
- Passamonti F., Cattaneo C., Arcaini L., Bruna R., Cavo M., Merli F., Angelucci E., Krampera M., Cairoli R., Della Porta M.G., Fracchiolla N., Ladetto M., Gambacorti Passerini C., Salvini M., Marchetti M., Lemoli R., Molteni A., Busca A., Cuneo A., Romano A., Giuliani N., Galimberti S., Corso A., Morotti A., Falini B., Billio A., Gherlinzoni F., Visani G., Tisi M.C., Tafuri A., Tosi P., Lanza F., Massaia M., Turrini M., Ferrara F., Gurrieri C., Vallisa D., Martelli M., Derenzini E., Guarini A., Conconi A., Cuccaro A., Cudillo L., Russo D., Ciambelli F., Scattolin A.M., Luppi M., Selleri C., Ortu La Barbera E., Ferrandina C., Di Renzo N., Olivieri A., Bocchia M., Gentile M., Marchesi F., Musto P., Federici A.B., Candoni A., Venditti A., Fava C., Pinto A., Galieni P., Rigacci L., Armiento D., Pane F., Oberti M., Zappasodi P., Visco C., Franchi M., Grossi P.A., Bertù L., Corrao G., Pagano L., Corradini P.; ITA-HEMACOV Investigators. Clinical characteristics and risk factors associated with COVID-19 severity in patients with haematological malignancies in Italy: a retrospective, multicentre, cohort study. Lancet Haematol. 2020 Oct; 7(10): e737–e745. doi: 10.1016/S2352-3026(20)30251-9.
- Danzetta M.L., Amato L., Cito F., Di Giuseppe A., Morelli D., Savini G., Mercante M.T., Lorusso A., Portanti O., Puglia I., Monaco F., Casaccia C., Di Gennaro A., Testa L., Migliorati G., D'Alterio N., Calistri P. SARS-CoV-2 RNA Persistence in Naso-Pharyngeal Swabs. Microorganisms. 2020 Jul 26; 8(8): 1124. doi: 10.3390/microorganisms8081124.
- Li T.Z., Cao Z.H., Chen Y., Cai M.T., Zhang L.Y., Xu H., Zhang J.Y., Ma C.H., Liu Y., Gao L.J., Duan Z.H., Mou D.L., Liang L.C. Duration of SARS-CoV-2 RNA shedding and factors associated with prolonged viral shedding in patients with COVID-19. J Med Virol. 2021 Jan; 93(1): 506–12. doi: 10.1002/jmv.26280.
- Brissot E., Labopin M., Baron F., Bazarbachi A., Bug G., Ciceri F., Esteve J., Giebel S., Gilleece M.H., Gorin N.C., Lanza F., Peric Z., Ruggeri A., Sanz J., Savani B.N., Schmid C., Shouval R., Spyridonidis A., Versluis J., Nagler A., Mohty M. Management of patients with acute leukemia during the COVID-19 outbreak: practical guidelines from the acute leukemia working party of the European Society for Blood and Marrow Transplantation. Bone Marrow Transplant. 2021 Mar; 56(3): 532–5. doi: 10.1038/s41409-020-0970-x.
- Phillips L., Pavisic J., Kaur D., Dorrello N.V., Broglie L., Hijiya N. Successful management of SARS-CoV-2 acute respiratory distress syndrome and newly diagnosed acute lymphoblastic leukemia. Blood Adv. 2020 Sep 22; 4(18): 4358–61. doi: 10.1182/bloodadvances.2020002745.


