Клинический случай успешного лекарственного лечения аденокарциномы пищевода IV стадии
Автор: Сергеева А.В., Васильев В.Ю., Батов С.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 2 т.21, 2022 года.
Бесплатный доступ
Введение. Аденокарцинома пищевода часто диагностируется на поздних стадиях. При метастатическом процессе общая пятилетняя выживаемость составляет менее 15 %, основным методом лечения является лекарственная терапия. Продолжается поиск новых лекарственных средств. Поэтому актуальна оценка эффективности существующих опций лечения. Описание клинического случая. Представлено клиническое наблюдение успешного применения трастузумаба в поддерживающем режиме, после 4 циклов химиотерапии и 3 циклов в комбинации с трастузумабом у пациента 45 лет с распространенным раком пищевода, с поражением лимфоузлов малой сальниковой сумки, средостения и подключичных лимфоузлов. После 25 циклов поддерживающей терапии наблюдается стабилизация процесса. На данный момент пациент ведет активный образ жизни, без симптомов болезни. Значимых нежелательных явлений, связанных с применением препарата, не отмечено. Заключение. Современные достижения клинической онкологии позволили обеспечить эффективное лечение распространенной аденокарциномы пищевода с использованием трастузумаба при гиперэкспрессии белка HER2. Представленный клинический случай демонстрирует не только возможность контроля метастатического процесса с помощью таргетной терапии, но и сохранение высокого уровня качества жизни.
Аденокарцинома пищевода, таргетная терапия, трастузумаб, экспрессия her2
Короткий адрес: https://sciup.org/140293520
IDR: 140293520 | УДК: 616.329-006.66-08
Текст научной статьи Клинический случай успешного лекарственного лечения аденокарциномы пищевода IV стадии
Несмотря на достижения в хирургическом, химиолучевом и лекарственном лечении, рак пищевода (РП) считается одним из самых агрессивных новообразований желудочно-кишечного тракта. В 2020 г. в мире выявлено около 604 000 новых случаев РП (7-е место по заболеваемости) и 544 000 смертей (6-е место по общей смертности). Около 70 % случаев РП встречается у мужчин. Географические показатели заболеваемости существенно различаются в зависимости от наиболее распространенных гистологических подтипов (плоскоклеточный рак и аденокарцинома), т.к. они имеют разную этиологию [1].
Аденокарцинома пищевода составляет примерно две трети случаев среди рака пищевода в странах с высоким уровнем дохода [1]. С каждым годом отмечается рост заболеваемости аденокарциномой пищевода на 6 %, рост смертности – на 5,4 % [2]. Данные показатели можно объяснить ключевыми факторами риска: гастроэзофагеальной рефлюксной болезнью (ГЭРБ), ожирением, курением табака и снижением инфицирован-ности Helicobacter pylori. Эрадикация H. Pylori обусловливает снижение объема и кислотности желудочного сока. Ожирение за счет увеличения внутрибрюшной висцеральной жировой ткани приводит к повышению внутрибрюшного давления. Курение табака – к расслаблению нижнего пищеводного сфинктера. Все эти механизмы способствуют развитию гастроэзофагеального рефлюкса [3]. Исходом длительно протекающей ГЭРБ является пищевод Баррета, который, в свою очередь, представляет собой следующую ступень перед дисплазией, cancer in situ слизистой оболочки пищевода и впоследствии развитие инвазивного рака [4].
Симптомы на ранней стадии аденокарциномы пищевода неспецифичны, часто болезнь протекает под маской ГЭРБ. Диагностика начинается, когда появляется дисфагия. Этот симптом связан с увеличением размера опухоли и глубиной инвазии. Пятилетняя выживаемость при распространенном процессе составляет менее 15 % [5].
в опухолевых клетках, экспрессию PD-L1. При экспрессии HER2 в состав I линии лечения должен быть включен трастузумаб [6].
Клинический случай
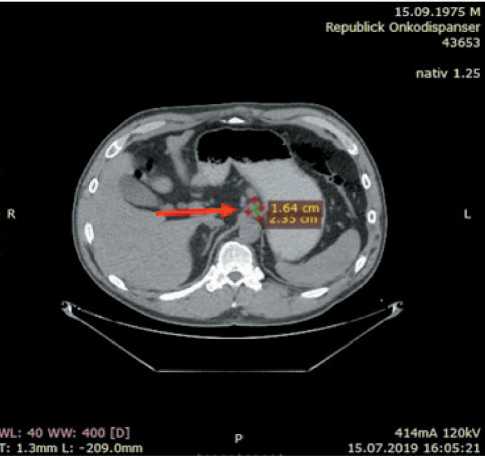
Рис. 1. КТ органов брюшной полости (15.07.19). Стрелкой обозначен таргетный очаг – лимфоузел малой сальниковой сумки до лекарственного лечения
Fig. 1. CT image of the abdominal organs (15.07.19). The arrow indicates the target focus – the lymph node of the small omental bursa before chemotherapy
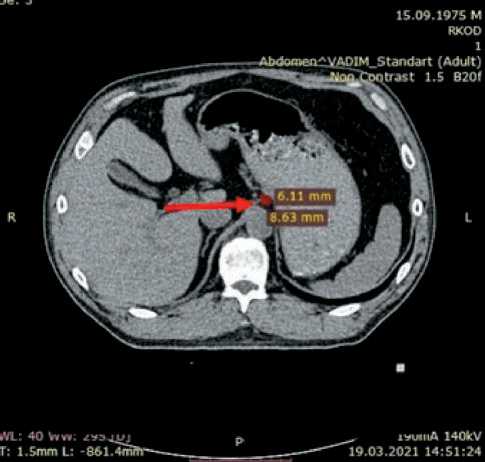
Рис. 2. КТ органов брюшной полости (19.03.21). Стрелкой обозначен таргетный очаг – лимфоузел малой сальниковой сумки во время поддерживающей терапии Трастузумабом (через 1,5 года от начала лечения)
Fig. 2. CT image of the abdominal organs dated 19.03.21. The arrow indicates the target focus – the lymph node of the small omental bursa during maintenance therapy with Trastuzumab (1.5 years after starting treatment)
рекомендована паллиативная химиотерапия (ХТ) с оценкой эффекта после 3 циклов.
При госпитализации на 1-й цикл ХТ предъявлял жалобы на неинтенсивные боли за грудиной при приеме твердой пищи, отрыжку воздухом после приема пищи. Состояние по шкале ECOG – 0. С
30.07.19 по 24.09.19 проведено 3 цикла паллиативной химиотерапии I линии по схеме СF (Цисплатин – 75 мг/м2 внутривенно капельно в 1-й день + 5-фторурацил – 1000 мг/м2/сут в виде 24-часовой внутривенной инфузии в 1–5-й дни, цикл 28 дней). Дисфагия прекратилась после 1-го цикла химиотерапии. КТ органов грудной клетки и брюшной полости (24.09.19): уменьшение размеров тар-гетного очага на 25 % (12×17 мм) – стабилизация по критериям RECIST 1.1. ФГС (27.09.19): инфильтративный рак нижней трети пищевода с переходом на кардиальный жом. Междисциплинарный консилиум (27.09.19): рекомендовано продолжение ХТ до прогрессирования. Проведен еще 1 цикл ХТ по схеме CF. 15.11.2019 выполнено иммуногистохимическое исследование – аденокарцинома с позитивным статусом HER2 (3+++). На консилиуме врачей отделения противоопухолевой лекарственной терапии принято решение с учетом HER2 позитивного статуса продолжить первую линию паллиативной химиотерапии по схеме DCF + трастузумаб (Доцетаксел – 75 мг/м2 внутривенно в 1-й день, цисплатин – 75 мг/м2 внутривенно в 1-й день, фторурацил – 750 мг/м2/сут внутривенная инфузия в 1–5-й дни, трастузумаб – 8 мг/кг (нагрузочная доза), далее 6 мг/кг внутривенно в 1-й день). Проведено 3 цикла лекарственной терапии по данной схеме. При КТ органов грудной клетки и брюшной полости (25.12.19): уменьшение размеров таргетного очага на 17 % (10×16 мм). Размеры нетаргетных очагов также уменьшились. 29.01.20 проведен консилиум врачей в отделении, на котором спланирована поддерживающая терапия трастузумабом до прогрессирования или непереносимой токсичности. Проведено 25 циклов поддерживающей терапии. По данным КТ органов грудной клетки и брюшной полости (19.03.21): стабилизация процесса, размеры таргетного очага уменьшились на 20 % за время проведения поддерживающей терапии до 8×13 мм (рис. 2), стабилизация процесса по критериям RECIST 1.1. ФГДС-контроль (26.05.21): с 39,0 до 41,0 см по левой боковой стенке пищевода слизистая инфильтрирована, бугристая, регрессия опухоли.
На момент написания статьи пациент не имеет симптомов болезни, ведет активный образ жизни. Значимых нежелательных явлений, связанных с применением препарата, не отмечено.
Заключение
Поиск оптимального алгоритма лечения аденокарциномы пищевода продолжается. Высокая экспрессия HER2 – это убедительный предиктор ответа на лечение Трастузумабом. У пациентов с высокой экспрессией HER2 в опухолевых клетках, которые получили химиотерапию в комбинации с трастузумабом, общая выживаемость составляет 16 мес, против 10 мес у пациентов, получавших терапию в том же объеме, но минимальная экспрессия HER2 в опухолевых клетках (HR – 0,65) [7]. В настоящее время пациенты с распространенной
Список литературы Клинический случай успешного лекарственного лечения аденокарциномы пищевода IV стадии
- Sung H., Ferlay J., Siegel R.L., Laversanne M., Soerjomataram I., Jemal A., Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021; 71(3): 209-49.
- DOI: 10.3322/caac.21660 EDN: MRLXRI
- Hur C., Miller M., Kong C.Y., Dowling E.C., Nattinger K.J., Dunn M., Feuer E.J. Trends in esophageal adenocarcinoma incidence and mortality. Cancer. 2013; 119(6): 1149-58.
- DOI: 10.1002/cncr.27834
- Coleman H.G., Xie S.H., Lagergren J. The Epidemiology of Esophageal Adenocarcinoma. Gastroenterology. 2018; 154(2): 390-405.
- DOI: 10.1053/j.gastro.2017.07.046 EDN: YGUIAH
- Grady W.M., Yu M. Molecular Evolution of Metaplasia to Adenocarcinoma in the Esophagus. Dig Dis Sci. 2018; 63(8): 2059-69.
- DOI: 10.1007/s10620-018-5090-8 EDN: VIBHKZ
- di Pietro M., Canto M.I., Fitzgerald R.C. Endoscopic Management of Early Adenocarcinoma and Squamous Cell Carcinoma of the Esophagus: Screening, Diagnosis, and Therapy. Gastroenterology. 2018; 154(2): 421-36.
- DOI: 10.1053/j.gastro.2017.07.041 EDN: VFMGZU
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) Esophageal and Esophagogastric Junction Cancers. 2021.
- Ter Veer E., van den Ende T., Creemers A., de Waal L., van Oijen M.G.H., van Laarhoven H.W.M. Continuation of trastuzumab beyond progression in HER2-positive advanced esophagogastric cancer: a meta-analysis. Acta Oncol. 2018; 57(12): 1599-1604.
- DOI: 10.1080/0284186X.2018.1503421 EDN: DBSEAW


