Клинический случай успешной эндоваскулярной коррекции артерио-мочеточниковой фистулы
Автор: Чернявский Михаил Александрович, Мосоян М.С., Ванюркин А.Г., Сусанин Н.В., Казанцев А.Н.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Случаи из клинической практики
Статья в выпуске: 3 т.25, 2021 года.
Бесплатный доступ
Артерио-мочеточниковая фистула - относительно редкое патологическое состояние, которое характеризуется дефектом между кровеносными сосудами и прилегающими к ним дистальными сегментами мочеточника. Ввиду высокого риска геморрагического шока на фоне рецидивирующей массивной гематурии является жизнеугрожающим. Цель публикации - продемонстрировать успешное эндоваскулярное лечение пациентки 51 года с артерио-мочеточниковыми фистулами. Из анамнеза: эвисцерация органов малого таза с формированием уретерокутанеостомы и колостомы. Для улучшения оттока мочи и профилактики стенозов мочеточников установлены мочеточниковые стенты. После удаления стентов эпизоды рецидивирующих профузных кровотечений из уретерокутанеостомы. При поступлении выполнили мультиспиральную компьютерную томографию с ангиографией подвздошных артерий, экстравазаций контрастного вещества не выявили, однако определили сдавление левой общей подвздошной артерии извне левым мочеточником. После дообследования имплантировали баллонорасширяемый стент-графт в левую общую подвздошную артерию. В послеоперационном периоде кровотечения не рецидивировали. Клинический случай демонстрирует высокую эффективность эндоваскулярного лечения артерио-уретеральных фистул, а также необходимость комплексного и мультидисциплинар-ного подхода при ведении таких больных. Малоинвазивная методика позволяет снизить хирургическую травму и в короткие сроки изолировать патологический сброс крови из артерии в мочеточник. Обсуждены преимущества и недостатки эндоваскулярных технологий при лечении представленной патологии.
Артерио-мочеточниковая фистула, артерио-уретеральная фистула, массивная гематурия, мочеточниковый стент, стент-графт, эвисцерация органов
Короткий адрес: https://sciup.org/142230791
IDR: 142230791 | DOI: 10.21688/1681-3472-2021-3-100-105
Текст научной статьи Клинический случай успешной эндоваскулярной коррекции артерио-мочеточниковой фистулы
М.А. Чернявский,
М.С. Мосоян,
А.Г. Ванюркин,
Н.В. Сусанин,
А.Н. Казанцев,
Артерио-мочеточниковая фистула (АМФ) — относительно редкое и потенциально опасное для жизни состояние, характеризующееся высокой смертностью из-за рецидивирующих спонтанных кровотечений [1; 2]. Клиническая картина включает в себя задержку мочи, лихорадку, боль в животе, однако наиболее частый признак — гематурия различной интенсивности [3; 4]. Среди пациентов женского и мужского пола АМФ распространены в соотношении 3 : 2 [3–5]. Основные факторы риска — постоянный мочеточниковый стент в мочеточниках, злокачественное новообразование в анамнезе, хирургическое вмешательство на органах брюшной полости и малого таза [5–7].
Первичное диагностическое обследование включает ангиографию, компьютерную томографию, уретерографию. Симптомы патологии неспецифические и на момент обследования могут отсутствовать [1–5]. Есть данные о проведении провокационных тестов при цистоскопии, инициирующих гематурию из фистулы, однако метод может вызвать неконтролируемое кровотечение и геморрагический шок [3–7].
15 % известных случаев АМФ связаны с первичным ослаблением артериальной и мочеточниковой стенок при артериовенозных мальформациях, аневризмах аорты и подвздошных артерий [8; 9]. Воспаление или хронические дегенеративные процессы приводят к эрозии стенки мочеточника в прилегающую сосудистую сеть или магистральные артерии [1; 5; 7; 9]. Пульсирующий кровоток в артериях создает механическое трение, вызывая раздражение и структурное ослабление стенок с последующим прорывом крови в просвет мочеточника [2; 3; 6]. 85 % АМФ вторичные, возникающие после хирургических вмешательств по поводу рака органов брюшной полости и малого таза, а также из-за размещения артериальных трансплантатов вблизи от мочеточников, установки постоянных мочеточниковых стентов для отвода мочи [8–11]. Патогенез вторичных АМФ схож с первичными: пульсация артерии и ее непосредственная близость с мочеточником создают механическое трение и приводят к эрозии их стенок.
Дефицит исследований, обусловленный редкостью патологии, создает неопределенность в лечении изучаемой когорты больных. Опубликованы единичные клинические случаи по «открытым» и эндоваскулярным техникам. В настоящей работе продемонстрирован эндоваскулярный способ коррекции АМФ у пациента с макрогематурией и оперативным лечением органов малого таза в анамнезе.
Клинический случай
Пациентка К., 51 год, поступила в отделение сердечно-сосудистой хирургии № 2 ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России в экстренном порядке. Из анамнеза: состояние после комплексной терапии и хирургического лечения по поводу рака шейки матки — экстирпации матки с придатками в феврале 2020 г. В мае 2020 г. ввиду рецидива злокачественного новообразования выполнена эвисцерация органов малого таза с резекцией подвздошной кишки, аппендэктомией и последующим наложением колостомы и уретерокутанеостомы. После оперативного вмешательства в обоих мочеточниках установлены мочеточниковые стенты для улучшения оттока мочи и профилактики стенозирования. Периодическую замену стентов осуществлял уролог по месту жительства. В ноябре 2020 г. во время планового удаления стентов возникло обильное кровотечение из кутанеосто-мы. Гематурию купировали повторной установкой левого мочеточникового стента. Пациентку обследовали в хирургическом стационаре по месту жительства, на селективной ангиографии признаков экстравазации не выявили, выполнили масляную окклюзию левой мочеточниковой артерии. Проводили гемостатическую и гемотрансфузионную коррекцию с целью восполнения объема циркулирующей крови. На второй день после выписки из стационара возник рецидив массивного кровотечения из кутанеостомы. Пациентку экстренно госпитализировали в хирургический стационар по месту жительства, провели консультацию уролога по поводу гематурии, по жизненным показаниям выполнили левостороннюю нефрэктомию. На 3-й и 6-й дни после операции — повторные эпизоды кровотечения. Провели телемедицинскую консультацию с сосудистым хирургом ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России, 08.01.2021 г. сан-транспортом доставили больную в отделение сердечно-сосудистой хирургии № 2.
На момент поступления состояние гемодинамически стабильное, эпизода кровотечения не было. Моча по уретерокутанеостоме соломенно-желтого цвета. Пульсация на магистральных артериях сохранена. Общий анализ крови: гемоглобин 87,6 г/л, эритроциты 3,1 × 1012/л, гематокрит 33,9 %. Общий
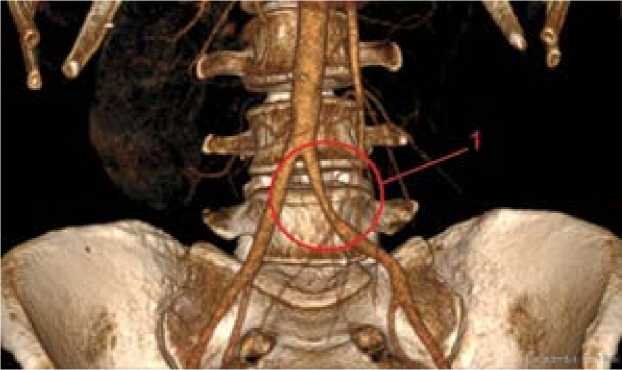
Рис. 1. Мультиспиральная компьютерная томография – ангиография аортоподвздошного сегмента, 3D-реконструкция Примечание. 1 — гемодинамически незначимое сужение левой общей подвздошной артерии.
анализ мочи: эритроциты 75 × 106/л, лейкоциты 103 × 106/л.
С целью верификации локализации АМФ выполнили мультиспиральную компьютерную томографию – ангиографию артерий аорто-подвздошного сегмента, по данным которой экстравазации контрастного вещества в брюшном отделе аорты, ее висцеральных ветвях и подвздошных артериях не обнаружили. Выявили гемодинамически незначимое сужение левой общей подвздошной артерии (рис. 1).
Пациентка предоставила результаты мультиспи-ральной компьютерной томографии – ангиографии органов брюшной полости после установки мочеточниковых стентов, по которым левый мочеточник пересекает левую общую подвздошную артерию, вызывая ее сдавление (рис. 2).
Диагноз по результатам обследования — ар-терио-уретеральная фистула между левым мочеточником и левой общей подвздошной артерией. Осложнение — рецидивирующее наружное кровотечение. Острая постгеморрагическая анемия средней степени тяжести. Сопутствующий рак шейки матки рT2bNxM0 после комплексной терапии в 2019 г., оперативного лечения в 2020 г. Эвисце-рация органов малого таза по поводу рака шейки матки в 2020 г. Нефрэктомия слева в 2020 г. Коло-стома слева, двухсторонняя уретерокутанеостома.
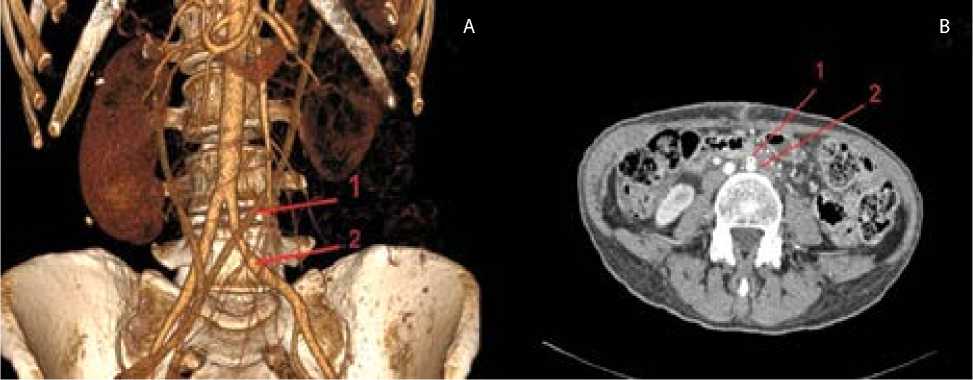
Рис. 2. Мультиспиральная компьютерная томография – ангиография аортоподвздошного сегмента после установки мочеточниковых стентов: 3D-реконструкция (A); поперечный срез на уровне общих подвздошных артерий (B) Примечание . 1 — левый мочеточниковый стент; 2 — левая общая подвздошная артерия.
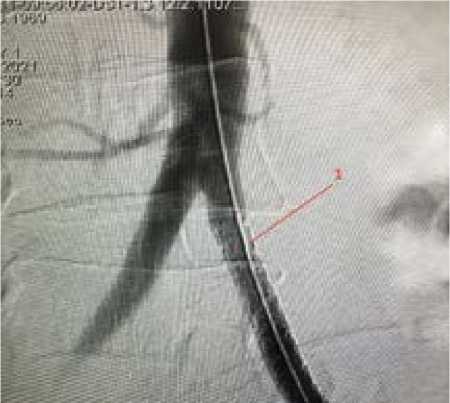
Рис. 3. Ангиография аорто-подвздошного сегмента после установки стента
Примечание. 1 — стент-графт LifeStream, имплантированный в левую общую подвздошную артерию.
Поскольку активное кровотечение из АМФ во время обследования отсутствовало, решили основываться на предоставленных результатах муль-тиспиральной компьютерной томографии – ангиографии и на анамнезе заболевания: эпизоды кровотечения были спровоцированы удалением левого мочеточникового стента и купированы его обратной установкой. Мультидисциплинарный консилиум из сердечно-сосудистого хирурга, уролога, кардиолога, анестезиолога-реаниматолога принял решение об эндоваскулярной установке стент-графта в левую подвздошную артерию в месте ее сдавления левым мочеточником.
Ход операции
После обработки операционного поля под местной анестезией 10,0 мл 0,1% раствора лидокаина выполнили пункцию левой общей бедренной артерии, установили интродьюсер 7F. На ангиографии определили гемодинамически незначимый стеноз левой общей подвздошной артерии на границе верхней и средней третей. В зону дефекта стенки сосуда завели и имплантировали баллонорасширяемый стент-графт LifeStream (Becton, Dickinson and Company, Франклин Лейкс, США) 8 × 58 мм. Выполнили постдилатацию баллонным катетером Mustang (Boston Scientific, Мальборо, США)
7 × 20 мм. Контрольная ангиография показала область стентирования без гемодинамически значимых остаточных стенозов, диссекций, экстраваза-ций (рис. 3). Удалили инструменты из сосудистого русла, ушили пункционное отверстие устройством Angio-Seal (Terumo Medical Corporation, Сомерсет, США), наложили асептическую повязку.
Послеоперационный период протекал без особенностей, болевой синдром, кровотечение и макрогематурия отсутствовали, пульсация на магистральных артериях сохранялась удовлетворительной. Общий анализ крови: гемоглобин 94,2 г/л, эритроциты 3,2 × 1012/л, гематокрит 33,8 %. Общий анализ мочи: эритроциты 0, лейкоциты 34 × 106/л. Пациентку выписали для амбулаторного наблюдения в удовлетворительном состоянии на 3-е сут. после вмешательства.
Обсуждение
Для коррекции АМФ используют хирургические и эндоваскулярные методы. Поскольку у большинства пациентов в анамнезе хирургические вмешательства на органах брюшной полости и малого таза, операция сопряжена с техническими сложностями из-за повторного доступа и высоким риском летального исхода. Имеется информация об эмболизации АМФ спиралью, однако данный метод повышает риск дистальной эмболизации магистральных артерий, что может привести к острой ишемии нижних конечностей [1; 5; 7; 9]. При локализации фистулы на общей или наружной подвздошных артериях эндоваскулярная имплантация стент-графта оптимальна, безопасна и сопряжена с наименьшим риском осложнений [2; 5; 7]. Основные преимущества — малотравматичность и возможность в короткие сроки изолировать патологическое сообщение на момент кровотечения. Недостатком является необходимость назначения антиагрегантной терапии для профилактики тромбоза стент-графта, которая ограничивает применение эндоваскулярного подхода при высоком риске кровотечения [3; 5; 7; 9]. Также у пациентов с хроническим воспалительным процессом в мочевыводящих путях после имплантации стент-графта существует угроза его инфицирования в послеоперационном периоде, что может потребовать профилактического назначения антибиотикоте-рапии в периоперационном периоде [3; 7–9; 11]. Конкретные рекомендации по лечению АМФ отсутствуют, а выбор тактики определяется опытом ангиохирургов, возможностью выполнять как «открытое», так и эндоваскулярное вмешательство [1; 2; 4; 5; 10]. Представленный клинический случай демонстрирует, что для диагностики и определения оптимального и наименее травматичного подхода к лечению артерио-уретеральных фистул необходим мультидисциплинарный подход.
Ограничения
Клинический случай реализован с опорой на опыт эндоваскулярных хирургов и урологов. Отсутствие данных в действующих рекомендациях о лечении данной патологии создавало неопределенность в выборе стратегии. Единственный правильный вариант коррекции дифференцировал мультидисциплинарный консилиум.
Заключение
Установка стент-графта в область АМФ эффективна и безопасна в лечении сложного для курации пациента. При множественных полостных вмешательствах на органах малого таза эта методика коррекции оптимальна. Стратегию лечения данной когорты больных должен определять мультидис-циплинарный консилиум персонифицированно, с учетом всех факторов риска пациента.
Список литературы Клинический случай успешной эндоваскулярной коррекции артерио-мочеточниковой фистулы
- Yoshioka N., Takagi K., Morita Y., Kawase M., Morishima I. Endovascular treatment of arterio-ureteral fistula with new-generation balloon-expandable stent graft using a 7-French system. SAGE Open Med Case Rep. 2020;8:2050313X20959219. PMID: 33062280; PMCID: PMC7534066. https://doi. org/10.1177/2050313X20959219
- Kaneko T., Sakamoto A., Yamada Y., Yamamoto M., Kondo H., Nakagawa T. Uretero-arterial fistula treated with endovascular stent graft following multiple interventions. IJU Case Rep. 2020;3(6):275-277. PMID: 33163924; PMCID: PMC7609180. https://doi.org/10.1002/iiu5.12216
- Malgor R.D., Oderich G.S., Andrews J.C., McKusick M., Kalra M., Misra S., Gloviczki P., Bower T.C. Evolution from open surgical to endovascular treatment of ureteral-iliac artery fistula. J Vasc Surg. 2012;55(4):1072-1080. PMID: 22326578; PMCID: PMC4476467. https://doi.org/10.1016/uvs.2011.11.043
- Guntau M., Hegele A., Rheinheimer S., Hofmann R., Mahnken A.H. Balloon-expandable stent graft for treating uretero-iliac artery fistula. Cardiovasc Intervent Radiol. 2017;40(6):831-835. PMID: 28150018. https://doi.org/10.1007/ s00270-017-1586-4
- Horie K., Fujiwara T., Satoyoshi K., Munehisa M., Inoue N. Endovascular treatment of ureteroarterial fistula using a covered stent, evaluated by intravascular ultrasound: a case report. CVIR Endovasc. 2019;2(1):16. PMID: 32026230; PMCID: PMC6966421. https://doi.org/10.1186/s42155-019-0060-6
- Gallo F., Gastaldi E., Spirito G., Barile A., Kosir C., Giberti C. A case of iliac-artery-ureteral fistula managed with a combined endoscopic approach. Nat Clin Pract Urol. 2008;5(4):225-228. PMID: 18334976. https://doi.org/10.1038/ncpuro1059
- Kuramoto T., Muraoka S., Nishikawa T., Matsumoto Y., Uokawa K. A Case of ureteroarterial fistula successfully treated with endovascular stent graft. Hinyokika Kiyo. 2019;65(7):299-303. PMID: 31501396. https://doi.org/10.14989/ ActaUrolJap 65 7 299
- Araki T., Nagata M., Araki T., Takihana Y., Takeda M. Endovascular treatment of ureteroarterial fistulas with stent-grafts. Radiat Med. 2008;26(6):372-375. PMID: 18677613. https://doi.org/10.1007/s11604-008-0235-x
- Krenzien J., Wagner R. Iliac artery-ureteral fistula and its treatment. Zentralbl Chir. 2003;128(9):768-773. PMID: 14533048. https://doi.org/10.1055/s-2003-42757
- Mahlknecht A., Bizzotto L., Gamper C., Wieser A. A rare complication of ureteral stenting: Case report of a uretero-arterial fistula and revision of the literature. Arch Ital Urol Androl. 2018;90(3):215-217. PMID: 30362691. https://doi. org/10.4081/aiua.2018.3.215
- Madonia M., Russo G.I., Trignano E., Paliogiannis P., Cimino S., Corbu C., Morgia G. A case of gross haematuria due to an ureteric-iliac artery fistula. Ann Ital Chir. 2013;84(ePub):S2239 253X13021750. PMID: 24395028.


