Клинический случай выявления газа в воротной вене после аортобедренного бифуркационного шунтирования
Автор: М.В. Зозуля, А.И. Ленькин, К.М. Лебединский
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Случаи из клинической практики
Статья в выпуске: 4 т.26, 2022 года.
Бесплатный доступ
Представлен клинический случай раннего хирургического лечения абдоминального компартмент-синдрома, возникшего после аортобедренного бифуркационного шунтирования. Мужчина 73 лет поступил в СЗГМУ им. И.И. Мечникова с критической ишемией нижних конечностей. В плановом порядке выполнили аортобедренное бифуркационное шунтирование синтетическим протезом через лапаротомный доступ. Послеоперационный период осложнился динамической кишечной непроходимостью. Прогрессировало ухудшение состояния (гиповолемический и септический шок, дыхательная недостаточность на фоне тяжелой пневмонии). Изначальная хирургическая тактика состояла в консервативном ведении. После выявления с помощью прикроватного ультразвукового исследования признаков интестинальной ишемии (пневматоз стенки кишечника, газ в воротной вене) тактику изменили. В тот же день провели декомпрессионную релапаротомию, установили интестинальный зонд. Послеоперационный период протекал с положительной динамикой: ранняя экстубация с удовлетворительными показателями газообмена, минимальные дозировки вазопрессорной поддержки, появление стула на 2-й день после операции. Газ в воротной вене в 70 % случаев свидетельствует о некрозе стенки кишечника. Выявление этого ультразвукового феномена у пациентов после операций на брюшном отделе аорты может указывать на ишемию толстой кишки, поскольку нарушения мезентериального кровообращения в первую очередь развиваются в бассейне нижней брыжеечной артерии. Состояние требует экстренного хирургического вмешательства, но его дифференциальная диагностика с послеоперационным парезом кишечника не всегда возможна, особенно на ранних стадиях. В нашем случае раннее выявление газа в воротной вене и экстренное вмешательство по этому поводу предотвратили необратимое ишемическое повреждение кишечника. Прикроватный ультразвуковой мониторинг позволяет предположить данное состояние и определить показания к раннему хирургическому вмешательству, что может улучшить исход.
Абдоминальный компартмент-синдром, газ в воротной вене, клинический случай, мезентериальная ишемия
Короткий адрес: https://sciup.org/142235625
IDR: 142235625 | DOI: 10.21688/1681-3472-2022-4-73-79
Текст научной статьи Клинический случай выявления газа в воротной вене после аортобедренного бифуркационного шунтирования
М.В. Зозуля, А.И. Ленькин, К.М. Лебединский,
Острое нарушение мезентериального кровообращения — одно из самых фатальных периоперационных осложнений после операций на брюшном отделе аорты [1]. Частота развития состояния после планового аортобедренного бифуркационного шунтирования (АББШ) по поводу аневризмы брюшной аорты — 0,6–13,0 % [2]. Значительно чаще встречается послеоперационный парез кишечника: в 10–30 % случаев после операций на органах брюшной полости [3]. Ранняя диагностика мезентериальной ишемии часто затруднена невозможностью прямого измерения кровотока в артериях и венах кишечника; четкие клинические и лабораторные критерии для быстрой и точной диагностики острой ишемии кишечника отсутствуют. Более того, послеоперационный парез маскирует вероятно имеющуюся ишемию кишечника. Парез может привести к абдоминальному компартмент-синдро-му (АКС) и полиорганной недостаточности. Прикроватный ультразвуковой мониторинг — полезный дополнительный инструмент, позволяющий выявить ишемию кишечника и АКС на ранней стадии, чтобы провести раннюю хирургическую декомпрессию и улучшить исход. Анализ многих клинических случаев показал, что выявление газа в воротной вене (ВВ), пневматоза кишечника при ультразвуковом исследовании часто ассоциируется с ишемией и некрозом кишечника [4; 5]. Цель — демонстрация клинического случая выявления газа в ВВ при прикроватном ультразвуковом исследовании у пациента после АББШ, осложненного абдоминальным ком-партмент-синдромом.
Клинический случай
Пациент Р., 73 года, поступил в клинику им. Петра Великого СЗГМУ им. И.И. Мечникова с критической ишемией нижних конечностей. Из анамнеза: в 2015 г. плановая полузакрытая петлевая эндартерэктомия из наружной подвздошной артерии слева. С ноября 2021 г. снизилась дистанция безболевой ходьбы до 30 м, с декабря 2021 г. испытывает боли в состоянии покоя. По данным мультиспиральной компьютерной томографии – ангиографии аорты и артерий нижних конечностей, окклюзия наружной подвздошной артерии слева, окклюзия общей подвздошной и наружной подвздошной артерий справа.
8 февраля 2022 г. выполнили АББШ с использованием бифуркационного протеза Intergard Silver Knitted № 20 (Getinge, Гетеборг, Швеция) через ла-паротомный доступ. Ранний послеоперационный период протекал без особенностей. С целью анальгезии и профилактики послеоперационного пареза кишечника проводили постоянную инфузию ро-пивакаина 8–12 мг/ч через эпидуральный катетер, установленный на уровне Th10–Th11.
На следующий день после операции пациента перевели в профильное отделение. Через сутки экстренно доставили в отделение реанимации и интенсивной терапии с признаками кишечной непроходимости: разлитыми болями в животе, тошнотой и рвотой застойным содержимым в объеме до 1,5 л, выраженной слабостью. При объективном осмотре состояние тяжелое, сознание ясное, немного заторможен, кожные покровы влажные, холодные, артериальное давление 145/55 мм рт. ст., частота сердечных сокращений 110 в минуту, синусовый ритм. Частота дыхания 24–26 вдохов в минуту, аускультативно — множественные влажные хрипы с двух сторон, SpO2 = 88–89 %. Живот напряжен, болезнен при пальпации, перитонеальных симптомов нет. Установили назогастральный зонд.
При фокусном эхокардиографическом исследовании сердца выявили признаки гиповолемии (маленькие камеры сердца, гиперкинез стенок левого желудочка, диаметр нижней полой вены менее 1 см, вена коллабирует на вдохе). В легких признаки консолидации легочной ткани с обеих сторон, динамические аэробронхограммы, небольшое количество жидкости в левой плевральной полости, в нижних отделах множественные В-линии. В газовом составе артериальной крови декомпенсированный метаболический лактат-ацидоз (рН = 7,21, лактат 3,3 ммоль/л), грубых нарушений в биохимическом анализе крови не отметили (креатинин 83 мкмоль/л, мочевина 10,5 ммоль/л, щелочная фосфатаза 55 ед/л, амилаза 130 ед/л). Уровень прокальцитонина 18,94 нг/мл, С-реактивного белка 240,8 мг/л свидетельствовал о сепсисе. Рентгенологически массивная инфильтрация без четких контуров в средне-нижних отделах слева. Экстренно вызвали абдоминального хирурга для консультации и определения дальнейшей тактики.
Изначальный диагноз — динамическая послеоперационная кишечная непроходимость, выбрали консервативную тактику ведения пациента. Врачи-реаниматологи дополнительно выполнили прикроватное фокусное ультразвуковое исследование кишечника. Закономерно выявили признаки пареза кишечника: петли тонкой, нисходящей ободочной и сигмовидной кишок дилатированы до 3–4 см соответственно, признак peristalsis To/Fro (маятникообразное движение содержимого кишечни- ка), утолщение стенки кишечника до 3 мм, стенки кишечника местами гиперэхогенны (pneumatosis intestinalis). С целью выявления или исключения свободной жидкости в брюшной полости обследовали карман Моррисона, периселезеночное пространство и ретровезикулярный карман. Видимого скопления жидкости в забрюшинном пространстве не обнаружили. Обратили внимание на выраженную диффузную гиперэхогенную зернистость печени, в просвете ВВ в В-режиме выявили подвижные гиперэхогенные очаги округлой формы, движение которых соответствовало кровотоку по ВВ (в направлении печени) (рисунок).
Такие находки указывали на газ в ВВ, что косвенно могло свидетельствовать об интестинальной ишемии. После повторной консультации хирург принял решение об экстренном хирургическом вмешательстве — релапаротомии, ревизии органов брюшной полости. При ревизии — пульсация аорты, подвздошных артерий отчетливая. Признаков нарушения мезентериального кровообращения не выявили. Полностью осмотрели тонкую и толстую кишки. Их петли расширены, серозная оболочка бледно-розового цвета, блестящая, пульсация брыжеечных артерий сохранена, перистальтика отсутствует. В брыжейку тонкой кишки ввели 60 мл 0,25% раствора новокаина. При дальнейшей ревизии брюшной полости данных о хирургической патологии не получили. Интраоперационную ситуацию расценили как послеоперационный парез кишечника. Выполнили интубацию кишечника зондом Эббота – Миллера до илеоцекального угла. Эвакуировали большое количество газа и кишечного содержимого.
Послеоперационный период с положительной динамикой: экстубировали через 3 ч с удовлетворительными показателями газообмена на фоне высокопоточной назальной оксигенации (SpO2 = 97–99 %), осуществляли вазопрессорную поддержку норадреналином в дозе 0,03–0,05 мкг/кг в минуту для обеспечения целевых параметров гемодинамики (среднее артериальное давление > 65 мм рт. ст.). На третьи сутки после релапаротомии удалили назоинтестинальный зонд, на фоне энтерального питания в объеме 2 л сброс по назогастральному зонду менее 500 мл. Восстановилась перистальтика кишечника, появился спонтанный стул. Показатели системного воспалительного ответа и бактериальной инфекции снизились (прокальцитонин 3,13 нг/мл, С-реактивный белок 107,8 мг/л). При повторном ультразвуковом исследовании на 3-й день после релапаротомии воздух в ВВ не опре-
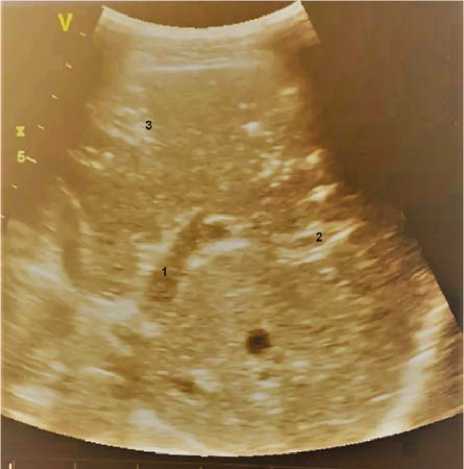
Ультразвуковая картина газа в воротной вене:
1 — пузырьки газа в воротной вене; 2 — левая ветвь воротной вены с визуализацией пузырьков газа в ее просвете; 3 — диффузно гиперэхогенная паренхима печени делялся, исчезла диффузная гиперэхогенная зернистость печени.
Послеоперационный период осложнился массивной левосторонней пневмонией. На фоне проводимой антибактериальной терапии (1,0 г меро-пенема 4 раза в сутки, 1,0 г ванкомицина 2 раза в сутки) рентгенологически и клинически положительная динамика. Спустя 5 суток после релапаротомии взяли мазок на полимеразную цепную реакцию SARS-CoV-2 с положительным результатом. Пациента перевели в специализированный стационар для лечения новой коронавирусной инфекции. Через 2 недели выписали в удовлетворительном состоянии. Жалоб со стороны желудочно-кишечного тракта не предъявлял.
Обсуждение
Ишемия кишечника — основная причина появления газа в ВВ у взрослых (до 70 % случаев) [4; 5], и при трансмуральном некрозе стенки кишечника летальность у таких пациентов достигает 85 % [7]. Ишемия толстой кишки — частое осложнение после АББШ (2,4–13,0 %) с высокой частотой неблагоприятных исходов (увеличение госпитальной летальности в 15 раз) [2; 8]. Факторами риска являются массивное периоперационное кровотечение (особенно при резекциях аневризмы аорты), массивная гемотрансфузия, ретроперитонеальная гематома и АКС [8]. Последний на фоне тяжелой внутрибрюшной гипертензии также может служить источником появления газа в ВВ. АКС часто сопровождается полиорганной недостаточностью. В случае АББШ (эндоваскулярного или «открытого») при разрыве аневризмы аорты АКС может быть вызван интра- и послеоперационной массивной кровопотерей, большим объемом инфузии компонентов крови и кристаллоидных растворов [9].
В клиническом наблюдении операция не сопровождалась значимой кровопотерей, переливание донорских гемокомпонентов не выполняли, а объем инфузионной терапии в периоперацион-ном периоде был небольшим. Выраженный послеоперационный парез кишечника вызвал значимую экстравазацию жидкости в просвет кишечника, что привело к гиповолемическому шоку. Большие потери жидкости также были обусловлены рвотой и невозможностью перорального приема жидкости. На фоне дыхательной недостаточности, гиповолемического и септического шока разрешение пареза кишечника было маловероятным. Стоит отметить, что пациенту ранее уже выполняли операцию на подвздошных артериях с забрюшинным доступом по Пирогову, и риск послеоперационного пареза был изначально высоким. Клинический случай также продемонстрировал нецелесообразность использования послеоперационной эпидуральной анальгезии с целью разрешения пареза [10].
По данным литературы, риск послеоперационного пареза кишечника при повторных вмешательствах увеличивается в 2,41 раза [11]. В связи с этим более вероятным сценарием дальнейшего течения заболевания было ухудшение мезентериального кровообращения и развитие АКС, который часто сопровождается острым почечным повреждением и дыхательной недостаточностью. Острое почечное повреждение развивается вследствие гипоперфузии на фоне высокого внутрибрюшного давления, которое способствует снижению почечного перфузионного давления и фильтрационного градиента (фильтрационный градиент = среднее артериальное давление – (внутрибрюшное давление х 2)) [12]. В нашем случае у пациента не были повышены показатели азотистого баланса, хотя диурез при повторном поступлении был редуцирован, что скорее свидетельствовало о ранней стадии АКС и острого почечного повреждения. Редукция диуреза также была обусловлена тяжелой гиповолемией (по данным фокусной эхокардиографии). Причиной дыхательной недостаточности была пневмония, подтвержденная рентгенологически (массивная инфильтрация нижней доли левого легкого), которая возникла после АББШ. К сожалению, мы не измеряли внутрибрюшное давление (техника предполагает измерение давления в мочевом пузыре при заполнении его 20–30 мл жидкости). Это позволило бы точно диагностировать внутрибрюшную гипертензию и степень ее тяжести. Показатели внутрибрюш-ного давления более 20 мм рт. ст. свидетельствуют о тяжелой внутрибрюшной гипертензии, а абдоминальное перфузионное давление (абдоминальное перфузионное давление = среднее артериальное давление – внутрибрюшное давление) менее 60 мм рт. ст. служит показанием к хирургической декомпрессии [12]. Более того, сами экстренные абдоминальные вмешательства в 75 % случаев сопровождаются внутрибрюшной гипертензией [13].
Для выявления газа в ВВ при ультразвуковом исследовании следует использовать низкочастотный конвексный «абдоминальный» датчик с частотой 1–2 МГц. Он обеспечивает достаточную глубину сканирования и позволяет получить изображение больших объемов ткани печени. Качество изображения может быть недостаточным, поэтому также используют линейный и микроконвексный датчики. Преимущество линейного датчика состоит в по- лучении высокого разрешения вблизи расположения датчика, что позволяет увидеть гиперэхогенные очаги в дистальных ветвях ВВ. Микроконвексный датчик благодаря высокому разрешению в ближней зоне и широкому полю обзора в глубине тканей идеален для осмотра через межреберные промежутки. Поскольку у пациентов с кишечной непроходимостью в просвете кишечника наблюдается большое скопление воздуха (что мешает визуализации), лучшим местом для сканирования печени служит правая боковая поверхность туловища по средней аксиллярной линии в 7-м, 8-м, 9-м межреберных промежутках. Датчик при этом располагают в поперечной плоскости. При сканировании сверху вниз сначала визуализируются печеночные вены и место их впадения в нижнюю полую вену, затем ворота печени с ВВ, ее левой и правой ветвями. Газ в ВВ визуализируется в виде мелких подвижных гиперэхогенных образований, движение которых соответствует кровотоку в ВВ, то есть внутрь печени. Они могут располагаться пристеночно либо, при большом количестве газа, заполнять весь просвет ВВ. Паренхима печени зернистая с гиперэхогенными включениями. Эти включения представляют собой пузырьки воздуха в дистальных отделах ветвей ВВ, вплоть до капилляров. Обычно они располагаются по периферии, что отличает газ в ВВ от пневмобилии, когда гиперэхогенные включения располагаются центрально возле ворот печени, а также в просвете общего желчного протока. При допплерометрическом исследовании в импульсно-волновом режиме характерно выявление острых спайков с расходящимися пиками по обе стороны от базовой линии на фоне монофазного кровотока в ВВ. Такие спайки сопровождаются громким аудиосигналом.
Большинство авторов рассматривают газ в ВВ как прогностический признак некроза кишечника [4; 5; 14]. Наше клиническое наблюдение продемонстрировало, что этот ультразвуковой феномен не исключает благоприятного течения заболевания при своевременном хирургическом вмешательстве. В литературе описаны случаи выявления газа в ВВ у практически здоровых людей без острой абдоминальной патологии [15].
Вышеуказанные ультразвуковые признаки присутствовали у пациента, что послужило поводом для экстренного хирургического вмешательства с целью исключения острой ишемии кишечника. По нашему опыту лечения пациентов после АББШ с присоединением кишечной непроходимости, в первую очередь следует исключать мезентериальный тромбоз в бассейне нижней брыжеечной артерии, так как парез кишечника — один из первых симптомов этого грозного осложнения. Ректальное исследование не показало крови в стуле, что характерно для пациентов с мезентериальным тромбозом в бассейне нижней брыжеечной артерии. Это послужило дополнительным аргументом для хирургов о консервативном лечении. Но ультразвуковые признаки ишемии кишечника способствовали изменению изначального решения, что благоприятно сказалось на состоянии пациента и, возможно, позволило избежать неблагоприятного исхода.
Заключение
Прикроватное ультразвуковое исследование кишечника, печени и ВВ, выявление признаков пневматоза стенки кишечника и газа в ВВ способствуют ранней диагностике АКС до развития явной поли-органной недостаточности. Такие находки являются показаниями к ранней хирургической декомпрессии кишечника, что приводит к регрессу динамической кишечной непроходимости, и, возможно, позволяет избежать осложнений и неблагоприятного исхода у пациентов после АББШ, осложненного динамической кишечной непроходимостью.
Список литературы Клинический случай выявления газа в воротной вене после аортобедренного бифуркационного шунтирования
- Дюсупов А.А., Рахметов Н.Р., Сагандыков И.Н., Карпенко А.А., Дюсупов А.З. Осложнения и их профилактика в раннем и позднем послеоперационном периоде у больных с инфраренальной аневризмой аорты. Патология кровообращения и кардиохирургия. 2009;(4):47-50. Dyusupov A.A. Rakhmetov N.R., Sagandykov I.N., Karpenko A.A., Diusupov A.Z. Complications and their prevention in early and late postoperative periods in patients with infrarenal aortic aneurysm. Patologiya krovoobrashcheniya i kardiokhirurgiya = Circulation Pathology and Cardiac Surgery. 2009;(4):47-50. (In Russ.)
- Dardik A., Burleyson G.P., Bowman H., Gordon T.A., Williams G.M., Webb T.H., Perler B.A. Surgical repair of ruptured abdominal aortic aneurysms in the state of Maryland: factors influencing outcome among 527 recent cases. J Vasc Surg. 1998;28(3):413-420. PMID: 9737450. https://doi.org/10.1016/s0741-5214(98)70126-0
- Venara A., Neunlist M., Slim K., Barbieux J., Colas P.A., Hamy A., Meurette G. Postoperative ileus: Pathophysiology, incidence, and prevention. J Visc Surg. 2016;153(6):439-446. PMID: 27666979. https://doi.org/10.1016/j.jviscsurg.2016.08.010
- Connor-Schuler R., Binz S., Clark C. Portal venous gas on point-of-care ultrasound in a case of cecal ischemia. J Emerg Med. 2020;58(3):e117-e120. PMID: 31843320. https://doi.org/10.1016/j.jemermed.2019.10.033
- Pan Y. Hepatic portal vein gas associated with intestinal ischemia and acute gastric dilatation: a case report. Ann Palliat Med. 2021;10(6):7095-7098. PMID: 33691431. https://doi.org/10.21037/apm-20-1764
- Meister A.L., Doheny K.K., Travagli R.A. Necrotizing enterocolitis: It's not all in the gut. Exp Biol Med (Maywood). 2020;245(2):85-95. PMID: 31810384; PMCID: PMC7016421. https://doi.org/10.1177/1535370219891971
- Chirica M., Scatton O. Air in the portal venous system: radiologic differential diagnosis and etiology-specific treatment. J Chir (Paris). 2006;143(3):141-147. PMID: 16888598. https://doi.org/10.1016/s0021-7697(06)73641-9
- Dovzhanskiy D.I., Bischoff M.S., Wilichowski C.D., Rengier F., Klempka A., Böckler D. Outcome analysis and risk factors for postoperative colonic ischaemia after aortic surgery. Langenbecks Arch Surg. 2020;405(7):1031-1038. PMID: 32827052; PMCID: PMC7541358. https://doi.org/10.1007/s00423-020-01964-2
- Rubenstein Ch., Bietz G., Davenport D.L., Winkler M., Endean E.D. Abdominal compartment syndrome associated with endovascular and open repair of ruptured abdominal aortic aneurysms. J Vasc Surg. 2015;61(3):648-654. PMID: 25499708. https://doi.org/10.1016/j.jvs.2014.10.011
- Акопян Р.В. Сравнительная характеристика влияния эпидуральной и опиоидной анальгезии на частоту возникновения паралитического илеуса у послеоперационных пациентов отделения интенсивной терапии. Анестезиология и реаниматология. 2013;6:25-28. Hakobyan R.V. Comparison of epidural and opioid analgesia effects on frequency of bowel peristalsis in patients of surgical intensive care unit. Anesteziologiya i reanimatologiya = Russian Journal of Anesthesiology and Reanimatology. 2013;6:25-28. (In Russ.)
- Kronberg U., Kiran R.P., Soliman M.S.M., Hammel J.P., Galway U., Coffey J.C., Fazio V.W. A characterization of factors determining postoperative ileus after laparoscopic colectomy enables the generation of a novel predictive score. Ann Surg. 2011;253:78-81. PMID: 21233608. https://doi.org/10.1097/SLA.0b013e3181fcb83e
- De Waele J.J., De Laet I. Intra-abdominal hypertension and the effect on renal function. Acta Clin Belg. 2007;62(Suppl 2):371-374. PMID: 18284002. https://doi.org/10.1179/acb.2007.083
- Райбужис Е.Н., Фот Е.В., Гайдуков К.М., Киров М.Ю. Мониторинг внутрибрюшного давления и абдоминального перфузионного давления при срочных хирургических вмешательствах на органах брюшной полости. Анестезиология и реаниматология. 2014;(3):17-20. Rajbuzhis E.N., Fot E.V., Gaidukov K.M., Kirov M.Yu. Monitoring of intraabdominal pressure and abdominal perfusion pressure in urgent abdominal surgery. Anesteziologiya i reanimatologiya = Russian Journal of Anesthesiology and Reanimatology. 2014;(3):17-20. (In Russ.)
- Иванова А.В., Шукевич Д.Л., Радивилко А.С., Григорьев Е.В. Газ в портальной вене — редкий диагностический признак абдоминального компартмент-синдрома. Комплексные проблемы сердечно-сосудистых заболеваний. 2018;7(2):146-151. https://doi.org/10.17802/2306-1278-2018-7-2-146-151 Ivanova A.V., Shukevich D.L., Radivilko A.S., Grigoryev E.V. Portal venous gas — rare diagnostic sign of abdominal compartment-syndrome. Kompleksnyye problemy serdechno-sosudistykh zabolevaniy = Complex Issues of Cardiovascular Diseases. 2018;7(2):146-151. (In Russ.) https://doi.org/10.17802/2306-1278-2018-7-2-146-151
- Kim H.J., Kim H.-K. Idiopathic hepatic portal venous gas in a healthy young man. Int J Gen Med. 2020;13:687-692. PMID: 33061536; PMCID: PMC7519867. https://doi.org/10.2147/IJGM.S276438


