Клинический случай: применение селперкатиниба у пациента с RET-мутированным немелкоклеточным раком легкого
Автор: Казаков А.М., Лактионов К.К., Воробьева В.О., Саранцева К.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 2 т.23, 2024 года.
Бесплатный доступ
Введение. Использование современных таргетных препаратов у пациентов с немелкоклеточным раком легкого (НМРЛ), имеющих определенные соматические альтерации (генетические альтерации в генах EGFR, ALK, ROS1, BRAF, RET и др.), позволяет добиться значительных результатов, выражающихся в увеличении общей и безрецидивной выживаемости на фоне приемлемого профиля токсичности. Использование RET-ингибиторов, таких как селперкатиниб, у пациентов с НМРЛ с транслокацией в гене RET позволило значительно улучшить прогноз их заболевания, поскольку применение химио- и иммунотерапии у данной когорты пациентов является малоэффективным. Данная транслокация встречается достаточно редко - около 2-3 % случаев среди аденокарциномы легкого, однако выявление данной генетической альтерации с последующим назначением таргетной терапии значительно улучшает прогноз заболевания. Описание клинического случая. Представлен клинический случай, демонстрирующий эффективность таргетной терапии RET-ингибитором селперкатинибом после обнаружения у 60-летней пациентки с НМРЛ транслокации в гене RET с помощью метода NGS (next generation sequencing). Описаны токсичность, возникшая на фоне терапии селперкатинибом, методы ее коррекции, эффект от проведенной терапии.
Немелкоклеточный рак легкого, мутация в гене ret, ингибитор ret
Короткий адрес: https://sciup.org/140304949
IDR: 140304949 | УДК: 616.24-006.6-08:615.28 | DOI: 10.21294/1814-4861-2024-23-2-133-138
Текст научной статьи Клинический случай: применение селперкатиниба у пациента с RET-мутированным немелкоклеточным раком легкого
Немелкоклеточный рак легкого (НМРЛ) является чрезвычайно разнообразным с генетической точки зрения заболеванием, при котором встречаются десятки, если не сотни различных соматических мутаций. В качестве примера можно привести данные, размещенные на платформе My cancer genome, где представлено более 200 соматических мутаций, встречающихся при НМРЛ [1]. Эти мутации условно можно разделить на три большие группы. Первая, наибольшая на данный момент, включает в себя мутации, которые в настоящий момент не представляют клинического значения, для них не существует таргетной терапии, их прогностическое значение также пока в должной мере не изучено или их влияние на прогноз заболевание минимально. Вторая группа не так велика, она вбирает в себя мутации, для которых тоже пока нет эффективной таргетной терапии, но которые тем не менее интересны с клинической точки зрения, поскольку оказывают влияние на течение и прогноз заболевания. К ним можно отнести мутации в генах TP53, PTEN, STK11 и др. [2–4]. И, наконец, третья группа, пока наименьшая по количеству, но наиболее важная с клинической точки зрения, – это мутации, для которых существует эффективная таргетная терапия. Данная группа постепенно пополняется, и относительно недавно в нее стала входить еще одна мутация – транслокация в гене RET .
Характеристика RET-мутациии ингибитора RET – селперкатиниба
В 2020 г. FDA был ускоренно одобрен таргет-ный препарат, применяющийся при транслокации в гене RET – селперкатиниб [5]. Мутация в гене RET встречается в 1–2 % случаев неплоскокле- точного рака легкого, чаще у молодых некурящих пациентов. Наиболее частыми партнерами по транслокации для гена RET являются гены KIF5B и CCDC6, реже в качестве партнеров выступают NCOA4, TRIM33, ZNF477P, ERCC1, HTR4 и CLIP1 [6]. Образующаяся в процессе экспрессии химерного гена рецепторная тирозинкиназа обладает способностью к лиганд-независимой активации, бесконтрольно передавая потенцирующие сигналы на такие сигнальные пути, как RAS/MAPK и PI3K/ AKT, что приводит к чрезмерной пролиферации и росту опухолевой клетки [7].
Основанием для решения об ускоренной регистрации препарата стали результаты исследования LIBRETTO-001, в которое было включено 105 пациентов с диссеминированным НМРЛ, получавших до этого как минимум одну линию платиносодержащей полихимиотерапии (в среднем пациенты получили 3 линии лечения, в том числе 55 % получили ингибиторы PD-1/L1), и 39 пациентов с НМРЛ, не получавших предыдущее лечение. В группе предлеченных пациентов в 64 % случаев зарегистрированы объективные ответы (полный ответ – 2 %, частичный ответ – 62 %, стабилизация – 29 %). Средняя длительность ответа – 17,5 мес. У пациентов, ранее не получавших лечение, частота частичных ответов составила 85 %, стабилизация наблюдалась в 10 % случаев, полных ответов не было. На период наблюдения в 6 мес 90 % пациентов сохраняло ответ на терапию. Примечательно, что препарат показал хорошую интракраниальную активность, частота объективных интракраниальных ответов составила 91 %, что особенно важно, учитывая повышенную вероятность метастазирования в головной мозг у RET-мутированных пациентов. Препарат также продемонстрировал приемлемый профиль токсичности. Большинство нежелательных явлений, связанных с лечением, не требовало прерывания терапии или снижения дозы. Наиболее частые нежелательные явления III степени (артериальная гипертензия, повышение печеночных трансфераз, гипонатриемия, лимфопения) коррегировались после снижения дозы. Только 2 % пациентов прекратили прием селпер-катиниба из-за нежелательных явлений, связанных с приемом препарата [8].
Многообещающие результаты данного исследования послужили причиной ускоренной регистрации селперкатиниба для применения в рутинной клинической практике.
Клинический случай
Пациентке М., 60 лет, 15.08.21 установлен диагноз: немелкоклеточный рак правого легкого с множественными метастазами в обоих легких, внутригрудных лимфатических узлах, стадия заболевания – T3N3M1а IVА. Общее состояние на момент начала лечения оценивалось как ECOG 2 (жалобы на слабость, одышку при умеренной физической нагрузке). Компьютерная томография органов грудной клетки представлена на рис. 1.
Гистологический тип опухоли – аденокарцинома (верификация получена из надключичного лимфатического узла). Пациентка – курильщица, выкуривала по 2–3 сигареты в день в течение 30 лет, семейный анамнез отягощен – у отца был рак легкого (данных о стадии, гистологическом подтипе нет). Гистологический материал был отправлен на таргетное секвенирование методом NGS (Next-generation Sequencing) на платформе FoundationOne. Параллельно с этим было начато химиотерапевтическое лечение по схеме пеме-трексед 500 мг/м2 + карбоплатин AUC5 1 раз в 21 день (обсуждалось добавление к вышеописанной схеме бевацизумаба, однако в связи с невозможностью выполнения эзофагогастродуоденоско- пии (ЭГДС) в связи с выраженной дыхательной недостаточностью препарат сразу назначен не был, но был добавлен, начиная со 2-го курса, после выполнения ЭГДС). По данным контрольного обследования после 4 курсов – стабилизация заболевания. В это же время был получен ответ по NGS- тестированию – у пациентки выявлена транслокация CCDC6-RET fusion, статус PD-L1 – 1 %. Пациентка была включена в программу расширенного доступа по получению RET-ингибитора селперкатиниба. Учитывая временную задержку до получения селперкатиниба и стабилизацию заболевания, было решено перевести пациентку на поддерживающую терапию по схеме пеметрексед 500 мг/м2 в монорежиме. Бевацизумаб был отменен в связи с плохо контролируемыми эпизодами повышения артериального давления выше 160/90 мм рт. ст. (CTCAE grade 3). Суммарно пациентка получила 8 курсов поддерживающей терапии пеме-трекседом, после чего при очередном контрольном обследовании выявлено прогрессирование заболевания в виде увеличения в размерах некоторых опухолевых инфильтратов в легких, а также появления метастаза в головном мозге – очаг в 3 мм в правой височной доле (бессимптомный). Кроме того, больная стала отмечать нарастание одышки и слабости (рис. 2).
В связи с наличием у пациентки активирующей мутации в гене RET и прогрессированием на фоне первой линии ПХТ было решено перевести ее на терапию таргетным RET-ингибитором селперка-тинибом в стандартной дозе 160 мг 2 раза в день. Прием начат 14.10.22 в дозе 160 мг 2 раза в день (на момент начала приема препарата общий анализ крови и мочи, биохимический анализ крови, коагулограмма без клинически значимых отклонений, ЭКГ – синусовый ритм, без патологии). Через 2 нед пациентка стала отмечать субъективное улучшение состояния в виде уменьшения одышки, однако
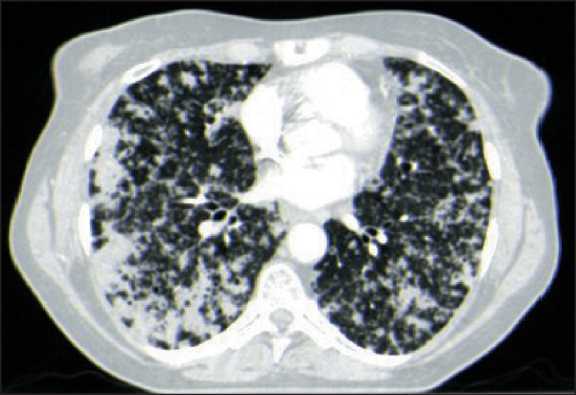
Рис. 1. КТ органов грудной клетки до начала лечения. Поражение легких по типу «снежная буря». Примечание: рисунок выполнен авторами
Fig. 1. CT scan of the chest before treatment. Lung lesions of the «blizzard» type. Note: created by the authors
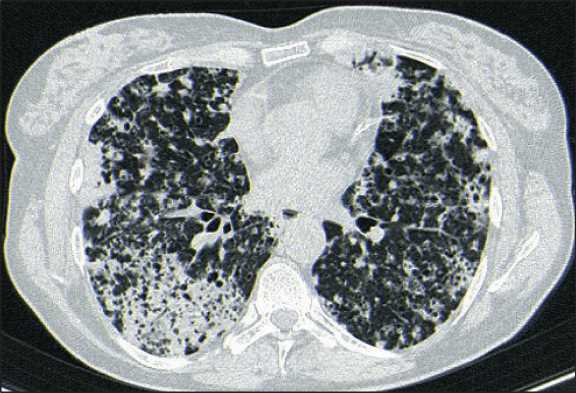
Рис. 2. КТ органов грудной клетки при прогрессировании заболевания. Увеличение опухолевых инфильтратов в легких. Примечание: рисунок выполнен авторами
Fig. 2. CT scan of the chest with disease progression.
An increase in tumor infiltrates in the lungs. Note: created by the authors
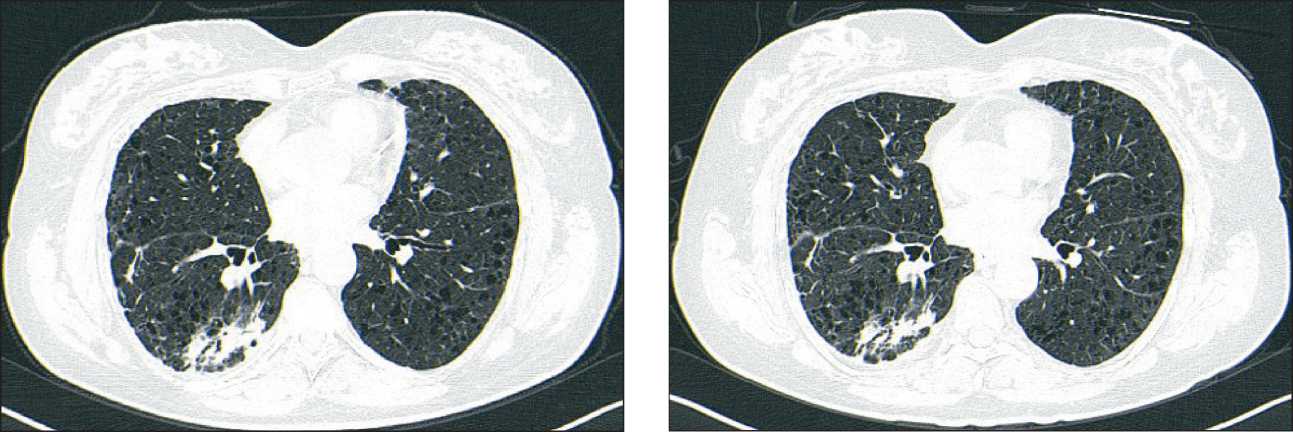
Рис. 3. КТ органов грудной клетки после 2 мес приема сел-перкатиниба. Значительное уменьшение размеров и количества опухолевых инфильтратов в легких. Примечание: рисунок выполнен авторами
Fig. 3. CT scan of the chest after two months of taking selper-catinib. Significant reduction in the size and number of tumor infiltrates in the lungs. Note: created by the authors
Рис. 4. КТ органов грудной клетки от 15.12.23. Отсутствие признаков прогрессирования заболевания.
Примечание: рисунок выполнен авторами
Fig. 4. CT scan of the chest dated December 15, 2023. No signs of disease progression. Note: created by the authors по данным контрольных анализов крови через 14 дней после начала терапии выявлено повышение АЛТ до 314 ЕД/л, АСТ до 209 ЕД/л, в остальном (общий анализ крови, мочи, коагулограмма, ЭКГ) – без клинически значимых отклонений. Рекомендована временная приостановка терапии на 48 ч с повторным контролем показателей крови. В биохимическом анализе крови через 48 ч – снижение показателей АЛТ до 189 ЕД/л и АСТ до 123 ЕД/л на фоне терапии гептралом (адеметионин) 800 мг 2 раза в день. Рекомендовано продолжить терапию в том же объеме и повторить анализы через неделю. Через 1 нед – АЛТ 192 ЕД/л, АСТ 99 ЕД/л. Пациентке проведена инфузионная терапия ремаксолом 400 мл 5 дней, стерофундином 500 мл 5 дней. Через 5 дней – АЛТ 61 ЕД/л, АСТ 39 ЕД/л. Рекомендовано возобновление терапии селперкатинибом в редуцированной на две ступени дозе – 80 мг 2 раза в день. При контрольной КТ органов грудной клетки и брюшной полости (19.12.22): выраженная положительная динамика (рис. 3). При контрольном МРТ головного мозга не визуализировался метастаз, ранее определявшийся в правой височной доле,.
Анализы крови от 26.12.22: АЛТ 63 Ед/л, АСТ 53 ЕД/л. Рекомендовано продолжить прием селперкатиниба в дозе 80 мг 2 раза в день. По данным контрольных анализов крови от 09.01.23 – АЛТ 31 ЕД/л, АСТ 44 ЕД/л – решено увеличить дозу селперкатиниба на 1 ступень – 120 мг 2 раза в день. При контрольном обследовании от 21.02.23 – продолжение положительной динамики. В анализах крови от 09.03.23 без клинически значимых отклонений. По данным контрольного обследования на период от 21.02.23 по 15.12.23 – стабилизация заболевания (рис. 4).
На момент написания статьи выживаемость без прогрессирования на фоне приема селперкати- ниба составила 14 мес. Продолжен прием препарата в максимальной дозе – 160 мг 2 раза в день.
Обсуждение
На примере представленного клинического случая видно, что препарат продемонстрировал ожидаемый противоопухолевый эффект, сравнимый с описанными эффектами, полученными в ходе клинических исследований. Несмотря на невозможность в полной мере оценить противоопухолевый эффект по классификации RECIST1.1 (поражение легких в виде «снежной бури»), при сравнении первого контрольного обследования после начала таргетной терапии с предыдущим результатом отмечается отсутствие отчетливого определения подавляющего большинства множественных метастатических узлов/очагов, в то время как ранее отмечалось практически тотальное поражение легких. Данный ответ на лечение можно приравнять к частичной регрессии. Хорошая интракраниальная активность препарата, отмеченная в клинических исследованиях, также зафиксирована в настоящем клиническом случае. Метастаз в височной доле головного мозга при первом контрольном обследовании перестал отчетливо определяться и не визуализировался на момент написания данной работы. Несмотря на значимое повышение уровня печеночных трансаминаз (Grade 3 по CTCAE 5 версии) на фоне лечения, данное нежелательное явление удалось взять под контроль при помощи сопроводительной терапии и коррекции дозы препарата. На протяжении всего периода лечения пациентка не предъявляла субъективных жалоб, ее состояние оценивалось как ECOG 0.
Исходя из полученных результатов, можно заключить, что в случае выявления транслокации в гене RET назначение соответствующей терапии ингибитором RET (в данном случае селперкатини-бом) является крайне полезной опцией, которой не стоит пренебрегать. Данная работа, хотя и является описанием всего одного клинического случая, тем не менее служит еще одним подтверждением весьма убедительных данных об эффективности препарата при наличии транслокации в гене RET, полученных в регистрационном исследовании LIBRETTO-001.
Заключение
Генетическое тестирование является чрезвычайно важной частью диагностики и последующего лечения больных НМРЛ. Несмотря на то, что некоторые мутации, не входящие в панель обязательного генетического тестирования, встречаются достаточно редко, к примеру мутация в гене RET, тестирование на данные мутации при наличии технической возможности оправдано. Эту задачу облегчает активное внедрение в клиническую практику NGS-тестирования, которое решает такие проблемы, как сроки проведения генетического тестирования, нехватка морфологического материала, точность полученного заключения. Используя возможности NGS-тестирования и подбора необходимой таргетной терапии, можно значительно улучшить эффективность диагностики и лечения пациентов с немелкоклеточным раком легкого.
Список литературы Клинический случай: применение селперкатиниба у пациента с RET-мутированным немелкоклеточным раком легкого
- AACR Project GENIE Consortium. AACR Project GENIE: Powering Precision Medicine through an International Consortium. Cancer Discov. 2017; 7(8): 818-31. DOI: 10.1158/2159-8290.CD-17-0151 EDN: YFTRWG
- Wang S., Jiang M., Yang Z., Huang X., Li N. The role of distinct co-mutation patterns with TP53 mutation in immunotherapy for NSCLC. Genes Dis. 2020; 9(1): 245-51. DOI: 10.1016/j.gendis.2020.04.001 EDN: ACXPAO
- Xiao J., Hu C.P., He B.X., Chen X., Lu X.X., Xie M.X., Li W., He S.Y., You S.J., Chen Q. PTEN expression is a prognostic marker for patients with non-small cell lung cancer: a systematic review and meta-analysis of the literature. Oncotarget. 2016; 7(36): 57832-40. 10.18632/ oncotarget.11068. DOI: 10.18632/oncotarget.11068
- Pécuchet N., Laurent-Puig P., Mansuet-Lupo A., Legras A., Alifano M., Pallier K., Didelot A., Gibault L., Danel C., Just P.A., Riquet M., Le Pimpec-Barthes F., Damotte D., Fabre E., Blons H. Different prognostic impact of STK11 mutations in non-squamous non-small-cell lung cancer. Oncotarget. 2017; 8(14): 23831-40. DOI: 10.18632/oncotarget.6379 EDN: YXLEEX
- Rodak O., Peris-Díaz M.D., Olbromski M., Podhorska-Okołów M., Dzięgiel P. Current Landscape of Non-Small Cell Lung Cancer: Epidemiology, Histological Classification, Targeted Therapies, and Immunotherapy. Cancers (Basel). 2021; 13(18): 4705. DOI: 10.3390/cancers13184705 EDN: BJXLOG
- Drusbosky L.M., Rodriguez E., Dawar R., Ikpeazu C.V. Therapeutic strategies in RET gene rearranged non-small cell lung cancer. J Hematol Oncol. 2021; 14(1): 50. DOI: 10.1186/s13045-021-01063-9 EDN: IIBAFV
- Gainor J.F., Shaw A.T. Novel targets in non-small cell lung cancer: ROS1 and RET fusions. Oncologist. 2013; 18(7): 865-75. 10.1634/ theoncologist.2013-0095. DOI: 10.1634/theoncologist.2013-0095
- Drilon A., Oxnard G.R., Tan D.S.W., Loong H.H.F., Johnson M., Gainor J., McCoach C.E., Gautschi O., Besse B., Cho B.C., Peled N., Weiss J., Kim Y.J., Ohe Y., Nishio M., Park K., Patel J., Seto T., Sakamoto T., Rosen E., Shah M.H., Barlesi F., Cassier P.A., Bazhenova L., De Braud F., Garralda E., Velcheti V., Satouchi M., Ohashi K., Pennell N.A., Reckamp K.L., Dy G.K., Wolf J., Solomon B., Falchook G., Ebata K., Nguyen M., Nair B., Zhu E.Y., Yang L., Huang X., Olek E., Rothenberg S.M., Goto K., Subbiah V. Efficacy of Selpercatinib in RET Fusion-Positive Non-SmallCell Lung Cancer. N Engl J Med. 2020; 383(9): 813-24. DOI: 10.1056/NEJMoa2005653


