Клинический случай: сочетание иммуноопосредованной тромбоцитопении и миокардита на фоне лечения немелкоклеточного рака легкого ингибиторами контрольных точек
Автор: Югай С.В., Деханова К.В., Рыков И.В., Баллюзек М.Ф.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Клинический случай
Статья в выпуске: 1 т.13, 2023 года.
Бесплатный доступ
Иммуноопосредованные нежелательные явления (иНЯ) являются актуальной проблемой современной онкологии. При лечении пациентов с солидными опухолями ингибиторами контрольных точек (анти-PD-1, анти-CTLA-4, PD-L1) частота иНЯ достигает 60-85 % [1]. Примерно в 40 % случаев иНЯ требуют полной отмены терапии [2]. К наиболее частым осложнениям этого типа относятся эндокринопатии (до 10 %), пульмониты (5-10 %), аутоимунные гепатиты (до 20 %), колиты (до 30 %), кожная токсичность (до 50 %) [3]. Другие формы нежелательных явлений, такие как гематологическая и кардиоваскулярная токсичность, встречаются крайне редко. Мы описываем клинический случай развития двух редких осложнений у пациента, получающего терапию пембролизумабом по поводу распространенной стадии PD-L1-позитивного немелкоклеточного рака легкого.
Иммуноопосредованные нежелательные явления, pd-l1 ингибиторы, фокальный миокардит, аутоиммунная тромбоцитопения, мрт сердца
Короткий адрес: https://sciup.org/140297797
IDR: 140297797 | DOI: 10.18027/2224-5057-2023-13-1-24-29
Текст научной статьи Клинический случай: сочетание иммуноопосредованной тромбоцитопении и миокардита на фоне лечения немелкоклеточного рака легкого ингибиторами контрольных точек
-
• Гематологическая и кардиоваскулярная токсичность — редкие, но опасные осложнения терапии ингибиторами контрольных точек;
-
• Спленэктомия является одним из эффективных резервных способов лечения стероид-резистентной иммунной тромбоцитопении, в том числе у онкологических пациентов;
-
• Острый миокардит может встречаться у пациентов на фоне лечения ингибиторами контрольных точек и должен быть дифференцирован с другой острой сердечно-сосудистой патологией (ОКС, ТЭЛА);
-
• МРТ является одним из ключевых методов подтверждения диагноза наравне с эндомиокардиальной биопсией. Результаты МРТ значимо коррелируют с результатами эндомиокардиальной биопсии у тропонин-позитивных пациентов без признаков ИБС;
-
• Лечение острого миокардита кортикостероидами может быть эффективно и должно быть начато при подозрении на иммунный характер заболевания.
КЛИНИЧЕСКИЙ СЛУЧАЙ
Пациент — мужчина 60 лет — поступил в нашу клинику с диагнозом: аденокарцинома верхней доли правого легкого cT4N2M1 (метастазы в контралатеральном легком). Пациент — курильщик (40 пачка /лет). Наследственность не отягощена. Из значимых сопутствующих заболеваний — ХОБЛ, вне обострения. Рост — 163 см, вес — 71 кг, площадь поверхности тела — 1,79 м 2 .
При иммуногистохимическом и молекулярно-генетическом исследовании опухолевого материала не было выявлено мутаций в генах EGFR, ALK, ROS1, HER2, BRAF. Выявлена экспрессия PD-L1 (TPS) в опухолевых клетках — 100 %. В качестве 1 линии лечения выбрана монотерапия пембролизумабом.
Пациент получил одно введение пембролизумаба в нашей клинике. Через 10 дней после введения препарата самостоятельно выполнил клинический анализ крови амбулаторно. Была выявлена тромбоцитопения 4 степени (уровень тромбоцитов — 6 × 10 9 / л). Других изменений в клиническом анализе крови не было. В дальнейшем отмечалось развитие геморрагического
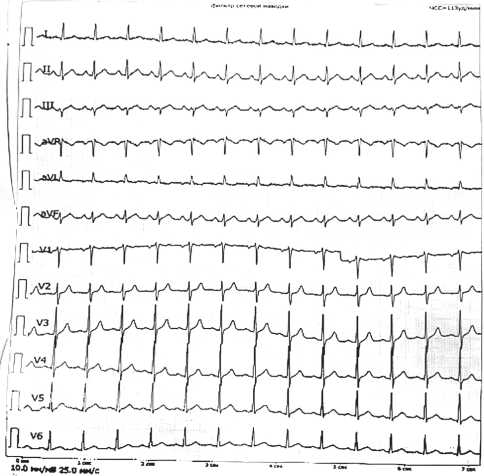
Рисунок 1. Первичная ЭКГ синдрома (пятнисто-петехиальные высыпания, носовые кровотечения). У пациента не отягощен семейный анамнез, отсутствует метастатическое поражение костного мозга, раннее не наблюдалось схожих клинических проявлений. В связи с этим осложнение расценено как иммунная тромбоцитопения на фоне применения анти-PD-L1 препаратов.
В качестве лечения пациент получал трансфузии концентрата тромбоцитов и преднизолон в дозе 1 мг / кг в течение 2 недель. Затем, в течение 4 недель получал терапию преднизолоном в дозе 2 мг / кг, без эффекта. В рамках мультидисциплинарного консилиума обсуждались различные методы лечения тромбоцитопении, такие как применение тромбопоэтинов, терапия ритук- симабом и спленэктомия. В качестве альтернативного метода лечения выбрана спленэктомия, учитывая необходимость достижения быстрого эффекта и продолжения противоопухолевого лечения.
Пациент был повторно госпитализирован в нашу клинику в отделение хирургии. Планировалась трансфузионная терапия для восстановления уровня тромбоцитов с последующим проведением операции. В день поступления пациент предъявил жалобы на острые боли за грудиной, одышку. Выполнена срочная ЭКГ, диагностированы неспецифические нарушения процессов реполяризации в II, III, V6 (рис. 1). На ЭХО-КГ — без очаговых нарушений сократимости. Тропонин I — 3,7 пг /мл. Тропонин I через 3 часа — 4,8 пг /мл. Тропонин через 6 часов — 15591 пг / мл. D-димер — 2980 нг / мл. Пациент переведен в отделение реанимации и интенсивной терапии нашей клиники.
По данным МСКТ органов грудной клетки в ангиорежиме признаки тромбоэмболии легочной артерии (ТЭЛА) отсутствовали.
Экстренная коронарография не была проведена в первые часы в силу тромбоцитопении 4 степени и высокого риска кровотечения (уровень тромбоцитов 3 × 10 9 / л). На фоне трансфузий концентрата тромбоцитов достигнут уровень 30 × 10 9 /л. Проведена коронароангиография. Признаков нарушения коронарного кровотока не выявлено (рис. 2).
Данные коронарографии, тем не менее, не исключали развитие инфаркта миокарда без обструктивного поражения коронарных артерий (Myocardial infarction with non obstructive coronary arteries — MINOCA), поэтому следующим шагом диагностики явилось выполнение магнитно-резонансной томографии сердца (cardiac magnetic resonance — CMR). По ее данным отмечены признаки острого очагового повреждения миокарда по неишемическому типу (S5, S11, S13) (рис. 3–5).
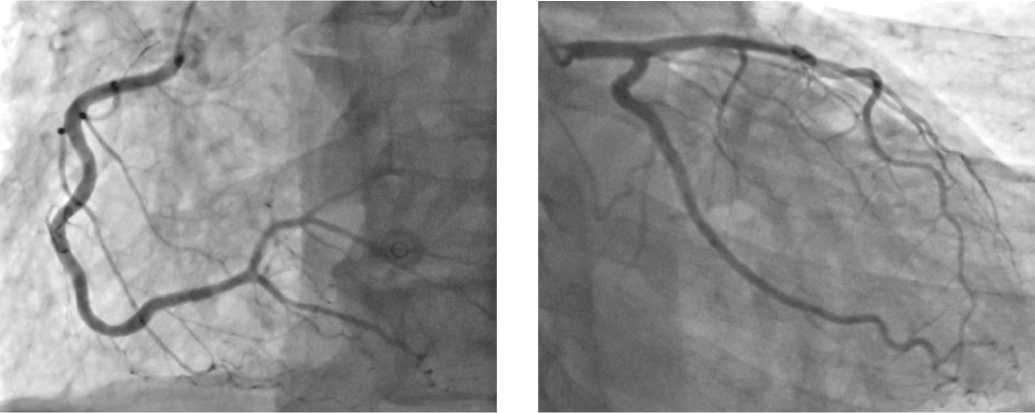
Рисунок 2. Коронарография
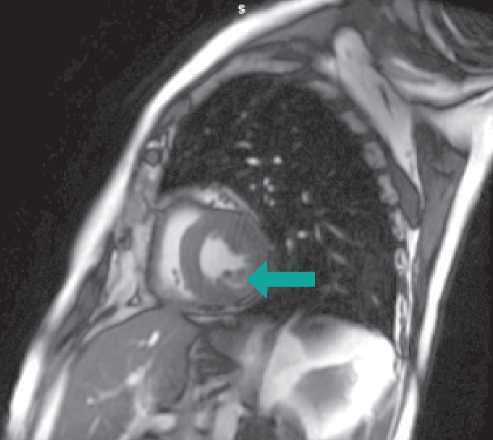
Рисунок 3. Зона миокардиального отека (базальные сегменты, задняя и задне-боковая стенки левого желудочка)
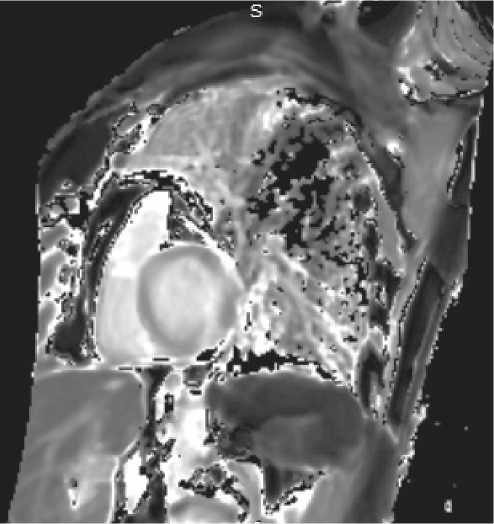
Рисунок 5. Очаги повышения релаксации времени Т1 в миокарде левого желудочка
Итак, по данным МРТ были выявлены признаки острого (до 1 месяца) повреждения миокарда по неишемическому типу с преимущественным вовлечением S5, S11, S13 сегментов левого желудочка. С учетом клинической картины, повышения уровня тропонина-I и результатов МРТ пациенту выставлен диагноз острого очагового миокардита на фоне терапии ингибиторами контрольных точек.
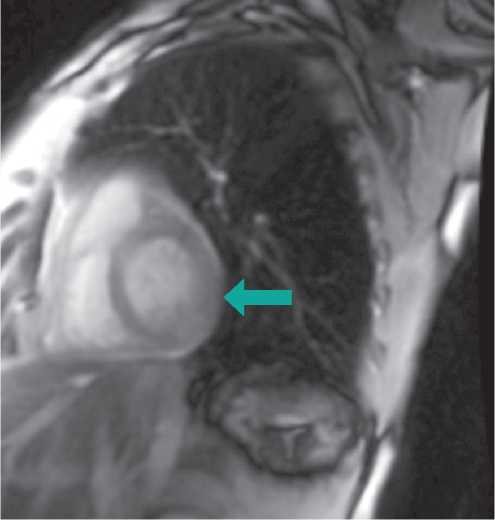
Рисунок 4. Контрастное усиление задней и задне-боковой стенки левого желудочка
Эндомиокардиальная биопсия (ЭБМ) не выполнялась не только в связи с отсутствием достаточного опыта персонала по проведению столь серьезного инвазивного метода диагностики, но и потому, что все больше исследований демонстрируют хорошую корреляцию между результатами МРТ в режиме CRM и эндомиокардиальной биопсией миокарда у тро-понин-положительных пациентов без ишемической болезни сердца
Одной из вероятных причин развития миокардита послужила терапия анти-PD-L1 препаратами (3 месяца от момента первого введения пембролизумаба). С учетом развития миокардита на фоне приема преднизолона (в рамках лечения тромбоцитопении) начата терапия метилпреднизолоном 1 г в день. На этом фоне наблюдалась стабильная клиническая картина (стойкое исчезновение болевого синдрома, одышки), снижение тропонина I в динамике (тропонин I — 686 пг / мл на 3 день), стабильная картина ЭКГ. Также назначалась кардиотропная терапия (бета-блокаторы, сартаны, ивабрадин). Отмечались признаки развития диастолической дисфункции I типа на ЭХО-КГ, раннее не выявляемые у пациента.
Пациент был переведен в отделение хирургии, в плановом порядке выполнена спленэктомия. После выполнения операции наблюдался динамический рост показателя тромбоцитов. На 5 сутки уровень тромбоцитов поднялся до 50 × 10 9 /л. Через 3 недели — до 320 × 10 9 /л. Пациент продолжил лечение в отделении онкологии и паллиативного лечения нашего госпиталя.
ДИСКУССИЯ
Сочетание двух редких осложнений, наиболее вероятно иммунопосредованной природы, является казуистической находкой. Тяжелые тромбоцитопении на фоне иммунотерапии являются предметом единичных наблюдений разных авторов. Так, Ahmad et al. описали развитие тромбоцитопении 4 степени у пациента с меланомой на фоне терапии ипилимумабом. В этом наблюдении терапия кортикостероидами и иммуноглобулином имела положительный эффект [4]. Le Royet al. описали развитие тромбоцитопении 3 степени на фоне терапии пембролизу-мабом у двух пациентов, страдающих меланомой и колоректальным раком, в обоих случаях имело место быстрое восстановление уровня тромбоцитов (спонтанное в первом случае, во втором — на фоне терапии кортискостерои-дами) [5]. Схожий случай развития тяжелой, но обратимой тромбоцитопении 4 степени был опубликован Mouri et al. у пациента с немелкоклеточным раком легкого [6]. Song et al. в 2019 году опубликовали еще один клинический случай тяжелой тромбоцитопении у пациента, уже на фоне терапии другим препаратом — пембролизума-бом. В отсутствие ответа на стероиды и иммуноглобулин тромбоцитопения была купирована с применением эл-тромбопага (препарата из группы агонистов рецепторов тромбопоэтина) [7].
Успешное применение анти-CD20 антител ритук-симаба в сочетании с агонистами рецепторов тромбо-поэтина (ромиплостим) при стероид-резистентной тромбоцитопении оказалось успешным в наблюдении Shiaun et al. [8].
Спленэктомия позволяет устранить физиологический механизм уничтожения тромбоцитов в селезенке и остается одним из резервных вариантов лечения иммунной тромбоцитопении. Крупные ретроспективные данные свидетельствуют о том, что клинически значимое повышение уровня тромбоцитов наблюдается более чем в 80% случаев после проведения спленэктомии. При этом от 50 до 70% пациентов характеризуются длительной ремиссией [9]. Этот метод наравне с использованием кортикостероидов, ритуксимаба и тромбопоэтинов фигурирует в клинических рекомендациях, в частности рекомендациях Американского общества гематологов (ASH) [10]. Применение этого метода у пациентов с солидными опухолями не изучалось в крупных исследованиях, но оказалось успешным в нашем клиническом случае.
Кардиоваскулярные осложнения, включая тяжелые, также являются крайне редким и непредсказуемым событием при использовании ингибиторов контрольных точек. Первые детальные описания подтвержденного аутоиммуного миокардита на фоне иммунотерапии представлены Johnson et al [12]. В обоих случаях миокардит возник у пациентов, получающих терапию ипилимума-бом и ниволумабом в рамках клинических исследований СheckMate 204 и DreamSeq [13,14]. Оба случая характеризовались летальным исходом, несмотря на проводимую терапию. Nghiem et al. также описали один случай развития миокардита у пациента с карциномой Меркеля, получавшего терапию пембролизумабом в рамках исследования NCT02267603 [15].
На основании анализа этих и других единичных клинических случаев, Американское общество клинической онкологии (ASCO) предложило свой алгоритм диагностики и лечения острых миокардитов, который мы использовали для принятия решений в нашем случае [16]. Нами был использован метод МРТ как вариант выбора при диагностике миокардитов в общемедицинской практике. Выбор этого метода также позволил сделать выводы о структурных повреждениях миокарда при отсутствии изменений на ЭХО-КГ и повреждения коронарных сосудов.
Также одной из ключевых особенностей случая является факт активного лечения пациента глюкокортикоидами в момент дебюта миокардита. Это могло потенциально маскировать клинические проявления и создать дополнительные трудности для дифференциальной диагностики.
Представленный нами случай описывает параллельное развитие у одного пациента двух редких осложнений, вероятнее всего имеющих иммунноопосредованную природу. Отсутствие клинических рекомендаций, основанных на доказательствах высокого качества, создает сложности при принятии решений и требует мультидисциплинарного подхода. Применение спленэктомии (в случае тромбоцитопении) и терапии глюкокортикостероидами (в случае миокардита) оказалось эффективным и не сопровождалось осложнениями. Через 3 месяца после развития вышеописанных осложнений наш пациент жив, продолжает противоопухолевую терапию, повторных эпизодов иНЯ не отмечалось.
Список литературы Клинический случай: сочетание иммуноопосредованной тромбоцитопении и миокардита на фоне лечения немелкоклеточного рака легкого ингибиторами контрольных точек
- Hryniewicki, A. T., Wang, C., Shatsky, R. A., & Coyne, C. J. (2018). Management of Immune Checkpoint Inhibitor Toxicities : A Review and Clinical Guideline for Emergency Physicians. Journal of Emergency Medicine, 55 (4), 489-502. https://doi.org/10.1016/j.jemermed.2018.07.005.
- Haanen, J. B. A. G., Carbonnel, F., Robert, C., Kerr, K. M., Peters, S., Larkin, J., & Jordan, (2017). Management of toxicities from immunotherapy : ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology, 28 (Supplement 4), iv119-iv142. https://doi.org/10.1093/annonc/mdx225.
- Gürdoğan M, Yalta K. Myocarditis associated with immune checkpoint inhibitors : Practical considerations in diagnosis and management. Anatol J Cardiol. 2020 ; 24 (2) : 68-75. https://doi.org/10.14744/AnatolJCardiol.2020.
- Zhang L., Awadalla M., Mahmood S.S., Nohria A., Hassan M.Z.O., Thuny F., et al. Cardiovascular magnetic resonance in immune checkpoint inhibitor-associated myocarditis. Eur Heart J. 2020 ; 41 : 1733-43.
- Brahmer J.R., Lacchetti C., Schneider B.J., et al. Management of Immune-Related Adverse Events in Patients Treated With Immune Checkpoint Inhibitor Therapy : American Society of Clinical Oncology Clinical Practice Guideline. National Comprehensive Cancer Network. J ClinOncol. 2018 Jun 10 ; 36 (17) : 1714-1768.
- Ahmad, S., Lewis, M., Corrie, P., &Iddawela, M. (2012). Ipilimumab-induced thrombocytopenia in a patient with metastatic melanoma. Journal of Oncology Pharmacy Practice, 18 (2), 287-292. https://doi.org/10.1177/107815521141100.
- Le Roy, A., Kempf, E., Ackermann, F., Routier, E., Robert, C., Turpin, A., Marabelle, A., Mateus, C., Michot, J. M., &Lambotte, O. (2016). Two cases of immune thrombocytopenia associated with pembrolizumab. European Journal of Cancer, 54 (August 2014), 172-174. https://doi.org/10.1016/j.ejca.2015.10.073.
- Mouri, A., Kaira, K., Shiono, A., Miura, Y., &Kagamu, H. (2020). Severe Thrombocytopenia Associated with Pembrolizumab in Patients with Non-small Cell Lung Cancer (NSCLC) : A case report and literature review. In Vivo, 34 (2), 877-880. https://doi.org/10.21873/invivo.11852.
- Song, P., & Zhang, L. (2019). Eltrombopag treatment for severe refractory thrombocytopenia caused by pembrolizumab. European Journal of Cancer, 121, 4-6. https://doi.org/10.1016/j.ejca.2019.08.003.
- Shiuan, E., Beckermann, K. E., Ozgun, A., Kelly, C., McKean, M., McQuade, J., Thompson, M. A., Puzanov, I., Greer, J. P., Rapisuwon, S., Postow, M., Davies, M. A., Eroglu, Z., & Johnson, D. (2017). Thrombocytopenia in patients with melanoma receiving immune checkpoint inhibitor therapy. Journal for ImmunoTherapy of Cancer, 5 (1), 4-9. https://doi.org/10.1186/s40425-017-0210-0.
- Chaturvedi, S., Arnold, D. M., & McCrae, K. R. (2018). Splenectomy for immune thrombocytopenia : Down but not out. Blood, 131 (11), 1172-1182. https://doi.org/10.1182/blood-2017-09-74235311.
- Neunert, C., Lim, W., Crowther, M., Cohen, A., Solberg, L., &Crowther, M. A. (2011). The American Society of Hematology 2011 evidence-based practice guideline for immune thrombocytopenia. Blood, 117 (16), 4190-4207. https://doi.org/10.1182/blood-2010-08-302984.
- Johnson, D. B., Balko, J. M., Compton, M. L., Chalkias, S., Gorham, J., Xu, Y., Hicks, M., Puzanov, I., Alexander, M. R., Bloomer, T. L., Becker, J. R., Slosky, D. A., Phillips, E. J., Pilkinton, M. A., Craig-Owens, L ., Kola, N., Plautz, G., Reshef, D. S., Deutsch, J. S., Moslehi, J. J. (2016). Fulminant Myocarditis with Combination Immune Checkpoint Blockade. New England Journal of Medicine, 375 (18), 1749-1755. https://doi.org/10.1056/nejmoa1609214.
- Tawbi, H. A., Forsyth, P. A., Algazi, A., Hamid, O., Hodi, F. S., Moschos, S. J., Khushalani, N. I., Lewis, K., Lao, C. D., Postow, M. A., Atkins, M. B., Ernstoff, M. S., Reardon, D. A., Puzanov, I., Kudchadkar, R. R., Thomas, R. P., Tarhini, A., Pavlick, A. C., Jiang, J., Margolin, K. (2018). Combined Nivolumab and Ipilimumab in Melanoma Metastatic to the Brain. New Eng J Med, 379 (8), 722-730. https://doi.org/10.1056/nejmoa1805453.
- Nghiem, P. T., Bhatia, S., Lipson, E. J., Kudchadkar, R. R., Miller, N. J., Annamalai, L., Berry, S., Chartash, E. K., Daud, A., Fling, S. P., Friedlander, P. A., Kluger, H. M., Kohrt, H. E., Lundgren, L ., Margolin, K., Mitchell, A., Olencki, T., Pardoll, D. M., Reddy, S. A., … Cheever, M. A. (2016). PD-1 Blockade with Pembrolizumab in Advanced Merkel-Cell Carcinoma. New Engl J Med, 374 (26), 2542-2552. https://doi.org/10.1056/nejmoa1603702.
- Zhang L., Awadalla M., Mahmood S.S., Nohria A., Hassan M.Z.O., Thuny F., et al. Cardiovascular magnetic resonance in immune checkpoint inhibitor-associated myocarditis. Eur Heart J. 2020 ; 41 : 1733-43


