Клиническое наблюдение хондросаркомы трахеи
Автор: Тер-ованесов М.Д., Аксарин А.А., Копейка С.М.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 1 т.24, 2025 года.
Бесплатный доступ
Актуальность. Хондросаркома трахеи является крайне редкой злокачественной опухолью, составляющей лишь 0,1 % от опухолей данной локализации. Считается, что хондросаркома (ХС) возникает из злокачественной дегенерации в мезенхимальных плюрипотентных клетках хрящевой ткани, оссифицированных хрящах, а также в энхондромах. Хондросаркома трахеи является наименее изученной опухолью данной морфологической группы. С 1959 по 2020 г. в литературе описано лишь 35 наблюдений. Это определяет то, что золотым стандартом в лечении является хирургический метод с выполнением радикального вмешательства R0. Средний возраст пациентов на момент диагностики составлял 68 лет, и в абсолютном большинстве они были представлены мужчинами - 91 %. Наиболее частыми симптомами при первичном обращении были одышка (до 80 % наблюдений). Среди ХС трахеи превалируют опухоли, локализованные в проксимальной трети, - 54 %, тогда как опухоли дистальной трети составляют 29 %. Преобладают случаи опухолей низкой степени злокачественности G1 - 54 %. Золотым стандартом в диагностике опухолей трахеи является компьютерная томография органов грудной клетки (ОГК). Цель исследования - демонстрация успешного клинического случая лечения хондросаркомы трахеи. Описание клинического случая. У пациента, 67 лет, диагностирована опухоль трахеи. Оперативное лечение выполнено 04.07.22 в объеме циркулярной резекции 2, 3 и 4-го колец трахеи с лимфодиссекцией регионарных паратрахеальных лимфоузлов, R0. Послеоперационный период протекал без осложнений. Адъювантная терапия не проводилась. При контрольном исследовании через 2 года трахеальный анастомоз свободно проходим.
Хондросаркома трахеи, хирургическое лечение, резекция трахеи, системный обзор
Короткий адрес: https://sciup.org/140309639
IDR: 140309639 | УДК: 616.231-006.33.04 | DOI: 10.21294/1814-4861-2025-24-1-164-173
Текст научной статьи Клиническое наблюдение хондросаркомы трахеи
Background. Chondrosarcoma of the trachea is an extremely rare malignant tumor, accounting for only 0.1 % of all tracheal tumors. It is believed that chondrosarcoma arises from malignant degeneration in mesenchymal pluripotent cells of cartilage tissue, ossified cartilage, and enchondromas. Chondrosarcoma of the trachea is the least-studied tumor, with only 35 cases described in the literature from 1959 to 2020. Surgery with R0 resection remains the gold standard treatment of tracheal chondrosarcoma. The median age of patients at the time of diagnosis was 68 years, and 91 % were male. The most common symptoms at the initial visit were dyspnea (up to 80 % of cases). Tumors located in the proximal third of the trachea were observed in 54 % of cases, while tumors in the distal third of the trachea were found in 29 % of cases. Low-grade tumors (G1) were the most common (54 %). Computed tomography of the chest is considered the gold standard for the detection of tracheal tumors. purpose: to demonstrate a successful case of treatment of tracheal chondrosarcoma. C ase presentation. A 67-year-old male patient was diagnosed with a tracheal tumor. On 04.07.2022, surgical treatment was performed: circular resection of the 2nd, 3rd, and 4th tracheal rings with lymph node dissection of the regional paratracheal lymph nodes R0. The postoperative period was uneventful. Adjuvant therapy was not given. At the 2-year follow-up, no anastomotic complications were reported. conclusion. To date, circular resection of the trachea (R0) with end-to-end tracheal anastomosis is the gold standard for treating tracheal chondrosarcoma. This approach was performed in 77 % of cases with the median follow-up time of more than 30 months and relapse rate of only 6 %. It should be noted that adjuvant chemotherapy was not used in these cases due to the extremely low sensitivity of the tumor to chemotherapy drugs.
Хондросаркома (ХС) трахеи является крайне редкой злокачественной опухолью, составляющей лишь 0,1 % от опухолей данной локализации. Наиболее часто ХС развиваются из хрящевой ткани крупных трубчатых костей. Среди опухолей головы и шеи ХС также является достаточно редкой, составляя также лишь 0,1 %. Наиболее часто опухоли этой локализации возникают из хрящевой ткани лица и параназальных синусов, значительно реже возникая из хрящевых структур гортани или мягких тканей парафарингеальной области. Так как доказательных обоснований туморогенеза в настоящее время не представлено, считается, что ХС возникает из злокачественной дегенерации в мезенхимальных плюрипотентных клетках хрящевой ткани, оссифицированных хрящах, а также в энхондромах [1–5]. Описано несколько синдромов, ассоциированных с высокой частотой развития ХС, включая синдром Маффуцы (Maffucci syndrome) [6, 7] – заболевание, сопровождающееся развитием доброкачественных множественных энхондром, преимущественно в костях конечностей (ладони и стопы, но могут поражаться и более крупные трубчатые кости), а также структурными изменениями в мягких тканях кожи с развитием гемангиом и лимфангиом. Следует отметить, что данный синдром увеличивает риск развития рака яичников и печени. Патогенетическим фактором развития данного синдрома является появление мутации в генах IDH1 и IDH2 в соматических клетках, определяя ненаследственный характер патологии.
Хондросаркома трахеи является наименее изученной опухолью данной морфологической группы, причем в доступной литературе за период с 1959 по 2020 г. представлено описание лишь 35 случаев, наиболее часто в виде отдельных клинических примеров [8–13]. Это определяет то, что доказательных алгоритмов лечения этой опухоли не существует, а золотым стандартом является хирургический метод с выполнением радикального вмешательства R0. Подходы к комбинированному лечению являются спорадическими и также требуют дальнейшего клинического изучения. В настоящем обзоре мы исключили данные пациентов с ХС гортани, легких и крупных бронхов.
Клинический случай
Больной П., 67 лет, обратился на консультацию к онкологу в Сургутскую окружную клиническую
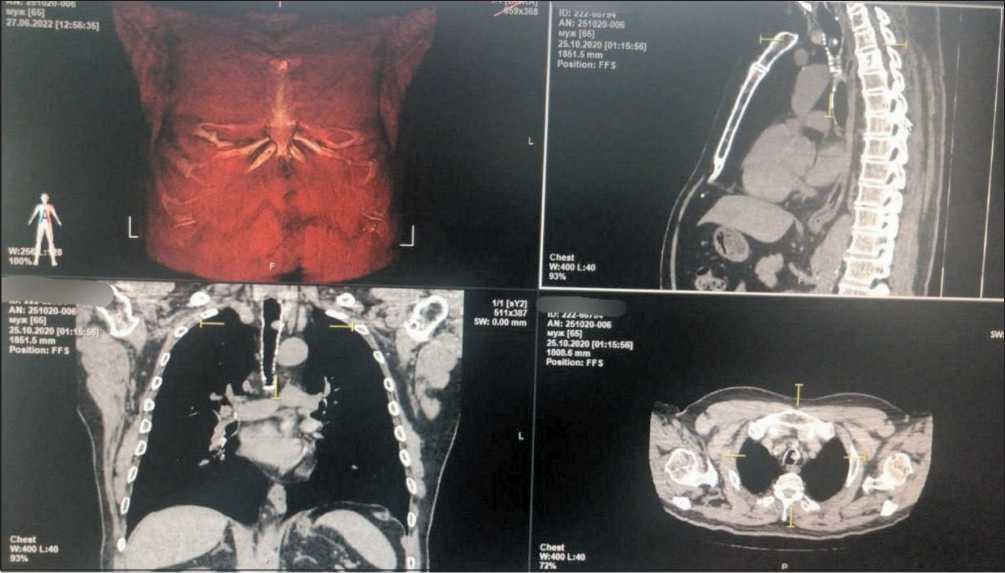
Рис. 1. КТ органов грудной клетки от 25.10.20. В трахее на уровне С7-Th1 имеется округлое образование, размерами 10×9 мм. Примечание: рисунок выполнен авторами
Fig. 1. Chest CT scan (25.10.2020) showing tumor 10×9 mm in the trachea at the level of C7-Th1. Note: created by the authors
больницу с жалобами на дискомфорт в гортани, нехватку воздуха, кашель с трудноотделяемой мокротой. Около 2 мес назад появились затруднения в дыхании. Легкие приступы удушья при физической нагрузке постепенно нарастали и стали проявляться в покое.
Из анамнеза: при вспышке коронавирусной инфекции пациенту выполнялась КТ органов грудной клетки (31.10.20): по внутренней поверхности трахеи (на уровне С7-Th1) определялось округлое образование с четкими контурами, размерами 10×9 мм (рис. 1). Участковым врачом информация о наличии опухоли трахеи была игнорирована, больному о ней не сообщили. Пациент к онкологу не направлялся.
Фибробронхоскопия: гортань без особенностей. Просвет трахеи в верхней трети (на 2,0 см дистальнее голосовой щели) перекрыт на 2/3 экзофитным опухолевым образованием, исходящим из левой боковой и передней стенок. Образование протяженностью около 2,5 см, с неровной изъязвленной поверхностью на верхушке, плотно-эластической консистенции (соединительная ткань?). Биопсия. При биопсии кровоточивость не повышена. Мембранозная часть дистонична. Слизистая истончена. Карина: по центру, острая. Сосудистый рисунок выражен. Заключение: опухоль трахеи. Пролапс задней стенки трахеи и главных бронхов.
ИГХ: комплексная иммуноморфологическая картина в объеме исследованного материала (с учетом клинических данных) позволяет предполагать наличие хондромы. Малый объем материала не позволяет достоверно верифицировать имею-щийся патологический процесс.
КТ органов грудной клетки (19.05.22.): в трахее по передней и левой латеральной стенкам определяется образование с локальным прорастанием в прилежащую паратрахеальную клетчатку, размерами 16×20 мм, в аксиальной плоскости. Данное образование значительно деформирует просвет трахеи. Признаки новообразования трахеи с распространением в прилежащую клетчатку (рис. 2).
При комплексном обследовании (ЭГДС, ФКС, УЗИ органов брюшной полости, КТ органов брюш-ной полости) данных за отдаленные метастазы нет. Проведен онкологический консилиум. Показано хирургическое лечение.
Плановое оперативное лечение выполнено 4.07.22. Положение больного на спине с валиком под лопатками и разгибанием шеи. Интубация трахеи была выполнена под фибробронхоскопическим контролем трубкой № 5 с целью профилактики травматического (интубационного) повреждения экзофитного компонента опухоли. Под комбинированным наркозом с миорелаксантами в условиях ИВЛ выполнена цервикотомия и частичная стернотомия до третьего межреберья. Выделена трахея, при этом в области 3-го и 4-го колец выявлена опухоль, деформирующая стенку трахеи по передней и левой боковой стенке, с прорастанием в паратрахеальную клетчатку (рис. 3). Начата ВЧ-вентиляция в дистальную треть трахеи, интубационная трубка удалена. Выполнена циркулярная резекция 2, 3 и 4-го колец трахеи в пределах здоровых тканей с лимфодиссекцией регионарных паратрахеальных лимфоузлов (рис. 4, 5).
Формирование межтрахеального анастомоза осуществлялось следующим способом. У края
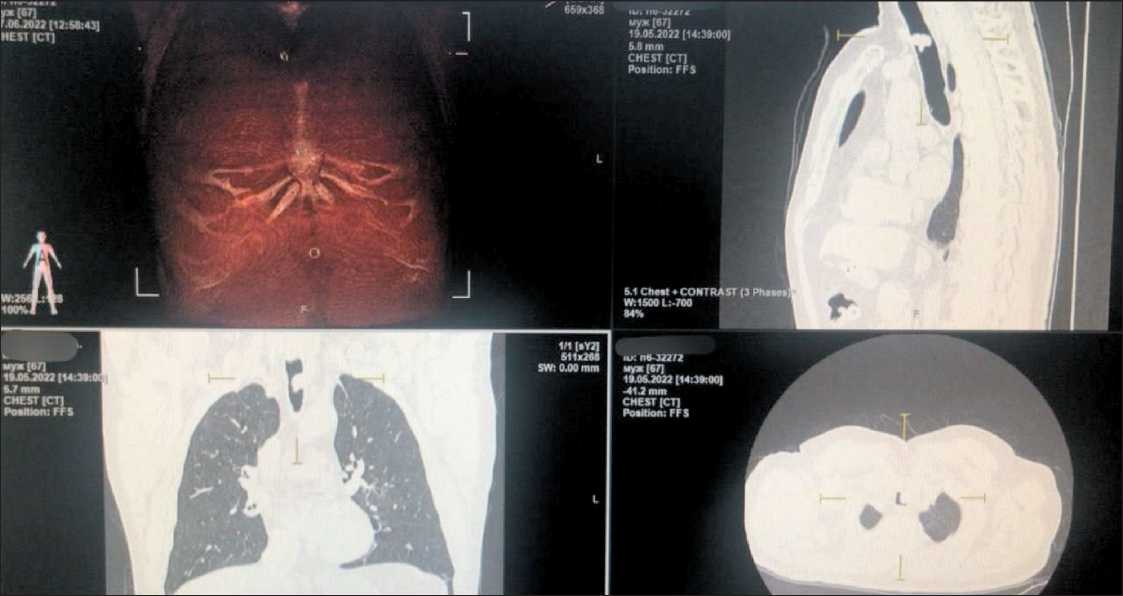
Рис. 2. КТ органов грудной клетки от 19.05.22. В трахее по передней и левой латеральной стенкам опухоль с локальным прорастанием в паратрахеальную клетчатку, размерами 16×20 мм. Примечание: рисунок выполнен авторами
Fig. 2. Chest CT scan (19.05.2022) showing tumor with local growth into the paratracheal tissue (16×20 mm) in the trachea along the anterior and left lateral walls. Note: created by the authors
хрящевых колец наложены 2 шва-держалки. На мембранозную часть трахеи наложен обвивной непрерывный шов монофиламентной нитью пролен 3/0. С помощью швов-держалок сопоставлены края трахеи и завязан шов на мембранозной части (рис. 6). На хрящевую часть трахеи наложены отдельные 8-образные швы нитью пролен 3/0 и завязаны (рис. 7). Контроль на аэростаз. Выполнено укрытие передней полуокружности анастомоза с помощью капсулы щитовидной железы путем ее прошивания (рис. 8). Загрудинно установлены 2 дренажа. Проволочные 8-образные швы на грудину. Послойное ушивание операционной раны. Подбородок нежестко фиксирован отдельными швами к коже грудной клетки без сгибания шеи по Grillo. Больной был переведен на спонтанное дыхание через 40 мин после операции, экстубирован.
Послеоперационный период протекал без осложнений. Пероральное питание смесями для сипинга начато на 3-и сут. Выписан на 10-е сут.
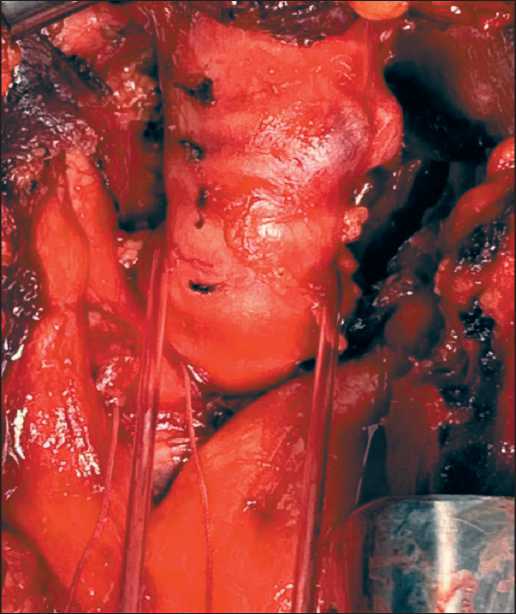
Рис. 3. Трахея с опухолью в области 3-го и 4-го колец. Примечание: рисунок выполнен авторами Fig. 3. Trachea with a tumor in the area of the 3rd and 4th rings. Note: created by the authors
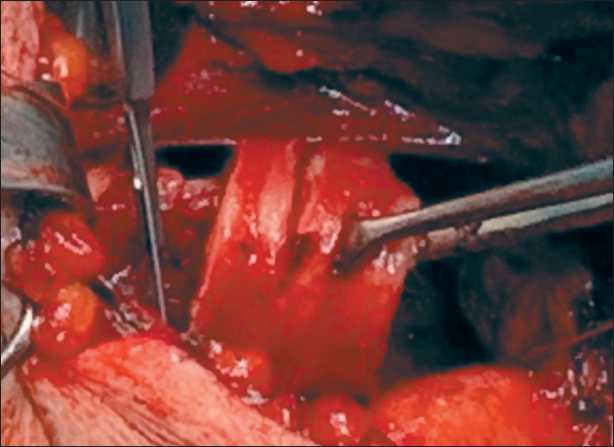
Рис. 4. Циркулярная резекция 2, 3 и 4-го колец трахеи. Примечание: рисунок выполнен авторами
Fig. 4. Circular resection of 2, 3 and 4 tracheal rings. Note: created by the authors
Патогистологическое заключение: морфологические признаки высокодифференцированной хондросаркомы. Отступ от краев опухоли в обе стороны на 0,3 см проксимально и 0,4 см дистально. Края резекции трахеи без опухолевых клеток. В 13 лимфоузлах признаки реактивных изменений, без признаков опухолевого роста.
Диагноз: Хондросаркома трахеи G1, pT1N0M0 стадия: I. Адъювантная терапия не проводилась.
Через 2 мес после операции при фибробронхо-скопии выявлены разрастания на уровне слизистой в области анастомоза. При гистологическом исследовании – грануляции. Выполнена эндоскопическая резекция грануляций.
Контрольное обследование проведено через 4, 6, 9 и 12 мес (рис. 9, 10, 11). Данных за рецидив или прогрессирование заболевания не получено. Анастомоз без рубцевания и грануляций.
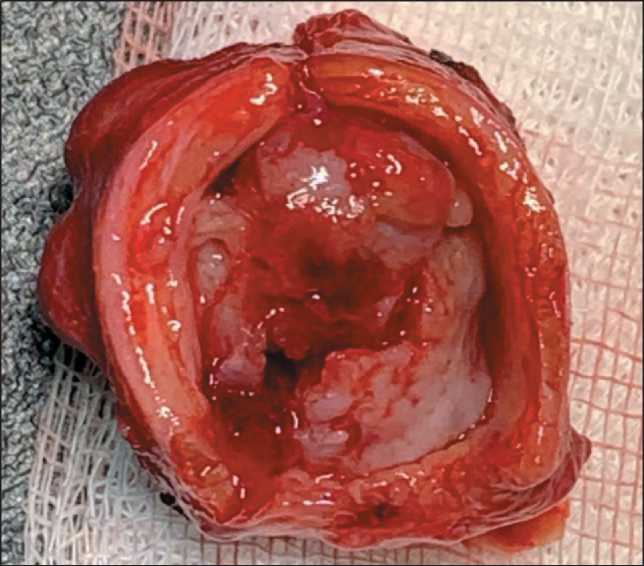
Рис. 5. Резецированная часть трахеи с опухолью. Примечание: рисунок выполнен авторами Fig. 5. Resected part of the trachea with a tumor. Note: created by the authors
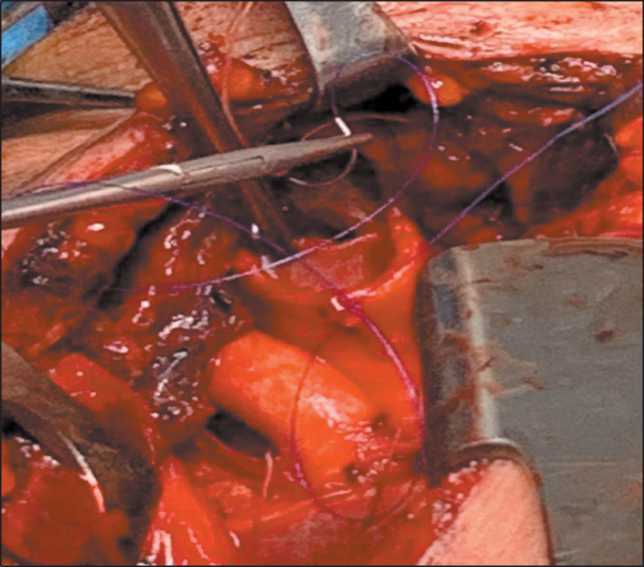
Рис. 6. С помощью швов-держалок сопоставлены края трахеи и завязан шов на мембранозной части.
Примечание: рисунок выполнен авторами Fig. 6. The suture on the membranous part trachea.
Note: created by the authors
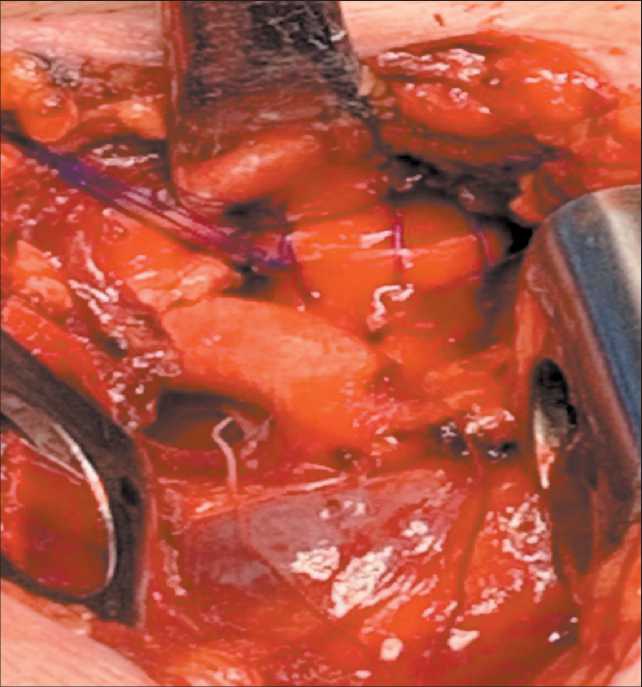
Рис. 7. На хрящевую часть трахеи наложены отдельные 8-образные швы нитью пролен 3/0.
Примечание: рисунок выполнен авторами
Fig.7. The sutures on the cartilaginous part trachea.
Note: created by the authors
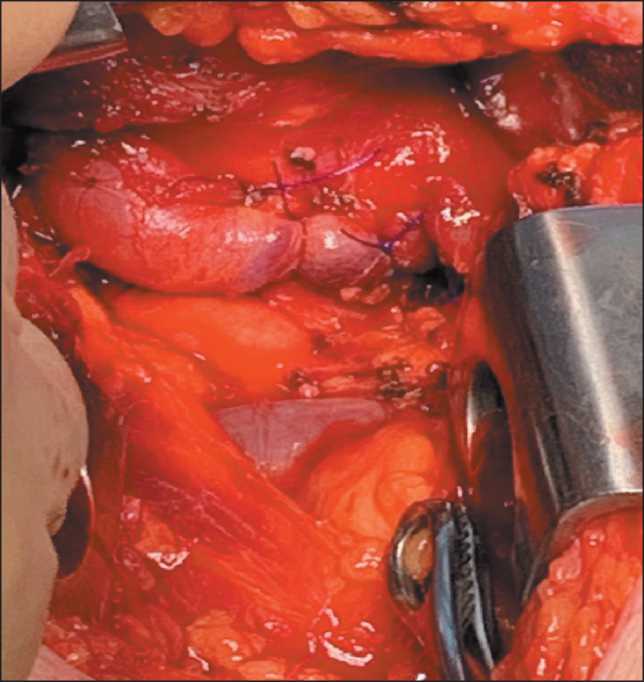
Рис. 8. Выполнено укрытие передней полуокружности анастомоза с помощью капсулы щитовидной железы путем ее прошивания. Примечание: рисунок выполнен авторами Fig. 8. The anterior semicircle of the anastomosis was covered using the thyroid capsule. Note: created by the authors
ФБС (24.07.23): в верхней трети трахеи в 2,0 см от голосовой щели определяется циркулярный рубец в месте ранее сформированного анастомоза, просвет трахеи в этой области минимально деформирован, свободно проходим. По ходу рубца определяются лигатуры. Просвет трахеи дистальнее рубца не деформирован. Слизистая физио-логической окраски. Карина по центру, острая.
При контрольном обследовании через 2 года после операции, по данным ФБС (10.07.24): в верхней трети трахеи, в 2,0 см от голосовой щели определяется циркулярный рубец в месте ранее наложенного анастомоза, просвет трахеи в этой области незначительно деформирован, свободно проходим. Просвет трахеи дистальнее рубца не деформирован. Карина по центру, острая. В дистальных отделах бронхиального дерева – без особенно-стей (рис. 12). При контрольной КТ трех зон – без признаков рецидива заболевания. В области шеи и органах грудной клетки в зоне трахеального анастомоза патологических образований не выявлено. ПЭТ/КТ: очагов патологической мета-болической активности не выявлено. Пациент сохраняет хороший функциональный статус, продолжает работать, клинически чувствует себя удовлетворительно. При умеренной физической нагрузке одышки нет.
Обсуждение
Как уже отмечалось выше, в современной литературе представлены данные лишь о 35 пациентах. Средний возраст пациентов на момент диагностики составлял 68 лет (возрастной интервал – от 58 до 75 лет), в абсолютном большинстве они были мужчинами – в 91 % случаев. Наиболее частыми симптомами при первичном обращении были одышка (до 80 % наблюдений), сухой кашель (до 40 %), а также свистящее дыхание и стридор (до 37 %).
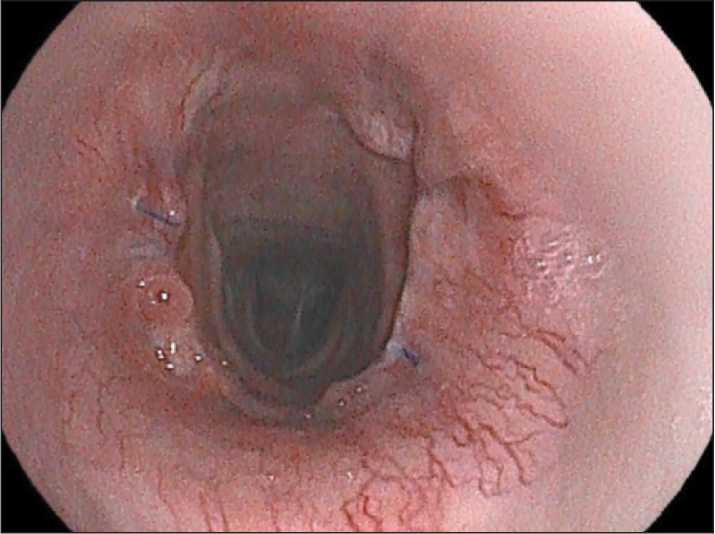
Рис. 9. Анастомоз через 4 мес.
Примечание: рисунок выполнен авторами Fig. 9. Anastomosis after four months.
Note: created by the authors
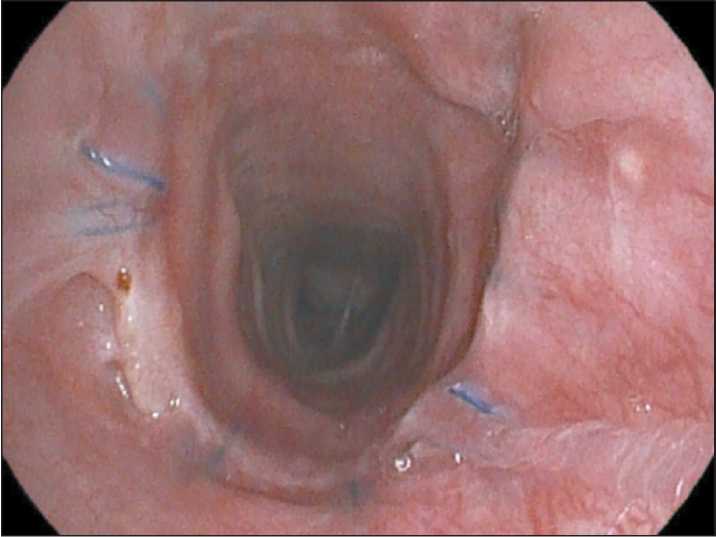
Рис. 10. Анастомоз через 6 мес.
Примечание: рисунок выполнен авторами Fig. 10. Anastomosis after six months. Note: created by the authors
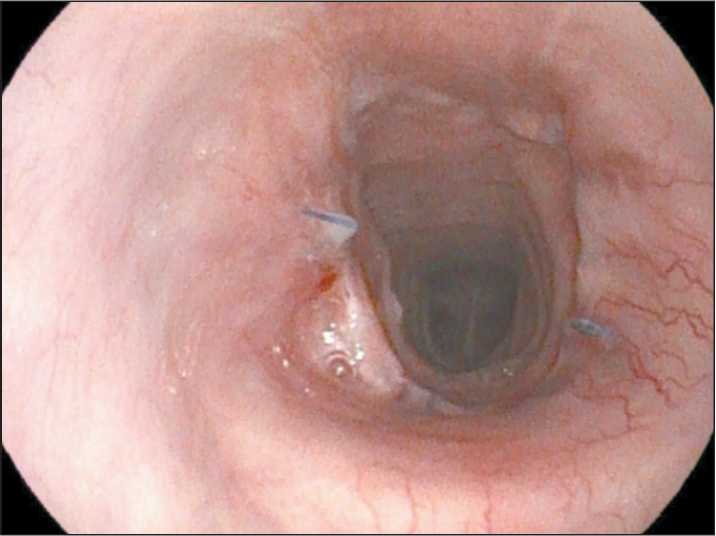
Рис. 11. Анастомоз через 1 год. Примечание: рисунок выполнен авторами Fig. 11. Anastomosis after one year.
Note: created by the authors
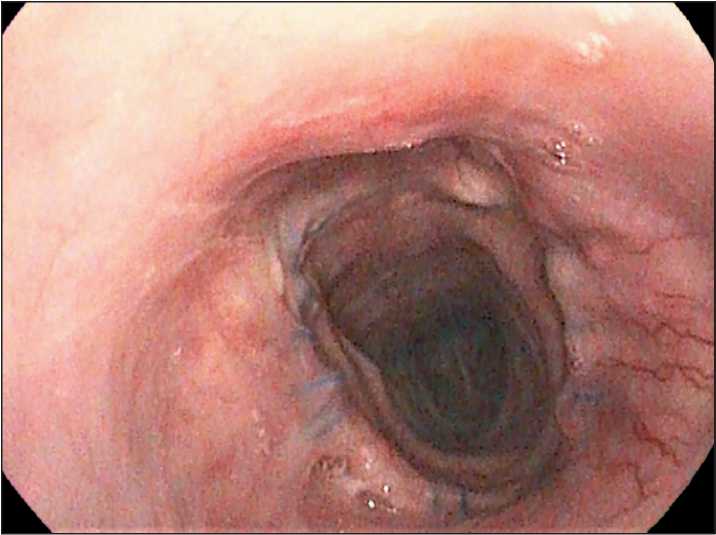
Рис. 12. Анастомоз через 2 года.
Примечание: рисунок выполнен авторами Fig. 12. Anastomosis after two years.
Note: created by the authors
Обычно последние осложнения встречаются при сужении просвета трахеи на 2/3 просвета (>75 %) и более [14]. Также достаточно часто встречались осиплость голоса, связанная с парезом возвратного гортанного нерва (до 20 %) [15]. Осложнения основного заболевания в виде дисфагии (до 6 %), а также кровохарканья выявлялись в 17 % от всех наблюдений. В среднем у абсолютного числа пациентов на момент диагностики отмечалось два и более симптома заболевания [16]. В связи с торпидным течением заболевания среднее время от появления симптомов до постановки диагноза составляло более 7 мес. Причем в большинстве случаев при первичном обращении к терапевтам пациентам выставлялся диагноз впервые возникшей бронхиальной астмы (до 20 % наблюдений) либо декомпенсации хронической обструктивной болезни легких (до 9 %), по поводу которых пациенты получали терапию без должного клинического дообследования [17, 18]. Средний размер опухоли на момент диагностики составлял около 3 см.
Следует отметить, что если в первом метаанализе, опубликованном по проблемам ХС трахеи в 2017 г. и включавшем 17 наблюдений, были представлены данные о преимущественном поражении дистальной трети трахеи (частота поражения н/3 составляла 43,8 %, в/3 – 37,5 %, с/3 – 18,8 %) [19], то в более позднем из опубликованных метаанализов [16] уже превалировали опухоли проксимальной локализации в трахее – 54 %, тогда как опухоли дистальной трети составляли 29 %, а поражение средней трети диагностировалось в 17 % случаев.
В связи с неясной причиной трансформации нормальной хрящевой ткани в опухолевую, что вызывает достаточные сложности при морфологической дифференциальной диагностике доброкачественных энхондром от ХС [20], в последних превалировали опухоли низкой степени злокачественности (G1) – 54 %, тогда как опухоли средней (G2) и высокой (G3) степени злокачественности встречались в 31 и 3 % случаев соответственно. Однако именно в последних группах наиболее часто были рецидивы после радикального лечения – в 50 % и 13 % соответственно. Кальцификация в опухолевых узлах диагностирована в 71 %, экстра-трахеальный рост опухоли – в 74 % наблюдений.
Золотым стандартом в диагностике опухолей трахеи является компьютерная томография, позволяющая описать точную локализацию первичной опухоли, связь с хрящевыми кольцами трахеи, наличие кальцинатов в опухоли как дифференциального симптома ХС, а также оценить степень обструкции трахеи и наличие перитрахеального компонента и связь опухоли с окружающими структурами [21].
В настоящее время золотым стандартом в радикальном лечении ХС трахеи являются открытые хирургические вмешательства с резек- цией пораженного органа в пределах здоровых тканей – подобный подход был выполнен в 77 % наблюдений, причем в данной группе, при среднем периоде наблюдения более 30 мес, частота рецидива составила лишь 6 %. В противоположность данному подходу в литературе описывались случаи эндоскопического удаления экзофитного компонента опухоли с возможным проведением послеоперационной адъювантной лучевой терапии на зону первичного очага и регионарные лимфатические коллекторы средостения [22]. Данный нерадикальный подход к лечению выполнялся в случаях отказа от операции либо функциональной иноперабильности пациентов [23]. В этой группе частота нерадикальных операций составила до 75 %, а частота последующего локорегионарного рецидива была наибольшей и составила до 85,7 %. Следует отметить, что адъювантная химиотерапия не применялась ни в одном наблюдении, что обусловлено крайне низкой чувствительностью опухоли к химиопрепаратам, особенно высокодифференцированной ХС. Как уже отмечалось выше, стандартом в лечении ХС трахеи является циркулярная резекция трахеи в пределах здоровых тканей, со срочным исследованием линии резекции и формированием анастомоза «конец в конец» по общим правилам трахеальной хирургии, описанным H.C. Grillo и D.J. Mathisen [20, 24]. Попытки эндоскопической шейвинг-резекции не рекомендуются, кроме случаев необходимости временного улучшения трахеальной проходимости либо в варианте паллиативного вмешательства при функциональной иноперабильности пациентов [22]. В литературе приведен лишь один случай успешного эндоскопического удаления, причем в этом наблюдении опухоль описывалась по типу грибовидной с наличием выраженной ножки. Следует акцентировать внимание, что именно в группе эндоскопических резекций морфологически выявлялось наличие резидуальной опухоли либо развитие локального рецидива, причем разница с группой радикальных операций была статистически значимой (75 vs 9 %; р=0,001). При радикальных операциях регионарный рецидив был лишь у 2 пациентов, что еще раз определяет клиническую значимость достижения адекватных негативных краев резекции, подтвержденных при срочном морфологическом исследовании [22, 25].
Значение адьювантной лучевой терапии играет крайне ограниченную роль при первичной ХС трахеи, учитывая то, что эта опухоль рассматривается как радиорезистентная [26]. В литературе представлен лишь один случай радикального хирургического лечения пациента с умеренно дифференцированной ХС трахеи, получившего адъювантную конформную лучевую терапию (ЛТ) до СОД 50 Гр с развитием локорегионарного рецидива через 4 года, потребовавшего выполнения повторного радикального хирургического удаления: при последующем наблюдении в течение 2 лет данных за рецидив или системное прогрессирование болезни не получено [27]. В остальных случаях проведение адъювантной ЛТ было обусловлено нерадикальным характером вмешательства либо противопоказаниями к его выполнению. В одном наблюдении адъювантная ЛТ после эндоскопического паллиативного удаления опухоли до СОД 60 Гр на зону первичного очага и 40 Гр на средостение обеспечила стабилизацию процесса в течение 82 мес [28].
В последнем ретроспективном когортном исследовании национальной онкологической базы (США) при анализе 5 427 случаев ХС показано, что проведение лучевой терапии характеризуется значимым улучшением 5-летней выживаемости при СОД более 60 Гр, особенно при применении современных вариантов ЛТ: протонная ЛТ, IMRT, стереотаксическая радиохирургия, особенно у пациентов с положительными краями резекции [26].
Следует отметить, что адъювантная ХТ не рассматривается как вариант комбинированного лечения, что определяется ее низкой эффективностью [29]. Согласно данным обзора, посвященного нетрахеальным ХС, системная цитотоксическая терапия способна повлиять лишь на безреци-дивную выживаемость (БРВ), в особенности у пациентов с хорошим функциональным статусом, солитарным характером отдаленных очагов, а также при комбинации различных цитотоксических агентов, не влияя в целом на общую выживаемость (ОВ). Согласно данным обзора литературы по проблеме трахеальных ХС, в общей группе пациентов при применении различных методов лечения 5-летняя БРВ составляла 58 %, тогда как опухоль-специфическая выживаемость достигала 90 % в этот период наблюдения. Эти цифры еще раз отражают индолентный характер течения ХС трахеи, особенно при опухолях низкой степени злокачественности.
Наиболее часто рецидивные опухоли выявлялись у пациентов старшей возрастной группы (75 и более лет), получавших эндоскопическое или комбинированное лечение, особенно при его нерадикальном характере. Еще одним важным фактором в развитии рецидива болезни являлась морфологическая дифференцировка, причем при низкодифференцированной ХС возникновение рецидива статистически носило пограничный


