Клиническое обоснование значимости оценки уровня эстрадиола у мужчин с синдромом гипогонадизма на фоне терапии по стабилизации уровня тестостерона
Автор: Вальвачев А.А., Пранович А.А.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Андрология
Статья в выпуске: 3 т.17, 2024 года.
Бесплатный доступ
Введение. Значимой причиной снижения эффективности тестостеронзаместительной терапии (ТЗТ) у мужчин является повышенная активность фермента ароматазы у пациентов с избыточной массой тела и ожирением, когда под его воздействием из андрогенов конвертируются эстрогены (переход тестостерона в эстрадиол) преимущественно в жировой ткани, приводящие к повышению уровня эстрадиола. То есть при экзогенном введении тестостерона эстрадиола становится с переизбытком, тем самым ослабляются и даже часто нивелируются положительные эффекты ТЗТ, появляются опасные побочные явления гиперэстрадиолемии, то есть без тщательного контроля и нормализации уровня эстрадиола эффективность ТЗТ оказывается низкой, а побочное действие терапии ввиду высокого уровня эстрогенов на организм высоким. Цель исследования. Повысить эффективность ТЗТ гипогонадизма у пациентов с ожирением. Материал и методы. Проведено двуцентровое проспективное исследование по изучению ТЗТ при гипогонадизме. Проанализированы результаты обследования и лечения 106 мужчин в возрасте 35-59 лет (средний возраст 45,9±7,2 лет) с синдромом гипогонадизма, которым была назначена ТЗТ Омнадреном 250 мг 1 мл в/м. Проводился контроль уровня общего тестостерона, эстрадиола, пролактина через 48 часов после инъекции (фармакокинетика Омнадрена: Cmax тестостерона в плазме крови наступает в течение 24-48 ч), а также уровень гормонов на 10 сутки с контролем по опроснику AMS (Опросник возрастных симптомов андрогенного дефицита Aging Male Screening).
Тестостерон, эстрадиол, гипогонадизм, ожирение
Короткий адрес: https://sciup.org/142243278
IDR: 142243278 | DOI: 10.29188/2222-8543-2024-17-3-80-85
Текст научной статьи Клиническое обоснование значимости оценки уровня эстрадиола у мужчин с синдромом гипогонадизма на фоне терапии по стабилизации уровня тестостерона
андрология экспериментальная и клиническая урология № 3 2024
Одной из значимых причин сниженной эффективности тестостеронзаместительной терапии (ТЗТ)у мужчин является повышенная активность фермента ароматазы у пациентов с избыточной массой тела и ожирением,когда под его воздействием из андрогенов конвертируются эстрогены (переход тестостерона в эстрадиол) преимущественно в жировой ткани,при-водящие к повышению уровня эстрадиола. Это приводит к негативным симптомам, схожим с симптомами гипогонадизма,и возможным осложнениям на жизненно важные системы и органы.Проведение ТЗТ без тщательного контроля эстрадиола может приводить к гиперэстрогении (гиперэстадиолемии), так как при экзогенном введении тестостерона последнего становится больше, а имеющаяся избыточная ароматизация при ожирении формирует избыточный эстрадиол,тем самым ослабляя и даже нивелируя положительные эффекты ТЗТ. Гиперэстрогения является причиной снижения сексуального влечения,эректильной дисфункции, приводит к задержке жидкости в организме, артериальной гипертензии, отечности, появления жировых отложений по женскому типу, роста молочных желез, развития депрессии, онкологическим заболеваниям. Распространенность ТЗТ имеет стойкую тенденцию к росту, поэтому тщательный контроль и стабилизация уровня эстрадиола становятся все более актуальными.
Распространенность гипогонадизма у мужчин без сопутствующих хронических заболеваний составляет около 5% случаев [1]. Однако с возрастом, а также при наличии сопутствующих хронических заболеваний,в особенности висцерального ожирения и сахарного диабета 2 типа, распространенность гипогонадизма повышается до 30% [2, 3]. Однако возраст, зачастую, не является фактором риска развития дефицита тестосте рона,в связи с чем иногда термин «возрастной гипо гонадизм» может искажать реальное понимание этиологии заболевания так как у мужчин среднего и пожилого возраста, без сопутствующей патологии кон центрация тестостерона в 6% остается в пределах нор мальных значений [5, 6]. Вероятность возникновения большинства симптомов возрастает по мере снижения плазменного уровня тестостерона по мере возникно вения именно метаболических нарушений, что прежде всего приводит к снижению либидо и эректильной дисфункции [4]. При гипогонадизме часто разви ваются многие из компонентов метаболического син дрома: ожирение, артериальная гипертензия, дислипидемия, нарушения углеводного обмена и даже мочекаменная болезнь [7-9].
Рекомендуется пороговым значением уровня об щего тестостерона считать уровень, равный 12,1 нмоль/л крови,с целью разграничения нормального уровня и потенциального дефицита тестостерона [10, 11]. Однако это очень условно, т.к. установлено, что утрата либидо или упадок жизненных сил, об условленные дефицитом тестостерона, нарастают при концентрациях тестостерона уже ниже 15 нмоль/л; накопление висцерального жира, эректильная дисфункция наблюдается при концентрациях ниже 12,1 нмоль/л, а распространенность сахарного диабета типа 2 уве личивается при уровнях ниже 10 нмоль/л [4, 12]. В то же время в Европейском исследовании старения муж чин (EMAS) было установлено, что ожирение само по себе ведет к 13-кратному увеличению риска развития гипогонадизма [13].
Целью лечения пациентов с гипогонадизмом яв ляется купирование симптомов гипогонадизма путем восстановления сывороточных уровней тестостерона до нормальных значений. Пациент должен быть пол ностью информирован о предполагаемой пользе лече ния и возможных побочных эффектах [14]. Рекомендуется назначение препаратов тестостерона мужчинам с необратимыми вариантами гипогонадизма (первич ный гипергонадотропный, вторичный гипогонадот ропный, а также смешанный) с целью замещения низкого уровня тестостерона [15, 16]. Однако тестосте рон не является конечной точкой в стероидогенезе. Особенно достоин внимания и контроля гормон эстрадиол,как наиболее активная форма эстрогенов [17]. Это особенно актуально для пациентов с избы точной массой тела и ожирением, у которых повышена активность фермента ароматазы (CYP19A1) ввиду из бытка жира,так как под воздействием этого фермента из андрогенов образуется эстроген (конвертация те стостерона в эстрадиол) преимущественно в жировой ткани [18], что приводит к повышению уровня эстра диола и соответствующим негативным симптомам, аналогичным симптомам гипогонадизма. То есть при экзогенном введении тестостерона последнего стано вится больше, а имеющаяся избыточная ароматизация формирует избыточный эстрадиол, тем самым ослаб ляя и даже часто нивелируя положительные эффекты ТЗТ, что является причиной снижения сексуального влечения, эректильной функции, задержки жидкости в организме артериальной гипертензии, отечности, по явления жировых отложений по женскому типу (зона бедер, ног, живота), роста молочных желез, развития депрессии, сердечно-сосудистых заболеваний, повы шается риск рака предстательной железы и других ло кализаций, например колоректального рака [19-22]. Иными словами – без тщательного контроля и норма лизации уровня эстрадиола эффективность ТЗТ будет низкой, а побочное действие терапии, ввиду высокого уровня эстрогенов – высоким [23].
Распространенность ТЗТ имеет стойкую тенден цию к росту, набирая популярность ввиду своей высо кой эффективности, в то же время имеющаяся проблема гиперэстрогении становится все более оче видной, поэтому тщательный контроль уровня эстра диола становится все более актуальным и обязательным.
Цель исследования – повысить эффективность те стостеронзаместительной терапии гипогонадизма у па циентов с ожирением.
МАТЕРИАЛЫ И МЕТОДЫ
В период с ноября 2022 по март 2023 г. проведено двуцентровое проспективное исследование по изуче нию ТЗТ при гипогонадизме.Проанализированы ре зультаты обследования и лечения 106 мужчин в возрасте 35-59 лет (средний возраст 45,9±7,2 лет) с синдромом гипогонадизма.
Пациенты предъявляли жалобы на резкое ослаб ление либидо, эректильной функции, депрессивность отсутствие жизненной энергии. Оценка симптомов проводилась по опроснику AMS (Опросник возраст ных симптомов андрогенного дефицита – Aging Male Screening). (рис. 1).
ОПРОСНИК ВОЗРАСТНЫХ СИМПТОМОВ МУЖЧИНЫ (AMS)2
Какие из симптомов наблюдаются у Вас в настоящее время? Пожалуйста, отметьте соответствующие квадратики для каждого симптома. Отсутствующие симптомы отметьте в квадратике “НЕТ».
Симптомы
■ Ухудшение общего самочувствия и общего состояния (общее состояние здоровья, субъективные ощущения)
-
2 Боли в суставах и мышечные боли
(боли в нижней части спины боли в суставах, в пояснице.
боли по всей спине)
-
3 Повышенная потливость
(неожиданные/внезалные периоды повышенного потоотделения.
приливы жара, независимые от степени напряжения)
-
4 Проблемы со сном
(трудности с засыпанием, на протяжении сна. ранним пробуждением, чувство усталости, плохой сон. бессонница)
-
5 Повышенная потребность во сне. частое ощущение усталости
-
6 Раздражительность
(ощущение агрессивности, раздражение по пустякам, уныние)
-
7 Нервозность
(внутреннее напряжение, суетливость, беспокойство)
-
8 Тревожность
(приступы паники)
-
9 Физическое истощение/упадок жизненных сил
(общее снижение работоспособности, пониженная активность.
отсутствие интереса к занятиям досуга, сниженная самооценка, неудовлетворенность сделанным, достигнутым, необходимость заставлять себя проявлять активность)
-
10 Снижение мышечной силы
(ощущение слабости)
-
11 Депрессия
(чувство подавленности, грусти, слезливости, отсутствие стимулов, колебания в настроении, чувство бесполезности)
-
12 Ощущение, что жизненный пик пройден
-
13 Опустошенность, ощущение -дошел до ручки»
-
14 Уменьшение роста бороды
-
15 Снижение способности и частоты сексуальных отношений
-
16 Снижение количества утренних эрекций
-
17 Снижение сексуального желания/либидо
(отсутствие удовольствия от секса, отсутствие желания сексуальных контактов)
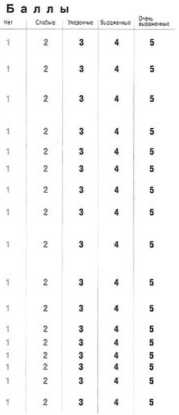
Баллы Выраженность симптомов
17-26 не выражены
27-36 слабо выражены
37-49 средней выраженности
Более 50 резко выражены
Наблюдаете ли Вы у себя какие-либо другие заметные симптомы? Да
Если «ДА», опишите_________________________________________
Общий балл____________________________________________
Рис. 1. Опросник AMS
Fig.1. AMS questionnaire
Лабораторные анализы выполнялись на базе Ме дицинской клиники ООО «А-МЕД».
Критерии включения:
-
• гипергонадотропный гипогонадизм;
-
• нормагонодотропный гипогонадизм;
гипогонадотропный гипогонадизм;
-
• уровень общего тестострона крови – 10±1,4 нмоль/л;
-
• уровень эстрадиола – 83,5±25,5 пмоль/л;
-
• нормальный уровень ГСПГ, пролактина.
Критерии невключения:
-
• эндокринологические заболевания – гипоти реоз, гипертиреоз, сахарный диабет, гиперлактатемия;
-
• заболевания печени;
-
• алкоголизм;
-
• злокачественные опухоли.
В зависимости от индекса массы тела (ИМТ) были сформированы три группы пациентов:
-
• 1-ю группу составили 35 пациента с ИМТ до 24,9 кг/м2 (норма, 22,8±1,4), средний возраст – 46,1±7,4 лет AMS 57,6±11,6,
-
• 2-ю группу составили 34 пациента с ИМТ 25 29,9 кг/м2 (избыточная масса, 27,3±1,2), средний воз раст – 45,6±7,4 лет, AMS 59,6±10,1,
-
• 3-ю группу составили 37 пациента с ИМТ от 30 кг/м2 и выше (клиническое ожирение, 35±2,2), сред ний возраст – 46,0±8,0 лет, AMS 63,1±12,4 (рис. 2).
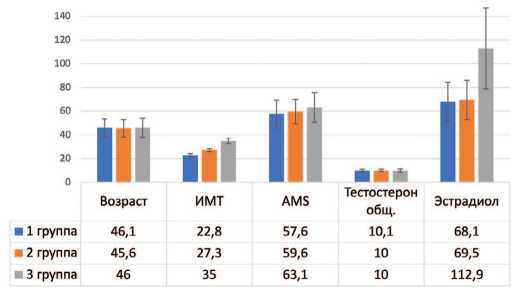
Рис. 2. Характеристика пациентов по группам
Fig. 2. Characteristics of patients by groups
Проводился контроль уровня общего тестостерона, эстрадиола, пролактина через 48 часов после инъекции (фармакокинетика Омнадрена: Cmax тестостерона в плазме крови наступает в течение 24-48 ч), а также гормоны на 10 сутки с контролем AMS. Исследования выполнялись на оборудовании: UniCe DXI800-2, Beckman Coulter, США;
Статистическая обработка данных выполнена на индивидуальном компьютере с помощью пакета прикладных программ «Statistica for Windows» v. 10.0, StatSoft Inc., Microsoft Excel.
Нормальность распределения оценивалась с использованием теста Шапира-Уилка. Сравнение групп по количественному признаку, анализ количественных данных осуществлялся при нормальном распределении каждого из сравниваемых признаков с использованием метода параметрической статистики – t-критерий Стьюдента. Статистически значимыми считались отличия при р <0,01 (99%-й уровень значимости). Корреляционный анализ взаимосвязи различных признаков был проведен с вычислением коэффициента корреляции Пирсона.
РЕЗУЛЬТАТЫ
У пациентов на фоне ТЗТ уже на вторые сутки через 48 часов статистически достоверно ( p <0,01) от мечалось повышение тестостерона, а также эстра диола: наиболее выражено до среднего значения с избыточной массой тела (ИМТ 25-30 кг/м2) до
145,7±12 ,6 пмоль/л у мужчин с ожирением (ИМТ более 30 кг/м2) до 161,9±15,0 пмоль/л (рис. 5), то есть у лиц с ожирением ароматизация тестостерона в эстрадиол была значительно выше, чем у пациентов с нормальным ИМТ (не более 25). При этом по баллам AMS также стремительно статистически достоверно ( p <0,01) отмечено улучшение во всех трех группах, од нако у пациентов 3 группы с ожирением улучшение было клинически не столь значимым (т.е. симптомп томатические изменения по AMS, слабая положитель ная динамика) ввиду существенно повышенного эстрадиола (рис. 3–5).
-
1 Группа: первый контроль (через 48 ч.)

AMS Тестостерон общ. Эстрадиол
■ До лечения 57,6 10,1 68,1
■ Первый контроль 28,1 57,3 98,6
Рис. 3. Контроль по 1 группе через 48 часов
Fig. 3. Control for group 1 after 48 hours
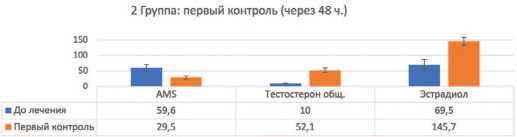
Рис. 4. Контроль по 2 группе через 48 часов
Fig. 4. Control for group 2 after 48 hours
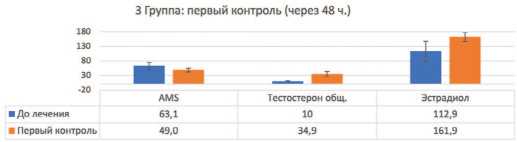
Рис. 5 Контроль по 3 группе через 48 часов
Fig. 5. Control for group 3 after 48 hours
Следующий контроль проводился на 10-е сутки. Статистически достоверно ( p <0,01) отмечались повышенный уровень тестостерона во всех трех группах по сравнению с исходными данными, а значения эстрадиола статистически значимо были выше у мужчин в третьей группе с ожирением – ароматизация тестостерона в эстрадиол была значительно выше и увеличилась еще более после первого контроля, чем у пациентов с нормальным ИМТ и даже избыточной массой тела.У пациентов 3 группы с ожирением по баллам AMS по сравнению с первым контролем статистически достоверных различий отмечено не было, то есть улучшения клинически не было значимым ввиду остающегося повышенного эстрадиола (причeм статистически достоверно стал выше через 8 суток) (рис. 6-8).
До лечения коэффициент корреляции Пирсона между уровнем эстрадиола и ИМТ составил r=0,61, что является заметной положительной корреляцией (ближе по силе к высокой); коэффициент корреляции между уровнем эстрадиола и клиническими проявлениями по AMS составил r=0,41, что является
1 Группа: второй контроль (через 10 сут.)

■ До лечения 57,6 10,1 68,1
■ Второй контроль 16,2 29,8 89,9
Рис. 6. Контроль по 1 группе через 10 суток
Fig. 6. Control for group 1 after 10 days
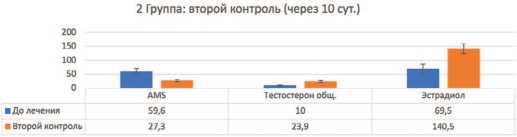
Рис. 7. Контроль по 2 группе через 10 суток Fig. 7. Control of the 2nd group after 10 days
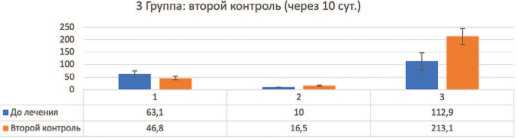
Рис. 8. Контроль по 3 группе через 10 суток
Fig. 8. Control of group 3 after 10 days умеренной положительной корреляцией,и демонст рацией того,что именно пациенты с более высоким ИМТ потенциально имеют более высокие показатели по эстрадиолу, и клинические проявления симптомов гипогонадизма (схожие с симптомами низкого тесто стерона) более выраженные.
На первом контроле коэффициент корреляции Пирсона между уровнем эстрадиола и ИМТ составил r=0,78, что является сильной положительной корре ляцией, коэффициент корреляции между уровнем эстрадиола и клиническими проявлениями по AMS составил r=0,60, что является заметной положитель ной корреляцией; коэффициенты корреляции ИМТ и AMS и уровнем эстрадиола составили r=0,81 (сильная корреляция), что явилось демонстрацией того, что именно пациенты с повышенным ИМТ потенциально будут иметь худшие результаты лечения при повы шенном эстрадиоле.
На втором контроле коэффициент корреляции Пирсона между уровнем эстрадиола и ИМТ составил r=0,87, что является сильной положительной корре ляцией, коэффициент корреляции между уровнем эстрадиола и клиническими проявлениями по AMS составил r=0,85, что является сильной положитель ной корреляцией; коэффициенты корреляции ИМТ и AMS и уровнем эстрадиола составили r=0,86 (силь ная корреляция), что явилось демонстрацией того что именно пациенты с повышенным ИМТ потенци ально будут иметь еще более худшие результаты по лечению при повышенном эстрадиоле в динамике по времени. Установлено, что клинические проявления синдрома гипогонадизма будут купироваться хуже ввиду высокого уровня эстрадиола (рис. 8).
ОБСУЖДЕНИЕ
В проведенном исследовании было установлено что уровень эстрадиола прямо пропорционально выше у пациентов с более высоким ИМТ и растет на фоне проводимой ТЗТ с сильной корреляцией по кли ническим проявлением в зависимости от ИМТ. Это сказывается на результатах лечения, нивелируя цен ность полезного действия ТЗТ на организм за счет вы сокого эстрадиола, что особенно выражено в когорте пациентов с ожирением.
Результаты нашего исследования совпадают с ра ботами А.А. Камалова с соавт. [20], G.A. Kanakis с соавт. [22] и M. Butaney с соавт. [23], которые доказали что именно по причине нераспознанности (при отсут ствии динамического контроля) высокого уровня эстрадиола в процессе ТЗТ отмечены такие осложне ния, как геникомастия, повышение артериального дав ления, отеки, подавленность, депрессивное состояние эстроген-зависимые онкологические заболевания. Ло гичным является необходимость коррекции уровня эстрадиола уже на ранних этапах препаратами с анти ароматазным действием для недопущения высокого эстрадиола и его роста в процессе терапии.
Поэтому важной задачей клинициста является не допустить осложнения ТЗТ, избежать снижения эф фективности проводимой терапии синдрома гипого надизма.а этого можно достичь только при четком контроле эстрадиола в самом начале ТЗТ как мини мум на вторые сутки,когда действие инъекционной формы препарата тестостерона максимально.
Таким образом, мы надеемся привлечь внимание специалистов к проблеме гиперэстрадиолемии при назначении терапии препаратами тестостерона, осо бенно пациентам с ожирением.
ВЫВОДЫ
-
1. Гипогонадизм не имеет специфических пато гномоничных симптомов, поэтому при обследовании пациентов, помимо тестостерона и глобулина, связы вающего половые гормоны (ГСПГ), необходимо обсле довать и на другие гормоны в комплексе: пролактин лютеинизирующий гормон (ЛГ) и особенно эстрадиол.
-
2. Уровень эстрадиола начинает значительно по вышаться уже на 2 сутки и продолжает расти после инъекции препарата тестостерона именно у пациен тов с ИМТ выше нормы,что приводит к негативным эффектам гиперэстрогении при проведении ТЗТ.
-
3. Пациенты с повышенным ИМТ имеют худшие результаты по лечению при повышенном эстрадиоле что требует контроля эстрадиола начиная со 2-3 суток с целью титрации частоты инъекций препаратов те стостерона и коррекции уровня эстрадиола до физио логических норм.
ПШАТШШП1ШЩ
РИНЦ Author ID 1119939,
Вклад авторов:
Вальвачев А.А. – концепция и дизайн исследования, сбор и статистическая обработка материала, написание текста, 50%
Пранович А.А. – концепция и дизайн исследования, сбор и статистическая обработка материала, написание текста, 50%
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Финансирование: Исследование выполнено без финансовой поддержки.
Список литературы Клиническое обоснование значимости оценки уровня эстрадиола у мужчин с синдромом гипогонадизма на фоне терапии по стабилизации уровня тестостерона
- Tajar A, Huhtaniemi IT, O'Neill TW, Finn JD, Pye SR, Lee DM, et al. Characteristics of Androgen Deficiency in Late-Onset Hypogonadism: Results from the European Male Aging Study (EMAS). J Clin Endocrinol Metab 2012;97(5):1508-16. https://doi.org/10.1210/jc.2011-2513.
- Agarwal PK, Singh P, Chowdhury S, Sharma SK, Majumdar A, Shah P, et al. A study to evaluate the prevalence of hypogonadism in Indian males with Type-2 diabetes mellitus. Indian J Endocr Metab 2017;21:64-70. https://doi.org/10.4103/2230-8210.196008.
- Ding EL, Song Y, Malik VS, Liu S. Sex Differences of Endogenous Sex Hormones and Risk of Type 2 Diabetes. JAMA 2006;295(11):1288-99. https://doi.org/10.1001/jama.295.11.1288.
- Zitzmann M, Faber S, Nieschlag E. Association of Specific Symptoms and Metabolic Risks with Serum Testosterone in Older Men. J Clin Endocrinol Metab 2006;91(11):4335-43. https://doi.org/10.1210/jc.2006-0401.
- Sartorius G, Spasevska S, Idan A, Turner L, Forbes E, Zamojska A, et al. Serum testosterone, dihydrotestosterone and estradiol concentrations in older men self-reporting very good health: the Healthy Man Study. Clin Endocrinol (Oxf) 2012;77:755–63. https://doi.org/10.1111/j.1365-2265.2012.04432.x.
- Hall SA, Esche GR, Araujo AB, Travison TG, Clark RV, Williams RE, McKinlay JB. Correlates of Low Testosterone and Symptomatic Androgen Deficiency in a Population-Based Sample. J Clin Endocrinol Metab 2008;93(10):3870-7. https://doi.org/10.1210/jc.2008-0021.
- Tan WS, Ng CJ, Khoo EM, Low WY, Tan HM. The triad of erectile dysfunction, testosterone deficiency syndrome and metabolic syndrome: findings from a multi-ethnic Asian men study (The Subang Men’s Health Study). Aging Male 2011;14(4):231-6. https://doi.org/10.3109/13685538.2011.597463.
- Tsujimura A, Miyagawa Y, Takezawa K, Okuda H, Fukuhara S, Kiuchi H, et al. Is low testosterone concentration a risk factor for metabolic syndrome in healthy middle-aged men? Urology 2013;82(4):814-9. https://doi.org/10.1016/j.urology.2013.06.023.
- West B, Luke A, Durazo-Arvizu RA, Cao G, Shoham D, Kramer H. Metabolic Syndrome and self-reported history of kidney stones: The National Health and Nutrition Examination Survey (NHANES III) 1988-1994. American Journal of Kidney Diseases 2008;51(5):741-7. https://doi.org/10.1053/j.ajkd.2007.12.030.
- Bhasin S, Pencina M, Jasuja GK, Travison TG, Coviello A, Orwoll E, et al. Reference ranges for testosterone in men generated using liquid chromatography tandem mass spectrometry in a community-based sample of healthy nonobese young men in the framingham heart study and applied to three geographically distinct cohorts. J Clin Endocrinol Metab 2011;96(8):2430-9. https://doi.org/10.1210/jc.2010-3012.
- Vesper HW, Bhasin S, Wang C, Tai SS, Dodge LA, Singh RJ, et al. Interlaboratory comparison study of serum total testoserone measurements performed by mass spectrometry methods. Steroids 2009;74(6):498-503. https://doi.org/10.1016/j.steroids.2009.01.004.
- Wu FC, Tajar A, Beynon JM, Pye SR, Silman AJ, Finn JD, et al. Identification of Late-Onset Hypogonadism in Middle-Aged and Elderly Men. N Engl J Med 2010;363(2):123-35. https://doi.org/10.1056/NEJMoa0911101.
- Grossmann M. Hypogonadism and male obesity: Focus on unresolved questions. Clinical Endocrinology 2018;89(1):11-21. https://doi.org/10.1111/cen.13723.
- Lee DM, Tajar A, Pye SR, Boonen S, Vanderschueren D, Bouillon R, et al. Association of hypogonadism with vitamin D status: the European Male Ageing Study. European Journal of Endocrinology 2011;166(1):77-85. https://doi.org/10.1530/eje-11-0743.
- Tracz MJ, Sideras K, Boloña ER, Haddad RM, Kennedy CC, Uraga MV, et al. Testosterone use in men and its effects on bone health. A Systematic review and meta-analysis of randomized placebo-controlled trials. J Clin Endocrinol Metab 2006;91(6):2011-6. https://doi.org/10.1210/jc.2006-0036.
- Isidori AM, Giannetta E, Greco EA, Gianfrilli D, Bonifacio V, Isidori A, et al. Effects of testosterone on body composition, bone metabolism and serum lipid profile in middleaged men: a metaanalysis. Clin Endocrinol (Oxf) 2005;63(3):280-93. https://doi.org/10.1111/j.1365-2265.2005.02339.
- Дедов И.И., Мельниченко Г.А., Фадеев В.В. Эндокринология. ГЭОТАРМедиа 2007;21(3):220-3. [Dedov I.I., Melnichenko G.A., Fadeev V.V. Endocrinology. GEOTARMedia 2007;21(3):220-3. (In Russian)].
- MacDonald AA, Herbison GP, Showell M, Farquhar CM. The impact of body mass index on semen parameters and reproductive hormones in human males: a systematic review with metaanalysis. Human reproduction update 2010;16(3):293-311. https://doi.org/10.1093/humupd/dmp047.
- Павлова З.Ш., Камалов А.А., Голодников И.И. Гиперэстрогения у мужчин – надуманная проблема или объективная реальность? Эффективны и безопасны ли ингибиторы ароматазы? Эндокринология: новости, мнения, обучение 2020;9(4):47-58. [Pavlova Z.Sh., Kamalov A.A., Golodnikov I.I. Hyperestrogenism in men – a far-fetched problem or an objective reality? Are aromatase inhibitors effective and safe? Endokrinologiya: novosti, mneniya, obucheniye = Endocrinology: news, opinions, training 2020;9(4):47-58. (In Russian)]. https://doi.org/10.33029/2304-9529-2020-9-4-47-58.
- Камалов А.А., Павлова З.Ш., Гострый А.В., Охоботов Д.А., Василевский Р.П. Метаболиты эстрогенов и их патогенетическая роль при раке предстательной железы (обзор). Технологии живых систем 2016;13(1):5-16. [Kamalov A.A., Pavlova Z.Sh., Gostry A.V., Okhobotov D.A., Vasilevsky R.P. Estrogen metabolites and their pathogenetic role in prostate cancer (review). Tekhnologii zhivykh sistem = Technologies of living systems 2016;13(1):5-16. (In Russian)].
- Basu A, Seth S, Arora K, Verma M. Evaluating estradiol levels in male patients with colorectal carcinoma. J Clin Diagn Res 2015;9(1):8-10. https://doi.org/10.7860/jcdr/2015/10508.5397.
- Kanakis GA, Nordkap L, Bang AK, Calogero AE, Bártfai G, Corona G, et al. EAA clinical practice guidelines-gynecomastia evaluation and management. Andrology 2019;7(6):778-93. https://doi.org/10.1111/andr.12636.
- Butaney M, Thirumavalavan N, Balasubramanian A, McBride JA, Gondokusumo J, Pastuszak AW, Lipshultz LI. Treatment of estrogen levels in the management of hypogonadism: an anonymous survey of issm members. Urology 2020;139:104-9. https://doi.org/10.1016/j.urology.2020.01.032.


