Клиническое значение суточного мониторирования артериального давления в прогнозировании развития артериальной гипертензии у больных подагрой
Автор: Губанова М.В., Кушнаренко Н.Н., Караваева Т.М.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.36, 2021 года.
Бесплатный доступ
Цель исследования: разработать модель ранней диагностики артериальной гипертензии (АГ) у больных подагрой, основанную на данных суточного мониторирования артериального давления (СМАД).Материал и методы. Проведено одномоментное поперечное проспективное исследование 69 пациентов с подагрой. Было выделено 3 исследуемые группы: 1-я группа (основная) - 41 мужчина с подагрой и АГ, 2-я группа (группа сравнения) - 28 мужчин с подагрой с нормальным уровнем АД, 3-я группа (контрольная) включала 30 относительно здоровых мужчин. СМАД проводили в амбулаторных условиях прибором BPLab («Петр Телегин», Россия).Результаты. Были выявлены статистически значимые межгрупповые различия по показателям минимального, среднего, максимального суточного систолического артериального давления (САД) у пациентов основной группы и группы сравнения (р
Подагра, артериальная гипертензия, суточное мониторирование артериального давления
Короткий адрес: https://sciup.org/149139340
IDR: 149139340 | УДК: 616-002.78-06-037:616.12-008.331.1-07 | DOI: 10.29001/2073-8552-2021-36-3-104-110
Текст научной статьи Клиническое значение суточного мониторирования артериального давления в прогнозировании развития артериальной гипертензии у больных подагрой
Подагра является самой распространенной формой воспалительного артрита, обусловленной отложением кристаллов моноурата натрия (МУН), образующихся в результате длительной гиперурикемии [1]. Помимо «классических» суставных проявлений подагра характе- ризуется высокой частотой сопутствующих заболеваний, прежде всего, почек и сердечно-сосудистых патологий, а также высокой смертностью, превышающей популяционную [2]. Особый вклад в развитие и прогрессирование сердечно-сосудистых осложнений при подагре вносит артериальная гипертензия (АГ) [3, 4]. Последние два десятилетия посвящены исследованию сложных клинико-патогенетических взаимодействий повышенного уровня мочевой кислоты и АГ [5, 6]. Действительно, повышение уровня мочевой кислоты сыворотки крови в результате воздействия внешнесредовых и генетических факторов способствует инициации иммуновоспалитель-ных нарушений, окислительного стресса, циклооксигеназы-2, пролиферации эндотелия, гломерулотубулярного повреждения, формированию тубулоинтерстициального фиброза, нейрогуморальной активации, индуцирующих повышение артериального давления (АД) [7, 8]. В свою очередь наличие АГ способствует утяжелению некоторых сопутствующих состояний – инсулинорезистентности, дислипидемии, хронической болезни почек, создавая порочный круг причинно-следственных взаимосвязей повышенного уровня уратов и развития подагры в будущем [5, 9]. Таким образом, ранняя диагностика и лечение АГ у больных подагрой является важным в плане контроля связанных с АГ сопутствующих состояний [3].
Цель исследования: разработать модель ранней диагностики АГ у больных подагрой, основанную на данных суточного мониторирования АД (СМАД).
Материал и методы
В течение 2011–2016 гг. проведено одномоментное поперечное исследование с участием 69 пациентов
Критерии включения: пациенты мужского пола с подтвержденным диагнозом подагры, установленным в соответствии с рекомендациями ACR/EULAR (2015) [10] или имеющие один или несколько критериев S.L Wallace (1977) [11].
Критерии исключения: наличие ишемической болезни сердца, сахарного диабета, дебют АГ до возникновения вспышки подагрического артрита, наличие острых воспалительных и хронических заболеваний в стадию обострения, алиментарно-конституциональное ожирение.
Были выделено 3 исследуемые параллельные группы: 1-я группа (основная) - 41 мужчина с подагрой и АГ, 2-я группа (группа сравнения) - 28 мужчин с подагрой с нормальным уровнем АД, 3-я группа (контрольная) включала 30 относительно здоровых мужчин.
Исследование одобрено этическим комитетом Читинской государственной медицинской академии Министерства здравоохранения Российской Федерации (протокол № 64 от 23.06.2014 г.). Перед проведением комплекса необходимых исследований получено информированное добровольное согласие пациентов, работа выполнена в соответствии с требованиями Хельсинкской декларации Всемирной медицинской организации (2013).
Всем пациентам проведено общеклиническое и лабораторное (определение концентрации мочевой кислоты сыворотки крови) обследование. СМАД проводили в амбулаторных условиях прибором BPLab («Петр Телегин», Россия), позволяющим анализировать показатели периферического и центрального аортального давления. Интервал измерений составлял 15 мин днем (06:00– 22:00) и 30 мин ночью (22:00– 06:00). Изучали общепринятые параметры СМАД: средние значения АД, вариабельность АД, индексы гипер- и гипотензии, степень ночного снижения АД.
Статистическая обработка результатов исследования осуществлялась с помощью пакета программ IBM SPSS STATISTICS, Version 25.0 (IBM, США). При проведении статистического анализа авторы руководствовались принципами Международного комитета редакторов медицинских журналов (ICMJE) и рекомендациями
«Статистический анализ и методы в публикуемой литературе» (SAMPL) [12]. Учитывая численность исследуемых групп (менее 50), оценка нормальности распределения признаков проводилась с помощью W-критерия Шапиро - Уилка, который в данной ситуации является наиболее эффективным, так как обладает большей мощностью по сравнению с альтернативными критериями проверки нормальности. В отсутствие нормальности распределения признаков данные представлены в виде медианы, первого и третьего квартилей ( Me [ Q1, Q3 ]). Различия количественных показателей в трех независимых группах пациентов выявлялись по критерию Краскела – Уоллиса. Апостериорные попарные сравнения количественных показателей в группах проводились по критерию Манна - Уитни с поправкой Бонфер-рони. Для определения степени линейных взаимосвязей между возможными предикторами АГ у больных подагрой использовали коэффициент корреляции Спирмена. Силу связи между исследуемыми параметрами оценивали по шкале Чеддока [13]. Методом логистической регрессии была создана модель, позволяющая прогнозировать развитие АГ у больных подагрой [13]. Для анализа качества предлагаемой прогностической модели был выполнен ее ROC-анализ [13].
Результаты во всех случаях считали статистически значимыми при р < 0,05.
Результаты и обсуждение
В исследование были включены 69 мужчин в возрасте 52,0 [41,3; 57,8] лет с диагнозом «подагра» с различным клиническим течением заболевания (интермиттирующим и хроническим), одинаково сопоставимым по дозе ингибитора ксантиноксидазы (аллопуринола). Медиана возраста дебютa подагры составила 43,0 [36,0; 47,0] года. У преобладающего большинства пациентов (58 человек, 84%) отмечалось классическое начало заболевания (интенсивные боли в I плюснефаланговом суставе большого пальца стопы). У 11 (16%) мужчин начало болезни имело атипичную картину, что послужило причиной поздней диагностики подагры (табл. 1).
Нами были изучены основные показатели периферической гемодинамики методом СМАД с оценкой суточных показателей (минимального, среднего и максимального) систолического (САД), диастолического (ДАД) и пульсового давления (ПД), таблица 2.
Установлено, что у больных подагрой, страдающих АГ, медиана среднесуточного САД была на 10,5% выше значений медианы среднесуточного САД у пациентов с подагрой с нормальным уровнем АД и на 14% выше медианы среднесуточного САД у здоровых лиц.
Кроме того, у пациентов 1-й группы медиана среднесуточного ДАД увеличивалась в среднем на 11,5% по сравнению со 2-й группой и на 8,5% – по сравнению с 3-й группой.
При анализе параметров ПД установлено, что медиана среднесуточного ПД у больных подагрой с АГ превышала медиану данного показателя в контрольной группе в 1,31 раза и в группе сравнения – в 1,21 раза.
Обращает на себя внимание тот факт, что медианные показатели среднесуточного ПД у пациентов 2-й группы увеличивались относительно контрольной группы в 1,16 раза, что может указывать на повышение жесткости крупных артерий у мужчин, страдающих подагрой с нормальными цифрами АД.
Таблица 1. Клиническая характеристика больных подагрой в исследуемых группах, df = 2
Table 1. Clinical characteristics of patients with gout in the study groups, df = 2
|
Показатели Parameters |
Исследуемые группы Study groups |
|
|
1-я группа, n = 41 Group 1, n = 41 |
2-я группа, n = 28 Group 2, n = 28 |
|
|
Длительность заболевания, лет Duration of disease, years |
7,5 [3,0; 13,5]* |
2,0 [1,0; 3,0] |
|
Частота рецидивов артрита в год Frequency of arthritis relapses per year |
4,0 [2,0; 7,0]* |
2,0 [0,5; 2,0] |
|
Количество пораженных суставов Number of affected joints |
5,0 [2,0; 7,0]* |
2,0 [1,0; 2,0] |
|
Длительность артрита, дни Duration of arthritis, days |
6,0 [5,0; 15,0]* |
3,0 [2,0; 4,0] |
|
Уровень мочевой кислоты, мкмоль/л Uric acid level, mmol/L |
614,4 [509,2; 680,8]* |
507,66 [472,28; 578,4] |
|
Холестерин липопротеинов высокой плотности, ммоль/л High-density lipoproteins, mmol/L |
0,98 [0,93; 1,3] |
1,2 [1,15; 1,25] |
|
Холестерин липопротеинов низкой плотности, ммоль/л Low-density lipoproteins, mmol/L |
2,5 [1,5; 3,3]* |
3,6 [3,5; 3,7] |
|
Триглицериды, ммоль/л Тriglycerides, mmol/L |
2,4 [1,7; 5,4]* |
2,1 [1,7; 3,8] |
|
Холестерин, ммоль/л Cholesterol, mmol/l |
5,16 [4,6; 5,6] |
5,5 [5,3; 5,8] |
|
Индекс атерогенности, ммоль/л Atherogenic index, mmol/L |
4,3 [3,4; 4,8]* |
3,75 [3,5; 3,8] |
|
Индекс массы тела, кг/м2 Body mass index, kg/m2 |
30,6 [28,2; 33,1] |
29,9 [26,7; 32,1] |
Примечание: * – р < 0,01 – статистическая значимость различий пациентов с подагрой и пациентов контрольной группы.
Note: *– р < 0.01 – significant differences between patients with gout and patients of control group.
Таблица 2. Показатели периферической гемодинамики в исследуемых группах, df = 2
Table 2. Parameters of peripheral hemodynamics in the study groups, df = 2
|
Клинические параметры Clinical parameters |
Исследуемые группы Study groups |
||
|
1-я группа, n = 41 Group 1, n = 41 |
2-я группа, n = 28 Group 2, n = 28 |
3-я группа, n = 30 Group 3, n = 30 |
|
|
Суточное САД min, мм рт. ст. Lowest 24-hour SBP, mm Hg |
104,2 [102,0; 106,4] *,*** |
95,7 [94,5; 97,0] |
89,9 [88,4; 91,5] |
|
Суточное САД mean, мм рт. ст. Mean 24-hour SBP, mm Hg |
134,6 [132,8; 136,4] *,*** |
119,6 [118,5; 120,6] |
114,9 [113,3; 116,4] |
|
Суточное САД max, мм рт. ст. Highest 24-hour SBP, mm Hg |
167,1 [164,4; 169,7] *,*** |
148,4 [146,5; 150,2] |
142,8 [140,3; 145,3] |
|
Суточное ДАД mean, мм рт. ст. Mean 24-hour DBP, mm Hg |
78,9 [77,1; 80,7] *, *** |
70,2 [69,1; 71,3] |
72,4 [71,1; 73,7] |
|
Суточное ДАД max, мм рт. ст. Highest 24-hour DBP, mm Hg |
109,0 [106,7; 111,3] *,*** |
96,0 [93,6; 98,2] |
98,8 [96,3; 101,2] |
|
Суточное ПД min, мм рт. ст. Lowest 24-hour PBP, mm Hg |
35,1 [33,6; 36,6] *,*** |
31,8 [30,8; 32,9] ** |
28,3 [27,4; 29,3] |
|
Суточное ПД mean, мм рт. ст. Mean 24-hour PBP, mm Hg |
55,8 [54,3; 57,3] *, *** |
49,9 [48,8; 51,1] ** |
42,6 [41,7; 43,4] |
|
Суточное ПД max, мм рт. ст. Highest 24-hour PBP, mm Hg |
81,8 [79,3; 84,2] *,*** |
70,6 [68,3; 72,9] ** |
59,5 [57,8; 61,2] |
Примечание: * – р < 0,001 – статистическая значимость различий основной группы и группы сравнения, ** – р < 0,05 – статистическая значимость различий группы сравнения с контрольной группой, *** – р < 0,001 – статистическая значимость различий основной группы с контрольной группой. Note: * – р < 0.001 – significant differences between main group and comparison group. ** – р < 0.05 – significant differences between comparison group and control group, *** – р < 0.001 significant differences between main group and control group.
Согласно современным представлениям, среднесуточная величина пульсового АД > 53 мм рт. ст. ассоциируется с высокой частотой сердечно-сосудистых осложнений и неблагоприятным прогнозом у больных АГ [14].
Важным критерием, определяющим безопасный уровень АД, является индекс времени (ИВ). Данный показатель определяет процент времени, в течение которого величины АД превышают критический («безопасный») уровень, т. е. демонстрирует, в каком проценте времени от общей длительности мониторирования АД было выше
(ниже) нормального, причем условной границей нормы для дневного времени считается 140/90, а для ночного – 125–130/80 мм рт. ст. ИВ у большинства здоровых лиц колеблется от 10 до 20% и не превышает 25%. Значение ИВ для САД более 25% считается патологическим, что дает основание для постановки диагноза лабильной АГ. Стабильная АГ диагностируется при ИВ не менее чем у 50% пациентов в дневное и ночное время [15]. На основании анализа этого показателя у пациентов основной группы диагностирована систоло-диастолическая (лабильная и стабильная) АГ. В данную группу были внесены пациенты с ИВ, превышающим 25% (табл. 3).
Установлено, что у больных подагрой, страдающих АГ, медианные значения ИВ САД днем, ИВ САД ночью, ИВ ДАД днем увеличивались относительно группы сравнения более чем в 7 раз ( р < 0,001), величины ИВ ДАД ночью – в 4,4 раза ( р < 0,001).
Медианные показатели ИВ САД днем и ИВ САД ночью у больных подагрой с АГ превышали аналогичные показатели контрольной группы более чем в 8,43 раза (р < 0,001). Медианы ИВ ДАД днем и ИВ ДАД ночью у больных 1-й группы превышали таковые 3-й группы более чем в 3,25 раза (р < 0,001).
Были определены значимые независимые предикторы развития АГ у больных подагрой - показатели СМАД, построена модель бинарной логистической регрессии, на основе которой был получен алгоритм для ранней диагностики АГ у больных подагрой (табл. 4).
Таблица 3. Показатели индекса времени в исследуемых группах, df = 2
Table 3. Time index values in the study groups, df = 2
|
Клинические параметры Clinical parameters |
Исследуемые группы Study groups |
Уровень статистической значимости различий Statistical significance |
||
|
1-я группа, n = 41 Group 1 n = 41 |
2-я группа, n = 28 Group 2 n = 28 |
3-я группа, n = 30 Group 3 n = 30 |
||
|
ИВ САДд SBP TI, day |
47,7 [42,2; 53,2] |
6,4 [5,1; 7,8] |
4,4 [3,0; 5,7] |
< 0,001 |
|
ИВ САДн SBP TI, night |
49,7 [43,3; 56,2] |
6,4 [5,3; 7,6] |
8,2 [6,2; 10,2] |
< 0,001 |
|
ИВ ДАДд DBP TI, day |
29,2 [24,0; 34,4] |
4,0 [2,7; 5,3] |
7,7 [5,5; 9,8] |
< 0,001 |
|
ИВ ДАДн DBP TI, night |
41,5 [34,8; 48,1] |
9,4 [6,9; 11,8] |
15,3 [12,5; 18,2] |
< 0,001 |
Таблица 4. Коэффициенты регрессии в разработанной модели
Table 4. Regression coefficients in the developed model
|
Модель Мodel |
B |
Среднеквадратичная ошибка Root-mean-square error |
Вальд Wald |
Число степеней свободы Degree of freedom |
Значимость Significance |
Exp (B) |
|
Константа Constant |
51,93 |
13,52 |
14,75 |
1 |
0,001 |
0,001 |
|
САД min Lowest SBP |
–0,14 |
0,08 |
3,02 |
1 |
0,082 |
0,869 |
|
САД mean Mean SBP |
0,39 |
0,11 |
12,41 |
1 |
0,001 |
1,477 |
|
САД мах Highest SBP |
0,11 |
0,06 |
3,73 |
1 |
0,053 |
1,111 |
Согласно построенному прогностическому алгоритму для каждого пациента вычислялась величина К, определяемая формулой:
K =___________________________________________ , 1 + e51,93 + 0,14 x CAД min – САД mean – 0,11 x САД max где e – математическая константа, равная приблизительно 2,72; САД min – минимальное суточное САД (мм рт. ст.); САД mean – среднесуточное САД (мм рт. ст.); САД max – максимальное суточное САД (мм рт. ст.). Вычисленное значение К сравнивалось с пороговым значением 0,54, определенным в модели логистической регрессии. При значении К > 0,54 прогнозируется развитие АГ у больных подагрой. Чувствительность разработанной прогностической модели составляет 0,84, специфичность – 0,95; площадь под ROC-кривой – 0,95 (95% ДИ = 0,91–0,99), рисунок 1.
Учитывая сложность необходимых расчетов, для упрощения использования способа в повседневной клинической практике создано приложение для Android в среде разработки Delphi (Delphi 10.3.3 Rio, Embarcadero Technologies, License No. 2UHK-Z9NG5B-DYPETV-3J8D, США), которое позволяет подтвердить факт развития АГ у больных подагрой. Использование данного алгоритма позволит не только выявить наличие АГ, но и своевременно назначить антигипертензивную терапию.
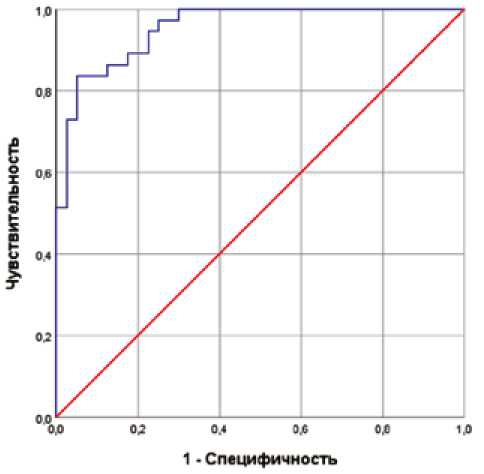
Рис. 1. Площадь под ROC-кривой для разработанной модели
Fig. 1. The area under the ROC curve for the developed model
Заключение
При изучении параметров СМАД установлено превышение значений среднесуточного минимального, среднего и максимального САД, среднего и максимального ДАД, минимального, среднего и максимального ПД у больных подагрой и АГ по сравнению с мужчинами, страдающими подагрой, с нормальными цифрами АД и здоровыми лицами. Однако при анализе ПД в группе больных подагрой с нормотонией выявлено значимое различие параметров минимального, среднего и максимального среднесуточ- ного ПД по сравнению с контрольной группой, что указывает на повышение риска развития АГ у данной категории больных. При оценке величин индексов нагрузки выявлено увеличение ИВ для САД и ДАД днем и ночью у пациентов, страдающих подагрой и АГ, по сравнению с больными подагрой с нормальными цифрами АД и здоровыми лицами. Модель, основанная на определении среднесуточных САД min, САД mean, САД max, позволяет с точностью в 90% проводить раннюю диагностику АГ у больных подагрой.
Список литературы Клиническое значение суточного мониторирования артериального давления в прогнозировании развития артериальной гипертензии у больных подагрой
- Richette P., Bardin T. Gout. Lancet. 2010;375(9711):318-328. DOI: 10.1016/S0140-6736 (09) 60883-7.
- Kuo C.F., Luo S.F. Gout: Risk of premature death in gout unchanged for years. Nat. Rev. Rheumatol. 2017;13(4):200-201. DOI: 10.1038/nr-rheum.2017.27.
- Richette P., Clerson P., Perissin L. Revisiting comorbidities in gout: A cluster analysis. Ann. Rheum. Dis. 2015;74(1):142-147. DOI: 10.1136/ annrheumdis-2013-203779.
- Цыганкова Д.П., Федорова Н.В., Кривошапова К.Е., Максимов С.А., Индукаева Е.В., Шаповалова Э.Б. и др. Социально-экономические факторы риска артериальной гипертензии у пожилых лиц. Сибирский журнал клинической и экспериментальной медицины. 2020;35(4):111-118. DOI: 10.29001/2073-8552-2020- 35-4111-118.
- Елисеев М.С., Новикова А.М. Коморбидность при подагре и гипер-урикемии: распространенность, причины, перспективы уратснижаю-щей терапии. Терапевтический архив. 2019;91(5):120-128. DOI: 10. 26442/00403660.2019.05.000232.
- Полянская А.В., Тузкова Т.С., Паторская О.А. Клиническая характеристика, особенности коморбидности и кардиальных нарушений у пациентов с подагрой и артериальной гипертензией. Военная медицина. 2018;2:57-60.
- Feig D.I., Kang D.H., Johnson R.J. Uric acid and cardiovascular risk. N. Engl. J. Med. 2008;359:1811-1821. DOI: 10.1056/NEJMra 0800885.
- Кушнаренко Н.Н., Мишко М.Ю., Медведева Т.А. Полиморфизм генов фолатного цикла у больных подагрой в популяции русских Забайкальского края. Сибирский журнал клинической и экспериментальной медицины. 2020;35(1):142-150. DOI: 10.29001/2073-8552-202035-1-142-150.
- Кошельская О.А., Журавлева О.А., Карпов РС. Маркеры хронической болезни почек у пациентов с артериальной гипертензией высокого риска: связь с нарушением суточного профиля артериального давления и уровнем внутрипочечного сосудистого сопротивления. Артериальная гипертензия. 2018;24(4):478-489. DOI: 10.18705/1607-419X-2018-24-4-478-489.
- Елисеев М.С. Классификационные критерии подагры (рекомендации ACR/ EULARJ. Научно-практическая ревматология. 2015;53(6):581-585.
- Wallace S.L., Robinson H., Masi A.T., Decker J.L., McCarty D.J., Yu T.F. Preliminary criteria for the classification of the acute arthritis of gout. Arthritis Rheum. 1977;20(3):895-900. DOI: 10.1002/art.1780200320.
- Lang T.A., Altman D.G. Statistical analyses and method sinthepublished literature: The SAMPL guidelines. Medical Writing. 2016;25(3):31-36. DOI: 10.18243/eon/2016.9.7.4.
- Мудров В.А. Алгоритмы корреляционного анализа данных в биомедицинских исследованиях с помощью пакета программ SPSS. Забайкальский медицинский вестник. 2020;2:169-176. URL: http:// zabmedvestnik.ru/arhiv-nomerov/nomer-2-za-2020-god/algoritmy-korreljacionnogo-analiza-dannyh-v-biomedicinskih-issledovanijah-s-pomoshhju-paketa-programm-spss (дата обращения: 9.07.2021).
- Islam M.S. Ambulatory blood pressure monitoring in the diagnosis and treatment of hypertension. Adv. Exp. Med. Biol. 2017;956:109-116. DOI: 10.1007/5584_2016_177.
- Рогоза А.Н. Современные неинвазивные методы измерения артериального давления для диагностики артериальной гипертонии и оценки эффективности антигипертензивной терапии: пособие для врачей. М.: Медика; 2007:72.


