Клинико-иммунологические аспекты синдрома диабетической стопы
Автор: Пиксин Иван Никифорович, Акашев Руслан Владимирович, Давыдкин Василий Иванович, Пигачев Андрей Вениаминович, Московченко Александр Сергеевич
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Медицина
Статья в выпуске: 2, 2015 года.
Бесплатный доступ
Проведено клинико-лабораторное исследование 29 пациентов с синдромом диабетической стопы в возрасте от 30 до 80 лет. Диагноз выставлялся в соответствии с разработанной классификацией диабетической стопы "LANOTPAD". Исследование зависимости изменений концентрации цитокинов от характера гнойно-воспалительного процесса показало, что уровень интерлейкинов-1 и -6 возрастает с тяжестью воспалительного процесса в группе больных с СДС, что связано с выраженностью воспалительного процесса. Уровень же интерлейкина-8 снижается при синдроме диабетической стопы, что связано с изменением адгезивных свойств нейтрофилов, миграцией клеток и их адгезией в месте проникновения микроорганизма. По уровню IgA и IgG прогнозировалось наличие вторичного иммунодефицита. В 1-й группе больных также отмечалось повышение концентрации фактора некроза опухоли, что связано с активностью воспалительного процесса. В группе с прогностически неблагоприятным течением процесса отмечались высокие цифры IgG, интерлейки-нов-4 и -6. Установлено, что чем глубже повреждение тканей, тем выше значение растворимого рецептора фактора некроза опухоли. При эффективном лечении уровень интерлейкина-6 достоверно снижается. Полученные данные свидетельствуют о возможности использования определения уровня цитокинов и их динамики для прогностической оценки эффективности лечебных мероприятий.
Сахарный диабет, диабетическая стопа, интерлейкин, иммуноглобулин, ангиопатия, нейропатия, нарушение трофики
Короткий адрес: https://sciup.org/14720158
IDR: 14720158 | УДК: 616.379-008.64 | DOI: 10.15507/VMU.025.201502.037
Текст научной статьи Клинико-иммунологические аспекты синдрома диабетической стопы
Синдром «диабетической стопы» (СДС) является наиболее частым осложнением у больных сахарным диабетом, с ним связано около трети всех госпитализаций пациентов с данной патологией. Развитие гнойно-некротических поражений стопы в большинстве случаев приводит к ампутации конечностей [2–3; 7; 9–11]. Частота высоких ампутаций составляет 6–8 на 1 тыс. пациентов с СДС, а показатель летальности – 40–68 % в течение 5 лет.
Особенностью СДС является гетерогенность, а течение характеризуется наличием различных вариантов клинических проявлений, при этом четкая оценка тяжести и прогноза продолжает оставаться сложной задачей. На сегодняшний день не существует ни одного лабораторного показателя, который мог бы однозначно свидетельствовать о тяжести СДС или служить предиктором развития тяжелых осложнений. Кроме того, ряд определяемых при СДС лабораторных маркеров может отражать не только выраженность воспалительного процесса, но и наличие сопутствующих заболеваний. Именно поэтому постоянно продолжается поиск маркеров, непосредственно свидетельствующих об активном иммунопатологическом процессе.
В патогенезе СДС важную роль играют выраженные ишемические повреждения тканей, микробная инвазия и нарушения иммунного статуса [16]. Гнойно-некротический процесс при СДС имеет свои особенности и сопровождается иммунологическими нарушениями регуляции репаративного процесса. В последнее время указывается на ведущую роль в регуляции воспалительного процесса цитокинов [4]. Дисбаланс в выработке последних приводит к искажению течения воспалительного процесса, что, несомненно, отрицательно сказывается на результатах лечения данной категории больных. Атеросклероз сосудов у больных СДС возникает на 8–10 лет раньше, чем в общей популяции, в связи с чем вос- палительная реакция происходит на фоне измененного метаболизма и нарушенного кровообращения [5–6; 14].
Иммунные клетки секретируют многочисленные растворимые медиаторы (цитокины), часть которых является высокоспецифическими. Усиленный синтез цитокинов начинается в ответ на проникновение микроорганизмов [9]. Учитывая отсутствие научно-исследовательских работ о состоянии уровня иммуноглобулинов (Ig), интерлейкинов (ИЛ) и растворимых рецепторов фактора некроза опухоли (ФНО) (P60, P80) у пациентов с различными вариантами СДС, представляется интересным исследование динамики уровня данных показателей и поиск взаимосвязи с ее отдельными клиническими проявлениями. Установление закономерностей формирования дисбаланса цитокинов позволит провести оценку тяжести течения СДС, определить значимые показатели, в наибольшей степени отражающие тяжесть клинических проявлений, эффективность проводимого лечения и прогнозирование исхода заболевания. Нами высказано предположение, что изучение совокупности иммунологических показателей позволит сформировать представление об их значимости при различных клинических проявлениях СДС.
Цель исследования – изучение и определение степени взаимосвязи между содержанием ИЛ и Ig в сыворотке крови больных с различными клиническими вариантами поражений диабетической стопы, а также установление их диагностической значимости.
Материал и методы исследования. Проведено клинико-лабораторное обследование пациентов сахарным диабетом II типа с гнойно-некротическими проявлениями СДС, проходивших лечение на клинической базе кафедры госпитальной хирургии Мордовского государственного университета. Исследуемую группу составили 29 пациентов, которым было проведено иммунологическое исследование 12 показателей для анализа механизмов развития диабетической стопы. Контрольную группу для сравнения составили 10 здоровых лиц по полу и возрасту, сопоставимых с исследуемыми группами.
Клиническое исследование больных включало определение варианта диабетической стопы с использованием классификации “LANOTPAD” [1] и программы для автоматизированной постановки диагноза [8]. Классификация диабетической стопы “LANOTPAD” включало распределение пациентов по локализации и глубине поражения; выраженности ангиопатии, нейропатии, остеоартропатии, трофических, гнойных проявлений и диаметру поражения.
L ocalization. Поражение 1-го пальца стопы обозначается как а1; 2-го – а2; 3-го – а3; 4-го – а4; 5-го – а5; поражение всех пальцев – a6. Поражение костей плюсны отмечается буквенным значением b, в том числе поражение на уровне плюсны – b1, поражение на уровне переднего отдела пред предплюсны – b2; поражение на уровне заднего отдела – b3. Наличие перехода гнойного процесса со стопы на голень обозначается с1 и гнойного процесса с голени на бедро – с2.
A ngiopathy (ангиопатические нарушения): а – нарушений нет; b – признаки хронической артериальной недостаточности нижних конечностей; с – критическая ишемия стопы.
N europathy (нейропатические нарушения): а – все виды чувствительности на стопах сохранены полностью; b – нарушение отдельных видов чувствительности (болевой, тактильной, температурной, вибрационной); с – нарушение всех видов чувствительности в области стопы.
O steoartropathy (остеоартропатия): а – нет признаков остеоартропатии; b – признаки начальной недифференцированной остеоартропатии; с – признаки прогрессирующей остеоартропатии; d – выраженная и необратимая деформация стопы (стопа Шарко).
Тtrophic (трофические нарушения): a – нет трофических нарушений; b – гиперкератоз, изменение ногтевых пластинок и т. д.; c – нейроангиотрофиче-ская язва без признаков воспаления.
P urulent process (гнойно-деструктивные поражения стопы): c1 – инфицированная трофическая язва; c2 – локальный некроз мягких тканей; c3 – остеомиелит (свищевой дефект в мягких тканях); c4 – абсцесс; c5 – флегмона; c6 – гангрена.
А mount (глубина повреждения): а – нет изменений; b – поверхностные изменения кожи, дефект подкожной клетчатки; с – вовлечение мышц, фасций, сухожильно-связочного аппарата, d – глубокий дефект с вовлечением костей и суставов.
Исследование уровня ИЛ, Ig и растворимых рецепторов ФНО в образцах плазмы крови пациентов проводилось в лаборатории кафедры госпитальной хирургии МГУ. Забор крови осуществлялся из локтевой вены в 1-е сутки (до хирургического вмешательства), а также на 3-и, 7-е и 14-е сутки. Концентрацию цитокинов ИЛ-1, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-8, ФНО, pФНОа-RI (60), pФНОа-RII (80) и иммуноглобулинов IgА, IgЕ IgG, IgМ в сыворотке крови определяли с использованием тест-систем «Вектор-бест» на иммуноферментном комплексе “Stat Fax”. Количественное определение ИЛ в сыворотке проводилось методом твердофазного иммунофермент-ного анализа, основанного на принципе «сэндвича» в соответствии с инструкцией фирмы производителя. Определение уровня растворимых рецепторов sTNF-R (60kDa) ELISA, sTNF-R (80 kDa) ELISA осуществлялось по инструкции eBioscience Platinum Ready-to-use Sandwich ELISA Bender MedSystems c использованием иммуноферментного набора для высокочувствительного количественного определения растворимого человеческого рецептора фактора некроза опухоли. Для контроля использовали референтные показатели нормы цитокинов производителя ООО «Вектор-Бест», а также полученные в результате обследования доноров.
Все пациенты с СДС получали базовое консервативное лечение. Проводилась коррекция углеводного обмена (ма-нинил, биосулин Н, и P, инсуман базал, хумулин НПХ, и R); антибактериальная (цефазолин, цефотаксим, цефтриаксон, цефтазидим, метрогил, ципрофлоксацин, канамицин) и дезинтоксикацион-ная терапия (глюкоза, раствор Рингера); назначались препараты, улучшающие реологические свойства крови (пентоксифиллин, гепарин); спазмолитики (ношпа, папаверин, платифиллин); витаминотерапия (липоевая кислота, мильгам-ма, никотиновая кислота, берлитион); нестероидные противовоспалительные препараты (диклофенак, нимесулид, ке-тарол).
Статистическая обработка данных проводилась с использованием программы PASW Statistics 18. Для обработки данных были выбраны непараметрические методы исследования. Для сравнения количественных данных в двух несвязанных между собой выборках применялся непараметрический U-критерий Манна-Уитни, для сравнения количественных параметров в двух связанных между собой совокупностях – непараметрический критерий Уилкок-сона. Уровень значимости (p) принимали равным 0,05 во всех вышеописанных сравнениях.
Результаты исследования. Согласно указанной классификации, произведено распределение по критериям и частоте встречаемости признаков. По локализации процесса ( localization ) (а1) отмечен у 10 (34,5 %) больных; а2 – у 3 (10,3 %); а4 – у 2 (6,9 %); а5 – у 2 (6,9 %). Поражение на уровне плюсны (b1) отмечено у 7 (24,1 %) больных; поражение на уровне переднего отдела предплюсны (b2) – у 1 (3,4 %); b3 – у 4 (13,8 %). Перехода гнойного процесса со стопы на голень (с1) и гнойного процесса с голени на бедро (с2) не отмечено ни у одного больного.
Ангиопатические нарушения (angiopathy) типа а отмечались у 1 (3,4 %) больного; в форме хронической арте- риальной недостаточности (b) – у 26 (89,7 %); критическая ишемия (с) – у 2 (6,9 %). Нейропатические нарушения (neuropathy) типа а выявлены у 4 (13,8 %) больных; b – у 24 (82,8 %); с – у 1 (3,4 %). Остеоартропатия (оsteoartropathy) типа b выявлена у 10 (34,5 %) больных; с – у 18 (62,1 %); d – у 1 (3,4 %). У всех больных отмечены гиперкератоз, изменения ногтевых пластинок (b).
Среди гнойно-деструктивных поражений стопы (purulent process) инфицированная трофическая язва (c1) имелась у 19 (65,5 %) больных; локальный некроз мягких тканей (c2) – у 3 (10,3 %); флегмона (c5) – у 4 (13,8 %); гангрена (c6) – у 3 (10,3 %).
Рассматривая глубину (amount) повреждений, можно отметить, что у 14 (48,3 %) больных были поверхностные изменения кожи и дефекты подкожной клетчатки (b); вовлечение мышц, фасций, сухожильно-связочного аппарата (с) – у 12 (41,4 %), глубокие дефекты с вовлечением костей и суставов (d) – у 3 (10,3 %).
По диаметру (diameter) поражения дефект до 1 см отмечался у 13 (44,8 %) больных, до 2 см – у 4 (13,8 %), до 3 см – у 6 (20,7 %), 4 см – у 3 (10,3 %), 5 см – у 2 (6,9 %), 8 см – у 1 (3,4 %) больного.
В связи с неэффективностью консервативных мероприятий и прогрессированием деструктивного процесса или присоединением гангрены хирургические вмешательства были выполнены у 14 (48,3 %) больных: в том числе ампутация на уровне бедра – у 2 (6,9 %); вскрытие и дренирование флегмоны подошвенной поверхности стопы – у 5 (17,2 %); экзартикуляция пальцев – у 7 (24,1 %).
При сравнительном анализе лабораторных параметров у двух групп (СДС=29 и здоровые n=10) достоверно значимые различия получены по ИЛ-1, ИЛ-6, ИЛ-8, ФНО, IgA, IgG (р<0,05).
В 1-й группе ИЛ-1, ИЛ-6, ФНО, IgA, IgG были достоверно повышены по сравнению со здоровыми лицами (контрольная группа) (р<0,05). Также отмечено повышение ИЛ-4 (р<0,08).
Уровень ИЛ-1 в группе больных с СДС достоверно был выше, что связано с выраженностью воспалительного процесса, усилением процесса реэпите-лизации ран, стимуляцией организации и дифференцировки эпидермальной ткани за счет усиления продукции фактора роста кератиноцитов фибробластами [17]. ИЛ-4 играет ведущую роль в модуляции иммунного ответа и процессов воспаления.
Уровень ИЛ-6 у пациентов с диабетической стопой был достоверно выше уровня здоровых лиц, что отмечают и другие авторы [19]. Высокий уровень цитокина указывал на повышенную активность белков острой фазы, а также опосредованную невыраженную системную реакцию эндотелиальной системы и местную в гнойно-некротиче- ском очаге. Кроме того, высокие уровни ИЛ-6 могут подавлять секрецию ФНО и ИЛ-1 [15] и повышать уровень глюкозы [12–13;18].
Уровень ИЛ-8, наоборот, был выше у здоровых лиц, что объясняется усилением адгезивных свойств нейтрофилов, миграцией клеток и их адгезией в месте проникновения микроорганизма.
Содержание IgA и IgG у пациентов с СДС оказалось выше, чем в группе здоровых лиц, что связано с состоянием вторичного иммунодифицита у больных. В 1-й группе больных также отмечалось повышение концентрации ФНО, что связано с активностью воспалительного процесса. Динамика цитокинов, Ig у больных с СДС при поступлении, во время лечения и по окончании лечения представлена в табл. 1.
Т а б л и ц а 1
Уровни лабораторных показателей в динамике на фоне проводимого лечения
|
Показатель |
При поступлении |
Середина лечения |
Окончание лечения |
Всего |
|
ИЛ-1, пг/мл |
4,054 |
3,421 |
4,189 |
29 |
|
ИЛ-2, пг/мл |
1,445 |
0,284 |
0,689 |
29 |
|
ИЛ-4, пг/мл |
3,224 |
4,760 |
3,279 |
29 |
|
ИЛ-6, пг/мл |
30,462 |
18,053 |
11,078 |
29 |
|
ИЛ-8, пг/мл |
42,824 |
44,821 |
51,450 |
29 |
|
ФНО, пг/мл |
319,161 |
335,653 |
312,456 |
29 |
|
P-60, пг/мл |
0,438 |
0,430 |
0,427 |
29 |
|
P-80, пг/мл |
0,966 |
0,970 |
0,979 |
29 |
|
IgА, МЕ/мл |
2,752 |
2,116 |
2,060 |
29 |
|
IgG, МЕ/мл |
28,662 |
28,147 |
28,438 |
29 |
|
IgE, МЕ/мл |
165,487 |
127,669 |
156,632 |
29 |
|
IgM, МЕ/мл |
2,453 |
2,524 |
3,010 |
29 |
Прогностическая значимость и корре- ней цитокинов при различных клиниче-ляционная зависимость изменений уров- ских вариантах СДС показаны в табл. 2 .
Т а б л и ц а 2
Взаимосвязь уровня лабораторного и клинического параметров
|
Критерий классификации |
Высокий уровень показателя в зависимости от выраженности клинических проявлений |
Низкий уровень |
|||||
|
L (локализация) |
ИЛ1 * |
ИЛ6 * |
|||||
|
A (ангиопатия) |
ИЛ4 ** |
ФНО * |
|||||
|
N (нейропатия) |
IgA * |
IgG * |
ИЛ4 ** |
||||
|
O (остеоартропатия) |
IgG * |
ИЛ 6 * |
ИЛ1 * |
||||
|
T (трофические нарушения) |
– |
– |
– |
– |
– |
– |
– |
|
P (гнойно-некротический процесс) |
IgG * |
ИЛ4 ** |
|||||
|
A (глубина поражения) |
IgG * |
ИЛ6 * |
ФНО * |
||||
|
D (диаметр поражения) |
IgG * |
ИЛ 6 * |
|||||
*Достоверные различия (р<0,05).
**Тенденция к различию (р<0,08).
У больных с диабетической стопой до проведения хирургического лечения отмечались высокие цифры IgG, ИЛ-4 и ИЛ-6.
Концентрация растворимых рецепторов ФНО (P60, P80 кДа) достоверно не отличалась от группы здоровых лиц (р>0,05). До настоящего времени не совсем понятна их роль в иммунопатологическом процессе, что требует дальнейшего изучения их связи с другими показателями. Нами было отмечено, что чем глубже повреждение тканей, тем выше уровни растворимого рецептора ФНО.
При оценке уровня ИЛ-6 в динамике отмечалось его достоверное снижение в ответ на проводимое лечение (рисунок). Это связано с купированием явлений воспаления и эффективностью проводимых лечебных мероприятий.
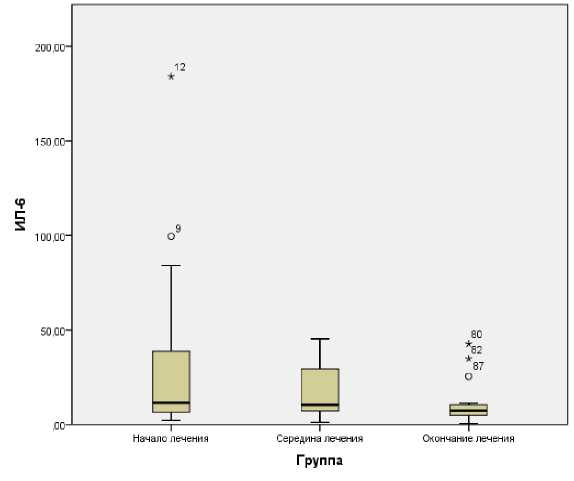
Р и с у н о к. Снижение уровня ИЛ-6 на фоне проводимого лечения (р<0,05)
Обсуждение. Проведенные исследования показали, что имеется взаимосвязь некоторых иммунологических показателей со степенью выраженности клинических проявлений у больных с СДС, а также исходом лечения.
Анализ уровней ИЛ-1, ИЛ-4, ИЛ-6, ИЛ-8, ФНО-a, IgA, IgG показал достоверные различия по сравнению со здоровыми лицами (р<0,05) , а ИЛ-4 стремился к достоверности (р<0,08). Остальные параметры достоверно не отличались от группы здоровых лиц (р>0,05).
Детальный анализ однородной группы с СДС при учете лабораторных показателей в соответствии с клиническими критериями классификации показал некоторую зависимость показателей от степени тяжести процесса. Это позволяет в большей степени понять связь отдельного лабораторного параметра с клиническими проявлениями синдрома и выявить наиболее значимый маркер тяжести заболевания. Так, повышение концентрации некоторых иммунологических показателей ассоциируется с прогрессированием клинических про- явлений. При этом имелась связь с локализацией процесса ИЛ-1 и ИЛ-6; ангиопатией – ИЛ-4; нейропатией – IgA и IgG; остеоартропатией –IgG и ИЛ-6; гнойнонекротическим процессом – IgG, ИЛ-4; глубиной процесса – IgA, ИЛ-6, ФНО; диаметром поражения – IgG, ИЛ-6. Отмечалось повышение показателей IgG, ИЛ-4, ИЛа-6 и IgA, предшествующих оперативному лечению.
Из вышеописанного следует, что наибольшей информативностью в качестве прогностического маркера тяжести заболевания следует считать ИЛ-6. Только данный показатель из всех изученных параметров не только имел достоверные различия, но и охватывал большую часть критериев классификации, имел связь с тяжестью клинических проявлений, локализацией процесса, выраженностью остеоартропатии, ангиопатии, глубиной и диаметром поражения.
Выраженность ангиопатических нарушений и гнойно-некротический вариант также отражает ИЛ-4, но его показатели лишь стремятся к достоверности (p<0,08).
Впервые изученная концентрация растворимых рецепторов ФНО (P60, P80 кДа) достоверно не отличалась от группы здоровых лиц. Их роль в иммунопатологическом процессе в настоящее время не ясна. Однако установлено, что с повышением концентрации растворимых рецепторов ФНО ИЛ-4 и Л-6 повышаются.
Таким образом, анализ результатов клинико-лабораторного исследования показал, что самую тесную связь с тя- жестью клинических проявлений в соответствии с критериями классификации “LANOTPAD” имеет ИЛ-6. Следует отметить, что повышение его уровня указывало на неэффективность терапии и прогрессирование процесса, необходимость использования хирургического лечения. Достоверное снижение этого показателя на фоне проводимого лечения позволяет сделать вывод о его значимости в прогнозе исхода, а также возможности оценки эффективности проводимого лечения.
Список литературы Клинико-иммунологические аспекты синдрома диабетической стопы
- Акашев, Р. В. Классификация диабетической стопы "Lanotpad"/Р. В. Акашев, И. Н. Пиксин, A. В. Пигачев//Медицинский альманах. -2013. -№ 5 (28). -С. 165-168.
- Беляев, А. Н. Внутриартериальная тромболитическая терапия ишемических осложнений диабетической ангиопатии конечностей/А. Н. Беляев, А. Г. Павелкин, А. Н. Родин//Ангиология и сосудистая хирургия. -2012. -Т. 18, № 3. -С. 13-17.
- Газин, И. К. Критерии интоксикации в оценке тяжести эндотоксикоза, эффективности озонотерапии и традиционного лечения у больных сахарным диабетом, осложненным гнойно-некротическими поражениями нижних конечностей/И. К. Газин//Клиническая лабораторная диагностика. -2008. -№ 6. -С. 21-22.
- Дисбаланс цитокинов как фактор патогенеза гнойно-септических заболеваний и иммунокорригирующие эффекты лейкинферона/В. П. Кузнецов //Медицинская иммунология. -2002. -Т. 4, № 1. -С. 11-20.
- Инструментальные методы исследования при макроангиопатии нижних конечностей, возникшей на фоне сахарного диабета/Р. В. Акашев //Вестник Мордовского университета. -2013. -№ 1-2. -С. 110-112.
- Комплексная оценка уровня спонтанной продукции цитокинов в культуре мононуклеарных клеток периферической крови здорового человека/В. И. Коненков //Цитокины и воспаление. -2005. -№ 2. -С. 33-37.
- Лукач, В. Н. Показатели иммунитета у больных сахарным диабетом с септическим шоком/B. Н. Лукач, В. А. Мальков, А. О. Гирш//Анестезиология и реанимация. -2008. -№ 3. -С. 35-38.
- Медицинская информационно-аналитическая система обработки данных у пациентов с синдромом диабетической стопы/И. Н. Пиксин //Свидетельство о государственной регистрации программы для ЭВМ. -№ 2012660943. -30 ноября 2012 г.
- Номоконова, И. Н. Влияние различных факторов на течение синдрома диабетической стопы/И. Н. Номоконова, Д. Г. Болотова//Вестник РГМУ -2007. -№ 2. -С. 120-121.
- Павелкин, А. Г. Совершенствование патогенетической терапии при осложненных формах диабетической ангиопатии нижних конечностей/А. Г. Павелкин, А. Н. Беляев//Вестник новых медицинских технологий. -2013. -Т. 20, № 3. -С. 26-32.
- Павелкин, А. Г. Оценка эффективности тромболитической терапии при осложненных формах диабетической стопы/А. Г. Павелкин, А. Н. Беляев//Медицинский альманах. -2012. -№ 4. -С. 88-92.
- Тотолян, А. А. Клетки иммунной системы/А. А. Тотолян, И. С. Фрейдлин. -Санкт-Петербург: Наука, 2000. -С. 173-178.
- Царегородцева, Т. М. Цитокины в гастроэнтерологии/Т. М. Царегородцева, Т. И. Серова. -Москва: Анахарсис, 2003. -С. 24-26.
- Ярилин, А. А. Система цитокинов и принципы ее функционирования в норме и при патологии/А. А. Ярилин//Иммунология. -1997. -№ 5. -С. 7-14.
- Correlations and interactions in the production of interleukin-6 (IL-6), IL-1, and tumor necrosis factor (TNF) in human Blood mononuclear cells: IL-6 suppresses IL-1 and TNF/R. Schindler //Blood. -1990. -No. 75. -P. 40-47.
- Levin, M E. The Diabetic Foot. Books oth Edition/M. E. Levin, L.W. O'Neal. -London, 2001. -828 p.
- Maas-Szabowski, N. Keratinocyte growth regulation in defined organitypic cultures through IL-1-induced keratinocyte growth factor expression in resting fibroblasts/N. Maas-Szabowski, H. J. Stark, N. E. Fusenig//J. Invest. Dermatol. -2000. -vol. 114, no. 6. -P. 1075-1084.
- Tadamitsu Kishimoto. The Cytokine Handbook/Ed A. A. Thomson. -London: Academic Press, 2003. -P. 281-304.
- Vascular endothelium and inflammatory process, in patients with combined Type 2 diabetes mellitus and coronary atherosclerosis: the effects of vitamin C/С. Antoniades //Diabet Med. -2004. -Jun. 21.-No. 6. -P. 552-558.


