Клинико-иммунологические особенности рассеянного склероза на фоне реактивации персистирующей герпесвирусной инфекции
Автор: Гончарова З.А., Беловолова Р.А., Мегерян В.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Неврология
Статья в выпуске: 1 т.14, 2018 года.
Бесплатный доступ
Цель: оценить клиническую картину рассеянного склероза (PC) и показатели иммунного статуса у больных с реактивацией персистирующей герпесвирусной инфекции (ПГВИ). Материал и методы. Обследовано 56 больных с достоверным PC и 20 пациентов, проходивших курс лечения других заболеваний нервной системы (корешковый синдром на фоне дегенеративного заболевания позвоночника) (группа сравнения). Пациенты с PC были разделены на 2 группы: больные без реактивации ПГВИ (типичный PC) и больные с реактивацией ПГВИ (вирусассоциированный PC). Реактивация ПГВИ регистрировалась при наличии соответствующих клинических проявлений и серологических маркеров по результатам иммуноферментного анализа (ИФА). Клиническую картину PC оценивали по шкалам FS и EDSS. Проводили исследование клеточного и гуморального звеньев адаптивного иммунитета. Результаты. У пациентов с реактивацией ПГВИ по сравнению с больными с типичным PC выявлены: более выраженный неврологический дефицит, более частые обострения, более высокая скорость прогрессирования PC. Изменения в иммунном статусе у больных с вирусассоциированным PC можно расценить как сочетание вторичного иммунодефицита (Т- клеточного) и активного аутоиммунного процесса (активация В-клеточного звена). Заключение. У больных PC с реактивацией ПГВИ наблюдались более выраженная неврологическая симптоматика, тяжелое течение PC и признаки вторичного иммунодефицита.
Аутоиммунные заболевания, вирус герпеса, вторичный иммунодефицит, рассеянный склероз
Короткий адрес: https://sciup.org/149135045
IDR: 149135045
Текст научной статьи Клинико-иммунологические особенности рассеянного склероза на фоне реактивации персистирующей герпесвирусной инфекции
-
1 В ведение. Рассеянный склероз (РС) — наиболее распространенное демиелинизирующее заболевание центральной нервной системы (ЦНС), занимающее второе место в структуре заболеваний нервной системы и являющееся ведущей причиной инвалидности, не связанной с травмой, у лиц молодого возраста [1]. РС — аутоиммунное заболевание, поэтому среди причин клинической гетерогенности болезни важны как генетические, так и средовые факторы. Наибольший практический интерес представляют средовые факторы, так как в большинстве своем они модифицируемые.
Среди факторов, провоцирующих развитие РС, как и других аутоиммунных заболеваний (АИЗ), большое значение имеет вирусная инфекция. По данным метаанализа, проведенного L. I. Levin, K. L. Munger и др. (2010) [2], вирусная инфекция является ведущим средовым фактором, способствующим развитию РС. Проблема персистирующей вирусной инфекции у больных РС актуальна не только в связи с ее ролью в патогенезе заболевания, но и в связи с использованием иммуносупрессантов и иммуномодуляторов в терапии РС, которые в силу своего механизма действия могут приводить к развитию вторичной иммунной недостаточности, сопровождающейся активацией инфекционных агентов. Особого внимания заслуживают вирусы группы герпеса ввиду их убикви-тарности и потенциальной нейротропности. Данные о значимости герпетической инфекции в развитии РС противоречивы: от категорического отрицания в качестве этиологического фактора РС [3] до присвоения им роли специфического возбудителя [2]. Помимо потенциального риска развития инфекционных осложнений у иммуннокомпрометированных лиц, сами вирусы герпеса разных групп способны вызывать иммунодефицитные состояния (вторичный иммунодефицит), что может быть выявлено даже стандартными методами оценки клеточного и гуморального
иммунитета. Влияние реактивации персистирующей герпесвирусной инфекции на течение аутоиммунного процесса, в частности РС [4], недостаточно изучено. Наличие персистирующей герпесвирусной инфекции (ПГВИ) может играть роль триггера, приводящего к более тяжелому течению РС, сопровождающемуся изменениями в основных показателях клеточного и гуморального иммунитета.
Цель: оценить клиническую картину рассеянного склероза и показатели иммунного статуса у больных с реактивацией персистирующей герпесвирусной инфекции (ПГВИ).
Материал и методы. На базе неврологического отделения клиники РостГМУ и городского Центра рассеянного склероза Ростова-на-Дону обследовано 56 больных с достоверным диагнозом РС (по критериям Макдональда 2005 г. и Позера 1983 г.), проходивших стационарное и амбулаторное лечение в период с 2009 по 2015 г. (основная группа, ОГ). Группу сравнения (ГС) составили 20 условно здоровых пациентов, подобранных путем случайной выборки, проходивших курс стационарного лечения в неврологическом отделении клиники РостГМУ по поводу других заболеваний нервной системы (корешковый синдром на фоне дегенеративного заболевания позвоночника). Пациенты обследовались не ранее чем через месяц после проведения пульс-терапии глюкокортикостероидами и плазмафереза (в случае его проведения). В группах больных с обострением РС оценивали особенности клиники и течения, иммунологических показателей заболевания и состояние гуморального противогерпетического иммунитета.
По результатам обследования выделены две группы. Первую группу составили 30 пациентов: критериями включения служили наличие достоверного РС и подтвержденное серологическими методами исследования отсутствие реактивации ПГВИ (типичный РС). Вторая группа состояла из 26 пациентов: критерием включения было наличие достоверного РС и реактивации ПГВИ. Реактивация ПГВИ регистрировалась при наличии одновременно клинических проявлений (везикулярные высыпания для ВПГ
1–2-го типов) и серологических методов диагностики либо при наличии только клинических признаков вируса простого герпеса (ВПГ) (также приводятся нормативные показатели для здоровых лиц). Критерии исключения: инфекционно-воспалительные заболевания (острые и хронические в стадии обострения), соматические и психические заболевания в стадии декомпенсации.
Клинические методы исследования: сбор анамнеза, неврологическое обследование, оценка ка-тамнеза, включая ретроспективное исследование амбулаторных карт и выписок из историй болезни стационарного больного (архивный метод). При оценке типа течения заболевания использовалось деление на рецидивирующий РС (РРС), вторичнопрогрессирующий РС (ВПРС) и первично-прогрессирующий РС (ППРС). При РРС осуществлялось деление на активный и неактивный типы заболевания, использовалась классификация F. D. Lublin (2014) [5]. Активный РС устанавливался на основании следующих критериев: клинические проявления обострения РС и/или появление на МРТ новых очагов, накапливающих гадолиний, либо появление новых или увеличение старых очагов в режиме Т2; также среди больных с активным РС дополнительно учитывались пациенты с высокоактивным РС (2 и более обострений в год, установленных на основании изложенных критериев). Выраженность неврологического дефицита оценивалась с помощью шкал Kurtzke в модификации Weiner и Elisson (1983): шкалы FS, позволяющей произвести количественную оценку (в баллах) степени нарушения функций основных семи функциональных систем; шкалы EDSS, оценивающей степень утраты трудоспособности и возможности к самообслуживанию. Кроме того, учитывались следующие показатели течения РС: ежегодная частота обострений заболевания при рецидивирующем течении и скорость прогрессирования (СП) заболевания, которая рассчитывалась как отношение показателя EDSS к длительности болезни в годах. При объективном осмотре обращали внимание на наличие везикулярных высыпаний на коже и слизистых и других клинических признаков реактивации ПГВИ согласно общепринятым диагностическим критериям [6].
Лабораторные методы исследования. Иммунологические исследования проводились на базе клинико-диагностической лаборатории РостГМУ (НИИ клинической иммунологии ФГБОУ ВО «Ростовский государственный медицинский университет», Ростов-на-Дону, руководитель — д-р мед. наук, профессор Л. П. Сизякина). Оценка иммунного статуса проводилась согласно методическим рекомендациям А. Н. Чередеева и Л. В. Ковальчука (1984).
Иммунный статус оценивался на основании следующих показателей: состояние клеточного иммунитета путем изучения субпопуляционного состава лимфоцитов. Содержание Т- и В-лимфоцитов (клетки CD3+, CD3+CD4+, CD3+CD8+, CD3-CD16+, CD3-CD19+) устанавливалось с помощью реакции непрямой иммунофлюоресценции, c использованием моноклональных антител с маркерами CD3+, CD3+CD4+, CD3+CD8+, CD3-CD16+, CD3-CD19+, предоставленных фирмой МП «Сорбент» Института иммунологии Минздрава России. Анализ образцов осуществляли на проточном лазерном цитофлуометре марки EPICS-XL фирмы «Coulter» методом муль-типараметрической двухцветовой цитофлоуметрии; рассчитывалось CD4+/CD8+-отношение — иммуноре-гуляторный индекс (ИРИ). Состояние гуморального иммунитета: уровень содержания иммуноглобулинов основных классов (IgA, IgM, IgG) в сыворотке крови определяли в реакции радиальной иммунодиффузии в геле (Mancini et al., 1965) с помощью моно-специфических сывороток, изготовленных в НИИВС им. И. И. Мечникова. Циркулирующие иммунные комплексы (ЦИК) в сыворотке крови регистрировали по реакции преципитации в 4,16%-ном р-ре полиэтиленгликоля согласно методике Haskovak et al. (1978) в модификации Ю. А. Гриневича и И. А. Алферовой (1981). Система фагоцитоза оценивалась по метаболической активности нейтрофилов при помощи НСТ (теста восстановления нитросинего тетразолия), по тесту спонтанному и стимулированному по Б. В. Пи-негину (1989) рассчитывался коэффициент стимуляции.
Для оценки состояния противогерпетического иммунитета в сыворотке крови исследовали следующие антитела (Ат) классов IgM и G к вирусу простого герпеса (ВПГ) 1-го и 2-го типов, Ат IgM и G к Varicella Zoster, Ат к антигенам вируса Эпштейна — Барр (ВЭБ): Ат IgM и G к капсидному антигену (VCA-18), Ат IgG к раннему антигену (ЕА-138), Ат IgG к ядерному антигену (EBNA-1р72), Ат Ig класса M и G к цитомегаловирусу (ЦМВ), Ат IgG к вирусу герпеса 6-го типа (ГВ-6), для Ат IgG к ВПГ 1-го и 2-го типов, VZV, VCA, ЦМВ, ГВ-6, определяется индекс авидно-сти. При обнаружении Ат IgM и низкоавидных Ат IgG диагностировалась реактивация соответствующей персистирующей герпесвирусной инфекции. Использованы тест-системы: «ДС-ИФА-АНТИ-ВЭБ-VCA-М», «ДС-ИФА-АНТИ-ВЭБ-VCA-G», «ДС-ИФА-АНТИ-ВЭБ-VCA-G-АВИДНОСТЬ», «ДС-ИФА-АНТИ-ВЭБ-ЕА-М», «ДС-ИФА-АНТИ-ВЭБ-EBNA-G», «ДС-ИФА-АНТИ-ВПГ 1,2-М», «ДС-ИФА-АНТИ-ВПГ 1,2-G», «ДС-ИФА-АНТИ-ВПГ1,2-G-АВИДНОСТЬ», «ДС-ИФА-АНТИ-ЦМВ-М», «ДС-ИФА-АНТИ-ЦМВ-G», «ДС-ИФА-АНТИ-ЦМВ-G-АВИДНОСТЬ» (НПО «Диагностические системы», Россия). Интерпретацию результатов проводили в соответствии с рекомендациями производителей тест-систем. Серопозитивными считались лица, в сыворотке крови которых определялись специфические IgM- и IgG-антитела, оптическая плотность которых превышала критическую оптическую плотность. Для определения степени авидности IgG-антител также использовался метод ИФА с использованием коммерческих наборов производства ЗАО «Вектор-Бест» (Новосибирск). Результат выражали расчетным значением индекса авидности антител (ИА) согласно инструкции фирмы-изготовителя тест-системы. При обнаружении IgM и низкоавидных IgG диагностировалась реактивация персистирующей вирусной инфекции.
Статистическая обработка полученных данных проводилась с использованием пакета программ Statistica 10.0 for Windows XP, SPSS for Windows. Статистически значимыми считали различия при р<0,05. В работе применялись методы описательной и аналитической статистики. Использовали определение числовых характеристик переменных: средней арифметической (М), средней ошибки выборки (mх), определяли также достоверность различия (р) c применением методов параметрической статистики при нормальности распределения, в противном случае использовались методы непараметрической статистики. Для отдельных показателей данные представлены в виде значений медианы (Me) и квартилей (25%; 75%). При парных сравнениях использовался непараметрический метод — двухвыборочные ранго- вые критерии для сравнения независимых выборок (U-тест Манна — Уитни). Сравнение относительных частот проводилось с помощью критерия χ2 с поправкой Йетса.
Результаты. При анализе клинической картины у пациентов с типичной формой РС нарушения различных функциональных систем встречались с разной частотой. Пирамидная симптоматика наблюдалась у 28 человек из 30 (93%), мозжечковая симптоматика — у 23 из 30 (77%), стволовые нарушения и нарушения функции черепных нервов — у 16 из 30 пациентов (53%). Чувствительные нарушения отмечались у 14 из 30 (47%), нарушения функции тазовых органов у 11 из 30 (37%). Зрительные нарушения фиксировались у 6 из 30 (20%) и нарушения ВНД у 6 из 30 (20%) пациентов.
У пациентов с вирусассоциированной формой РС также наблюдались различные клинические проявления. Пирамидная симптоматика обнаружилась у 24 из 26 (92%), мозжечковая симптоматика у 23 из 26 (89%), стволовые нарушения и нарушения функции черепных нервов у 15 из 26 пациентов (58%). Чувствительные нарушения имелись у 14 из 26 (52%) пациентов, нарушения функции тазовых органов у 13 из 26 (50%). Зрительные нарушения отмечались у 7 из 26 (27%) и нарушения ВНД у 5 из 26 (19%) больных.
У пациентов с вирусассоциированным РС прослеживалась тенденция к более выраженному неврологическому дефициту по всем функциональным системам, за исключением зрительных и психических нарушений. Между пациентами с типичным и вирусассоциированным РС выявлены статистически значимые различия по показателям пирамидных нарушений и показателям EDSS (p<0,05) (табл. 1). У пациентов с вирусассоциированной формой РС установлено большее количество обострений в год (0,73±0,03 в группе больных с типичным РС и 1,2±0,11 в группе с вирусассоциированной формой РС, p<0,05), а также зафиксирована более высокая скорость прогрессирования заболевания (у больных с типичной формой РС скорость прогрессирования РС составила 0,44±0,02 балла в год, а у больных с вирусассоциированной формой РС 0,66±0,13 балла в год, р≤0,05).
Общие закономерности реакции иммунной системы при типичном РС следующие: активация клеточного звена (T- и В-лимфоциты), дисиммуноглобули-немия, снижение фагоцитарной активности (табл. 2).
Таблица 1
Основные показатели неврологического дефицита у пациентов с типичной и вирусассоциированной формами РС
|
Показатель |
Типичный РС (n=30) |
Вирусассоциированный РС (n=26) |
||
|
M±mх |
[25; Me; 75] |
M±mх |
[25; Me; 75] |
|
|
Пирамидные нарушения |
1,97±0,08 |
1; 2; 3 |
2,74±0,271 |
2; 3; 4 |
|
Мозжечковые нарушения |
1,45±0,08 |
1; 1; 2 |
1,83±0,21 |
1; 2; 3 |
|
Нарушения функции ЧМН |
0,94±0,08 |
0; 1; 1 |
1,22±0,27 |
0; 1; 2 |
|
Чувствительные нарушения |
0,71±0,06 |
0; 0; 1 |
1,00±0,24 |
0; 1; 2 |
|
Тазовые нарушения |
0,65±0,06 |
0; 0; 1 |
1,00±0,20 |
0; 1; 2 |
|
Зрительные нарушения |
0,45±0,05 |
0; 0; 0,5 |
0,43±0,16 |
0; 0; 0,5 |
|
Психические нарушения |
0,19±0,03 |
0; 0; 0,5 |
0,17±0,10 |
0; 0; 0 |
|
EDSS |
2,90±0,10 |
2; 3; 4 |
3,70±0,301 |
2,5; 4; 5 |
Примечание: 1 — статистически значимые различия между пациентами с типичным и вирусассоциированным РС (p<0,05).
Таблица 2
Основные показатели клеточного и гуморального иммунитета у пациентов с типичной и вирусассоциированной формами РС (формат представления данных M±mx)
|
Показатель |
Группа сравнения (n=20) |
Типичный РС (n=30) |
Вирусассоциированная форма РС (n=26) |
|
Лейкоциты абс. (109/л) |
5,57±0,20 |
6,57±0,20 |
6,61±0,41 |
|
Лимфоциты отн. (%) |
26,20±0,10 |
29,60±0,6 |
31,60±2,001 |
|
Лимфоциты абс. (109/л) |
1,50±0,07 |
1,90±0,05 |
2,10±0,231 |
|
CD3 отн. (%) |
69,70±0,41 |
75,40 ±0,501 |
74,20±1,401 |
|
CD3 абс. (109/л) |
1,00±0,05 |
1,40±0,041 |
1,37±0,151 |
|
CD4 отн. (%) |
40,60±0,40 |
47,10±0,501 |
43,30±1,60 |
|
CD4 абс. (109/л) |
0,59±0,03 |
0,86±0,021 |
0,81±0,081 |
|
CD8, отн. (%) |
22,90±0,40 |
27,40±0,40 |
28,60±1,50 |
|
CD8 абс. (109/л) |
0,36±0,02 |
0,52±0,021 |
0,57±0,061 |
|
CD16 отн. (%) |
12,10±0,40 |
10,50±0,40 |
11,00±1,10 |
|
CD16 абс. (109/л) |
0,18±0,01 |
0,19±0,01 |
0,23±0,04 |
|
Показатель |
Группа сравнения (n=20) |
Типичный РС (n=30) |
Вирусассоциированная форма РС (n=26) |
|
CD19 отн. (%) |
6,70±0,30 |
10,40±0,29 |
11,30±1,501 |
|
CD19 абс. (109/л) |
0,10±0,01 |
0,20±0,01 |
0,23±0,051 |
|
ИРИ |
1,63±0,11 |
1,84±0,05 |
1,66±0,13 |
|
IgA, г/л |
1,79±0,07 |
2,00±0,03 |
1,96±0,10 |
|
IgM, г/л |
1,20±0,05 |
1,25±0,02 |
1,43±0,061,2 |
|
IgG, г/л |
10,50±0,20 |
11,10±0,10 |
11,30±0,20 |
|
ЦИК, у.е. |
60,90±3,50 |
69,40±1,60 |
86,50±6,501,2 |
|
НСТ спонтанный |
93,90±1,90 |
97,30±1,30 |
95,80±3,30 |
|
НСТ стимулированный |
164,30±1,90 |
147,60±2,901 |
142,30±6,601 |
|
Коэффициент стимуляции |
1,76±0,04 |
1,59±0,011 |
1,47±0,041,2 |
Примечание: 1 — статистически значимые (p<0,05) различия между данной группой (с типичным или вирусассоциированным РС) и группой сравнения, 2 — статистически значимые различия между показателями больных с вирусассоциированным и типичным РС.
Для типичного РС характерно изменение активности воспалительного процесса, которое проявляется увеличением количества лейкоцитов, лимфоцитов, относительного и абсолютного содержания всех субпопуляций Т-лимфоцитов, (Т-общих, Т-хелперов, Т-супрессоров/цитотоксических лимфоцитов). Однонаправленные изменения Т-хелперов и Т-супрессоров проявляются отсутствием изменений иммунорегуляторного индекса. Отмечается увеличение и В-лимфоцитов. При этом уровни сывороточных IgM и G практически не изменились, отмечается незначительное увеличение содержания IgA. В фагоцитарном звене фиксировалось снижение адап- тивного потенциала фагоцитов, что проявлялось снижением коэффициента стимуляции. Активацию Т- и В-клеточного звеньев при РС можно рассматривать как косвенные признаки активации аутоиммунного процесса.
При РС, ассоциированном с реактивацией ПГВИ, характер изменений иммунологических показателей в основном был однонаправленным, таким, как при типичном РС, но изменения были более выражены, особенно по показателям IgM, ЦИК и коэффициента стимуляции.
Данные состояния гуморального противогерпети-ческого иммунитета представлены в табл. 3.
Таблица 3
|
Показатель |
Типичный РС (n=30) |
Вирусассоциированная форма РС (n=26) |
р |
|
Антитела класса IgM к ВПГ-1, -2 (кол-во пациентов) |
- |
6 |
- |
|
Оптическая плотность антител класса IgM к ВПГ-1, -2 (M±m) |
- |
0,544±0,199 ОП критич. (0,270) |
- |
|
Антитела класса IgG к ВПГ-1, -2 (кол-во пациентов) |
29 |
26 |
>0,05 |
|
Оптическая плотность антител класса IgG к ВПГ-1, -2 (M±m) |
1,155±0,125 |
1,852±0,156 ОП критич. (0,8) |
>0,05 |
|
Низкоавидные антитела класса IgG к ВПГ-1, -2 (кол-во пациентов) |
- |
26 |
- |
|
Низкоавидные антитела класса IgG к ВПГ-1, -2 (индекс авидности) |
- |
43,15±1,42 |
- |
|
Высокоавидные антитела класса IgG к ВПГ-1, -2 (кол-во пациентов) |
29 |
- |
|
|
Высокоавидные антитела класса IgG к ВПГ-1, -2 (индекс авидности) |
90,9±1,08 |
- |
|
|
Антитела класса IgМ к VZV (кол-во пациентов) |
- |
- |
|
|
Антитела класса IgG к VZV (кол-во пациентов) |
28 |
26 |
>0,05 |
|
Оптическая плотность антител класса IgG к VZV (M±m) |
1,18±0,12 ОП критич. (0,8) |
1,66±0,143 ОП критич. (0,8) |
>0,05 |
|
Индекс авидности антител класса IgG к VZV (M±m) |
90,9±1,08 |
88,12±0,96 |
>0,05 |
|
Антитела класса IgM к VCA (кол-во пациентов) |
- |
9 |
<0,051 |
|
Оптическая плотность антител класса IgM к VCA (M±m) |
- |
1,23±0,2 ОП критич. (0,8) |
|
|
Антитела класса IgG к VCA (кол-во пациентов) |
18 |
24 |
<0,051 |
|
Показатель |
Типичный РС (n=30) |
Вирусассоциированная форма РС (n=26) |
р |
|
Оптическая плотность антител класса IgG к VCA (M±m) |
0,855±0,173 ОП критич. (0,287) |
1,23±0,2 ОП критич. (0,287) |
<0,051 |
|
Низкоавидные антитела класса IgG к VCA (кол-во пациентов) |
- |
24 |
|
|
Низкоавидные антитела класса IgG к VCA (индекс авидности) |
- |
49,2±4,12 |
|
|
Высокоавидные антитела класса IgG к VCA (кол-во пациентов) |
18 |
- |
|
|
Высокоавидные антитела класса IgG к VCA (индекс авидности) |
88,647±1,17 |
- |
|
|
Антитела класса IgG к EBNA (кол-во пациентов) |
24 |
24 |
>0,05 |
|
Оптическая плотность антител класса IgG к EBNA (M±m) |
0,994±0,137 ОП критич. (0,182) |
1,76±0,296 ОП критич. (0,182) |
>0,05 |
|
Антитела класса IgG к ЕА (кол-во пациентов) |
- |
15 |
- |
|
Оптическая плотность антител класса IgG к ЕА (M±m) |
- |
0,66±0,19 ОП критич. (0,287) |
- |
|
Антитела класса IgМ к ЦМВ (кол-во пациентов) |
- |
9 |
- |
|
Оптическая плотность антител класса IgM к ЦМВ (M±m) |
- |
0,392±0,136 ОП критич. (0,287) |
- |
|
Антитела класса IgG к ЦМВ (кол-во пациентов) |
18 |
22 |
>0,05 |
|
Оптическая плотность антител класса IgG к ЦМВ (M±m) |
0,720±0,148 (ОП критич (0,189) |
0,777±0,2 (ОП критич (0,189) |
<0,051 |
|
Низкоавидные антитела класса IgG к ЦМВ (кол-во пациентов) |
- |
22 |
|
|
Низкоавидные антитела класса IgG к ЦМВ (индекс авидности) |
- |
50,4±2,3 |
|
|
Высокоавидные антитела класса IgG к ЦМВ (кол-во пациентов) |
18 |
- |
|
|
Высокоавидные антитела класса IgG к ЦМВ (индекс авидности) |
88,96±0,812 |
||
|
Антитела класса IgG к ГВ 6 (кол-во пациентов) |
- |
5 |
- |
|
Оптическая плотность антител класса IgG к ГВ-6 (M±m) |
- |
1,44±0,154 (ОП критич 0,8) |
- |
Примечание: 1 — различия статистически значимы.
Показатели противогерпетического иммунитета
По данным серологического исследования антител к вирусам герпеса различных типов, у всех пациентов верифицирована персистирующая герпесвирусная инфекция. Ни у кого не отмечалось первичного инфицирования, что объясняется возрастом пациентов (28,9±0,6 года), так как инфицирование этими патогенами происходит преимущественно в детском возрасте.
По клинико-анамнестическим данным в группе больных с вирусассоциированной формой РС выявлены различные признаки реактивации герпетической инфекции, наблюдавшиеся в период, предшествующий обострению, либо в стадии обострения основного заболевания. У 6 из 26 (23,1 %) пациентов данной группы отмечались случаи везикулярных высыпаний, характерные для инфекции, вызванной вирусом герпеса 1, 2-го типов.
На рисунке показано количественное соотношение различных вариантов ПГВИ с реактивацией в исследуемых группах.
Нами выявлено, что микст-инфекция преобладает над моноинфекцией: 24 пациента (92,3%) против 2 пациентов (7,7%) соответственно. Случаи моноинфекции представлены ВПГ 1-го и 2-го типов. Самым распространенным возбудителем микст-инфекции был ВЭБ: 24 случая (92,3%); примерно одинаково часто встречались ВПГ 1-го и 2-го типов и ЦМВ: 17 (65,4%) и 18 (69,2%) соответственно. Реактивации инфекции, вызванной ГВ-6, редко встречались у больных РС. Самым распространенным вариантом герпетической микст-инфекции было сочетание ВПГ 1-го и 2-го типов, ВЭБ и ЦМВ: 8 пациентов (30,8%).
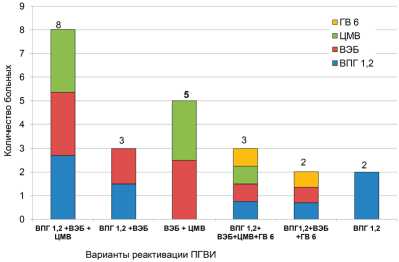
Соотношение различных вариантов реактивации герпетической микст-инфекции
Обсуждение. У больных РС с реактивацией ПГВИ отмечаются неблагоприятные прогностические признаки: более выраженная пирамидная симптоматика, более высокий балл по шкале EDSS, высокие показатели активности РС (частота обострений) и скорости прогрессирования заболевания, основного признака тяжелого течения РС. Полученные результаты коррелируют с данными литературы. Так, по сведениям Скрипченко Е. Ю. и др. (2016), большое значение в развитии нейроинфекций и провокации обострений РС у детей имеет микст-инфекция, вызванная вирусами герпеса различных типов. В 75% случаев обострения РС у детей связаны с реактивацией герпетической инфекции, при этом особое внимание уделялось сочетанию различных возбудителей с вирусом Эпштейна — Барр [7–9].
Изменения в иммунной системе при РС, ассоциированном с ПГВИ, определяются, возможно, вторичной иммунной недостаточностью, вызываемой ГВИ. Отсутствие признаков активации клеточного звена, снижение метаболической активности фагоцитов подтверждают это положение. Сохранение аутоиммунного компонента подтверждается активацией гуморального звена на фоне увеличения уровня ЦИК. Вероятно, изменения в иммунном статусе у больных с РС, ассоциированным с реактивацией ПГВИ, можно расценить как сочетание вторичного иммунодефицита (Т-клеточного) и активного аутоиммунного процесса (активация В-клеточного звена).
Заключение. Наличие реактивации герпесвирусной патологии у пациентов с РС следует расценивать как прогностически неблагоприятный фактор.
Оценка влияния реактивации ПГВИ на иммунный статус больных РС с использованием высокочувствительных и высокоспецифичных иммунологических и молекулярно-генетических методик обследования необходима для диагностики тяжести процесса, прогноза и оптимизации лечения больных с РС.
Список литературы Клинико-иммунологические особенности рассеянного склероза на фоне реактивации персистирующей герпесвирусной инфекции
- Гончарова 3 А. Клинико-эпидемиологические особенности рассеянного склероза в Ростовской области. Медицинский вестник Юга России 2010; (1): 62-66
- Munger KL, Levin LI, O'Reilly EJ, et al. Anti-Epstein-Barr virus antibodies as serological markers of multiple sclerosis: a prospective study among United States military personnel. Mult Scler 2011; 17 (10): 1185-1193. DOI: 10.1177/1352458511408991
- Buljevac D, van Doornum GJ, Flach HZ, et al. Epstein-Barr virus and disease activity in multiple sclerosis. J Neurol Neurosurg Psychiatry 2005 Oct; 76 (10): 1377-1381.4 Kvistad S, MyhrKM, Holmmy T, et al. Antibodies to Epstein-Barr virus and MRI disease activity in multiple sclerosis. Mult Scler 2014 Dec; 20 (14): 1833-40. DOI: 10.1177/1352458514533843
- Lublin FD. New multiple sclerosis phenotypic classification. EurNeurol2014;72(Suppl 1): 1-5. DOI: 10.1159/000367614
- Беликова E.A., Иванова Г.Ф. Современные представления о герпетической инфекции. Лекарственный вестник 2015; 59 (3): 22-27
- Голева О.В., Мурина Е.А., Осипова З.А. Новые подходы к диагностике сочетанных герпесвирусных инфекций при вирусных энцефалитах у детей. В кн.: VI Балтийский конгресс по детской неврологии: сб. тезисов конгресса. СПб.: Санкт-Петербургская общественная организация «Человек и его здоровье», 2016; с. 101
- Grimbacher В, Warnatz К, Yong PFK, et al. The crossroads of autoimmunity and immunodeficiency: Lessons from polygenic traits and monogenic defects. J Allergy Clin Immunol 2016; 137 (1): 3-17. DOI: 10.1016/j.jaci.2015.11.004
- Андреева И. И., Сизякина Л. П., Гончарова З.А. Инверсия го-меостатических свойств иммунной системы при рассеянном склерозе. Медицинский вестник Юга России 2016; (2): 23-27


