Клинико-экономическое обоснование стратегии определения PCA3 в моче при диагностике рака предстательной железы
Автор: Сивков А.В., Ефремов Г.Д., Михайленко Д.С., Григорьева М.В., Каприн А.Д.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Онкоурология
Статья в выпуске: 2, 2016 года.
Бесплатный доступ
Актуальность. PCA3 демонстрирует высокую диагностическую значимость в отношении РПЖ. Немногочисленные исследования клинико-экономической эффективности PCA3, посвящены дорогостоящему тесту «Progensa». Экономические аспекты применения других методик оценки экспрессии PCA3 не изучены. Цель работы - исследование диагностической значимости предложенной в НИИ урологии методики оценки экспрессии PCA3 в моче, основанной на ОТ-ПЦР в реальном времени с последующей оценкой экономической целесообразности опре деления экспрессии PCA3 в моче и разработкой стратегии применения маркера на практике. Материал и методы. Проанализирована выборка образцов постмассажной мочи, полученных от 110 мужчин (44-85 лет). Оценивали уровень сывороточного ПСА, патоморфологические результаты, экспрессию PCA3 в моче. Экономическую целесообразность включения PCA3 в алгоритм диагностики РПЖ, оценивали с помощью экономического моделирования с построением «дерева решений». Результаты. Определен пороговый уровень для РСА3 в моче ≤ 1,23, которому соответствовали диагностическая точность 81,8%, чувствительность 76,3%, специфичность 88,2%, AUC 0,879 95% ДИ(0,803-0,933). С помощью экономического моделирования (10 000 человек) продемонстрировано, что применение для диагностики РПЖ схемы, включающей определение PCA3, является экономически более целесообразным в сравнении со стандартной схемой (при уровне ПСА 4-10 нг/мл). Доля необоснованных затрат на биопсию в стандартной диагностической модели (24 024 931,52 руб.) будет значительно выше, в сравнении с диагностической моделью, включающей PCA3 в моче (5 099 113,04 руб.). В результате исключения ненужных биопсий с помощью PCA3, предполагаемая выгода составит 11 080 706,68 руб. Выводы. Продемонстрировано, что, несмотря на более высокую стоимость в сравнении с исследованием уровня сывороточного ПСА, РСА3 в моче является более надежным маркером, и позволяет сократить расходы на раннюю диагностику РПЖ у пациентов с уровнем ПСА 4-10 нг/мл, за счет исключения ненужных биопсий.
Рак предстательной железы, диагностика, молекулярно-генетический тест, клинико-экономический анализ
Короткий адрес: https://sciup.org/142188106
IDR: 142188106
Текст научной статьи Клинико-экономическое обоснование стратегии определения PCA3 в моче при диагностике рака предстательной железы
Боткинский пр., д.3.
Ефремов Г.Д., к.м.н. – заведующий лабораторией патологической анатомии НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина - филиа-ла ФГБУ «НМИРЦ» Минздрава
России. Тел. 8-499-110-40-67. Россия, 105425, Москва, ул. Парковая 3-я, д. 51.
Михайленко Д.С., к.м.н. – ведущий научный сотрудник лаборатории патологической анатомии с группой молекулярной генетики НИИ урологии и интер-венционной радиологии им Н.А.
Лопаткина – филиала ФГБУ НМИРЦ Минздрава России. Тел. 8-499-110-40-67. Россия, 105425, Москва, ул. Парковая 3-я, д. 51.
Health of Russian Federation. Tel. 8-499-110-40-67. Russian federation, 105425, Moscow, 3-rd Parkovaya street, 51.

граничения стандартной модели ранней диагностики рака предстательной железы (РПЖ), основанной на определении уровня сывороточного простат-специфичес-кого антигена (ПСА), при вели к необходимости поиска новых маркеров и методов для выявления данного заболевания. Для определения показаний к биопсии ПЖ наряду с ПСА было предложено применять различные диагностические алгоритмы, включающие ПСА и его изоформы, прогностические математические модели, учитывать результаты методов инструментальной диагностики, а также уровни биохимических и молекулярно-генетических маркеров [1, 2]. Одним из наиболее перспективных маркеров РПЖ является PCA3 [3]. РСА3 (prostate cancer antigen 3) представляет собой некодирующую РНК. Ген был идентифицирован M.J. Bussemakers и соавт. в 1999 г., которые использовали методику полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) [4]. В последующем для исследования экспрессии РСА3 в ткани ПЖ были предложены и другие методики: транскрипционно-опосредованная амплификация и гибридизация РНК in situ. Специфичность тканевого РСА3 в отношении РПЖ превышает 90% [5, 6]. В 2003 г. D. Hessels и соавт. предложили проводить оценку экспрессии РСА3 методом количественной ОТ-ПЦР не только в ткани, но и в осадке мочи, полученной после массажа ПЖ [7]. В 2006 г. J. Groskopf и соавт. предложили определять экспрессию РСА3 в моче с помощью транскрипционно-опосредованной амплификации [8]. На основе предложенной методики была разработана коммерческая тест-система «Progensa», которая в настоящее время широко используется в мировой практике. При исследовании экспрессии РСА3 в моче с помощью различных модификаций ОТ-ПЦР чувствительность и специфичность маркера составляют 65-92,5% и 41,592%, соответственно [7, 9-14]. В тесте «Progensa», в зависимости от используемого порогового уровня, РСА3 в моче демонстрирует чувствительность 18,6%-97,9% и специфичность 4,7%-95% [15-32].
Рядом авторов проведена оценка возможности стратификации риска РПЖ с помощью PCA3, исследователи определяли взаимосвязь между уровнем экспрессии маркера и степенью агрессивности РПЖ (клиническая и патоморфологи-ческая стадия, степень дифференцировки по Gleason, объем опухоли, наличие экстрапростатического роста). Примечательно, что о наличии взаимосвязи между PCA3 и агрессивностью РПЖ свидетельствуют данные исследований, в которых для оценки экспрессии PCA3 в моче использовалась тест-система «Progensa» [25, 31-38], в то время как авторами, применявшими ОТ-ПЦР, продемонстрированы противоположные результаты [12-14].
Мнения относительно возможности включения оценки экспрессии РСА3 в моче в стандарт диагностики РПЖ расходятся. FDA (U.S. Food and Drug Administration) рекомендует учитывать результаты данного исследования для принятия решения о выполнении повторной биопсии ПЖ у мужчин старше 50 лет. В то же время, по данным иссле- экспериментальная и клиническая урология №2 2 0 16 дования, посвященного оценке экономической целесообразности применения маркера, выгода, достигнутая за счет исключения ненужных биопсий, не покрывает затрат на определение экспрессии РСА3 с помощью теста «Progensa» [39]. Основываясь на анализе «затраты-эф-фективность», NICE (National Institute for Health and Care Excellence) не рекомендовал включение теста РСА3 («Progensa») в стандартную модель обследования пациентов с подозрением на РПЖ в Великобритании [40].
Представленные в литературе данные о клинико-экономической эффективности РСА3 соответствуют дорогостоящему коммерческому тесту «Progensa», в то время как экономические аспекты применения других методик исследования экспрессии РСА3 в моче не оценивали.
Для улучшения диагностики РПЖ в НИИ урологии была предложена методика оценки экспрессии PCA3 в моче, основанная на ОТ-ПЦР в режиме реального времени. В нашей предыдущей статье представлены первые результаты клинической апробации предложенной методики [41]. На основании полученных данных была поставлена задача по продолжению набора клинического материала с последующей оценкой экономической целесообразности исследования экспрессии PCA3 в моче и разработкой стратегии применения маркера на практике.
МАТЕРИАЛЫ И МЕТОДЫ
Клинический материал
Для оценки эффективности метода определения экспрессии PCA3, была проанализирована выборка, представленная образцами постмассажной мочи, полученными от 110 мужчин (44-85 лет) с подозрением на РПЖ (повышение уровня сывороточного ПСА; данные за РПЖ при пальцевом ректальном исследовании), направленных на трансректальную биопсию ПЖ. Во всех случаях окончательный диагноз был установлен на основании результа- тов патоморфологического исследования.
Сбор мочи во всех случаях производили перед выполнением биопсии. Экспрессию PCA3 в моче определяли с помощью ОТ-ПЦР в режиме реального времени. Методика детально была описана нами ранее [41].
Статистические расчеты
Статистическая обработка данных была проведена в программе MedCalc. Для описательной статистики использованы медиана, 25 и 75 процентили, а для оценки достоверности различий – непараметрический критерий Манна-Уитни. Для определения корреляционных зависимостей применен непараметрический критерий Спирмена. Чувствительность, специфичность и диагностическая точность были рассчитаны по стандартным формулам. Оптимальный пороговый уровень PCA3 в моче был определен с помощью ROC-анализа. Для дополнительной оценки диагностической значимости PCA3 был рассчитан показатель площади под ROC-кривой (AUC).
Расчет себестоимости исследования экспрессии РСА3 в моче
Расчет себестоимости исследования экспрессии PCA3 в моче осуществляли в соответствии с методикой, описанной в приложении №13 «Расчет себестоимости лабораторного анализа» приказа МЗ и СР РФ №380 от 25.12.1997, по формуле:
Себестоимость медицинской услуги
Расходы на оплату труда основного персонала +
Начисления на выплаты по оплате труда основного персонала +
Прямые материальные расходы +
Расходы на амортизацию оборудования +
Накладные расходы
Все показатели были рассчитаны в российских рублях.
Расчет стоимости диагностики РПЖ
Для расчета затрат на диагностику РПЖ у 1 пациента были использованы данные о стоимости медицинских услуг, приведенные в Тарифном соглашении на оплату медицинской помощи, оказываемой по Территориальной программе обязательного медицинского страхования города Москвы на 2015 год (Приложение № 6; Приложение № 8.2).
Экономическое моделирование
С целью оценки экономической целесообразности включения PCA3 в алгоритм диагностики РПЖ, было проведено экономическое моделирование с построением «дерева решений». Выполнен сравнительный анализ клинико-экономической эффективности стандартной схемы диагностики РПЖ (при уровне сывороточного ПСА 4-10 нг/мл) и схемы, включающей определение PCA3 в моче (со стратификацией пациентов на основании результатов молекулярно-генетического исследования), из расчета на 10 000 человек.
Для моделирования распределения значенийPCA3 в выборке из 10 000 человек, в программе MsExcel была выполнена генерация случайных величин по вариационному ряду. В результате проведения вариационного анализа исходной выборки (n=110), было выделено 5 диапазонов значений. Генерация случайных чисел выполнена с учетом распределения случайной величины в выбранных диапазонах. Для моделирования вероятности обнаружения РПЖ при биопсии у 10 000 пациентов с уровнем сывороточного ПСА 4-10 нг/мл использованы данные популяционного исследования 36316 биоптатов [42].
Для сравнения затрат на диагностику РПЖ по стандартной схеме и по схеме, включающей исследование РСА3 в моче, была рассчитана стоимость отдельных этапов, а также общая стоимость каждой ветви алгоритма. Оценку необоснованных затрат на биопсию ПЖ проводили с учетом числа истинно и ложноположительных результатов.
РЕЗУЛЬТАТЫ
РСА3 в моче
В соответствии с результатами патоморфологического заключения, исследуемая выборка образцов мочи (n=110) была разделена на две подгруппы: I (n=59) – РПЖ и II (n=51) – ДГПЖ и/или хронический простатит. Различия уровней экспрессии РСА3 между I и II подгруппами были определены как статистически значимые (табл. 1).
С помощью ROC-анализа, был определен наиболее оптимальный пороговый уровень для значения РСА3 в моче ≤1,23, которому соответствовали диагностическая точность 81,8%, чувствительность 76,3% и специфичность 88,2% .
Показатель AUC РСА3 в моче составил 0,879 95% ДИ(0,803-0,933), что подтверждает высокую диагностическую значимость маркера (рис. 1).
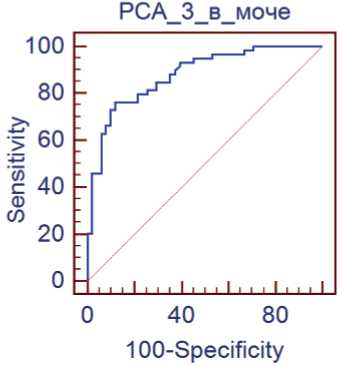
Рис. 1. ROC-кривая PCA3 в моче
Не выявлено статистически значимой корреляции между уровнем экспрессии РСА3 в моче и степенью дифференцировки опухоли по Gleason (р>0,05). Таким образом, экспрессия РСА3 в моче не позволяет судить об агрессивности РПЖ.
Таблица 1. Сравнение показателей экспрессии РСА3 в моче у пациентов с РПЖ (М-I) и доброкачественными заболеваниями ПЖ (М-II)
|
Показатели |
I (n=59) Ме (25%:75%) |
II (n=51) Ме (25%:75%) |
Уровень значимости |
|
Возраст (лет) |
65,00 (60,25:70,75) |
62,00 (58,00:67,00) |
р <0,05 |
|
Общий ПСА (нг/мл) |
7,55 ( 5,40:11,00) |
5,90 (4,09:8,44) |
р <0,05 |
|
PCA3 |
-0,20 (-0,94:1,22) |
4,09 (2,06:6,41) |
р <0,01 |
Стоимость методов диагностики РПЖ для экономического моделирования
В расчет себестоимости исследования экспрессии РСА3 в моче с методом ПЦР с обратной транскрипцией в режиме реального времени были включены следующие показатели:
-
1. Расходы на оплату труда основного персонала = 30,47 руб.
-
2. Начисления на выплаты по оплате труда основного персонала = 9,20 руб.
-
3. Прямые материальные расходы = 626,27 руб.
-
4. Расходы на амортизацию оборудования = 44,36 руб.
-
5. Накладные расходы = 29,30 руб.
Таким образом, себестоимость исследования экспрессии PCA3 в моче составила 739,60148 руб .
В расчет затрат на определение уровня экспрессии PCA3 в моче включена себестоимость следующих услуг:
-
- массаж ПЖ, взятие сока предстательной железы (код услуги 5004) 44,91 руб.;
-
- исследование экспрессии PCA3 в моче методом ПЦР с обратной транскрипцией в режиме реального времени 739,60 руб.
Таким образом, затраты на определение уровня экспрессии PCA3 в моче у 1 человека составили 784,51 руб.
В расчет затрат на определение уровня сывороточного ПСА включена себестоимость следующих услуг:
-
- взятие крови из вены, кровопускание (код услуги 2004) 50,58 руб.;
-
- определение простатического антигена (РSА) (код услуги 28071) 157,79 руб.
Таким образом, затраты на определение уровня сывороточного ПСА у 1 человека составили 208,37 руб.
В расчет затрат на биопсию ПЖ с гистологическим исследованием биоптатов включена себестоимость следующих услуг:
-
- биопсия предстательной железы (код услуги 52408) 1217,86 руб.;
-
- гистологическое исследование одного тканевого фрагмента биопсийного (операционного и диагностического) материала с применением дополнительных гистологических и/или гистохимических окрашиваний, а также декальцинации (код услуги 129006) 2218,20 руб.
Таким образом, затраты на биопсию ПЖ с гистологическим исследованием биоптатов у 1 человека составили 3436,06 руб .
Клинико-экономический анализ
С помощью экономического моделирования проведен сравнительный анализ клинико-экономической эффективности стандартной схемы диагностики РПЖ из расчета на 10 000 человек (при уровне сывороточного ПСА 4-10 нг/мл) со схемой, включающей определение PCA3 в моче (со стратификацией пациентов на основании результатов молекулярно-генетического исследования).
По данным популяционного исследования, выполненного S.M. Gilbert и соавт., при анализе 36 316 био-птатов, вероятность обнаружения РПЖ у пациентов с уровнем сывороточного ПСА 4-10 нг/мл составляет 30,08% [42]. Следовательно, при обследовании, 10 000 человек с уровнем сывороточного ПСА 410 нг/мл, численность лиц с РПЖ составит 3008 человек (30,08%), а численность здоровых лиц – 6 992 человек (69,92%).
Чистая стоимость диагностики РПЖ у 10000 человек с помощью стандартного алгоритма (определение уровня сывороточного ПСА с последующей биопсией ПЖ) составит 36 444 300,00 руб .
Затраты на исследование уровня сывороточного ПСА и уровня экспрессии РСА3 в моче у 10 000 человек составят 9 928 814,80 руб.
С помощью имитационного экспериментальная и клиническая урология №2 2 0 16 моделирования (генерация случайной величины по вариационному ряду) определено, что при исследовании экспрессии РСА3 в моче у 10 000 человек, значения распределятся следующим образом: тест отрицательный – экспрессия РСА3 не обнаружена (n=5508), тест положительный – гиперэкспрессия РСА3 (n=4492).
Пациенты с гиперэкспрессией РСА3 в моче будут направлены на биопсию ПЖ, стоимость которой составит 15 434 781,52 руб.
Стоимость диагностики РПЖ у 10 000 человек с помощью алгоритма, включающего РСА3, составит 25 363 593,32 руб.
Таким образом, экономия за счет исключения ненужных биопсий с помощью алгоритма, включающего исследование уровня экспрессии РСА3 в моче, составит 11 080 706,68 руб .
Число истинно положительных и ложноположительных результатов сывороточного ПСА при уровне 4-10 нг/мл будет соответствовать числу лиц с заболеванием (n= 3008) и числу здоровых лиц (n= 6992), соответственно. Число истинно положительных результатов РСА3 будет также соответствовать числу лиц с заболеванием – 3008, а число ложноположительных ре-
С гандарчный алгоритм диагностики РПЖ (ПСА + биопсия) Стоимость 36 444 300 руб.
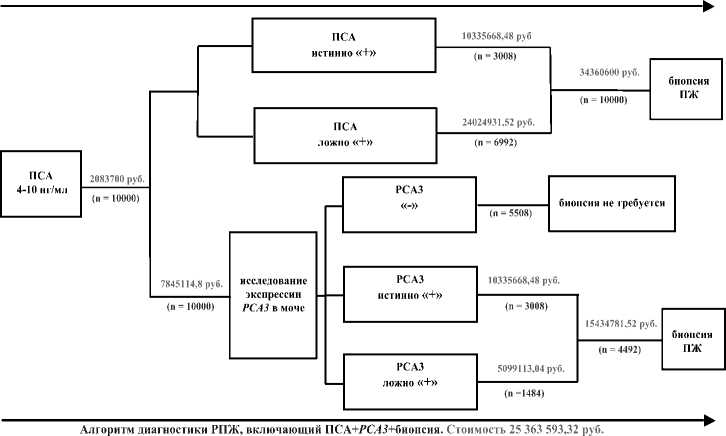
Рис. 2. Дерево решений и стоимость этапов диагностики РПЖ
зультатов РСА3 будет меньше и составит 1484. Суммарная стоимость биопсии ПЖ при истинно положительных результатах ПСА составит 10 335 668,48 руб , а при ложноположительных – 24 024 931,52 руб . Суммарная стоимость биопсии ПЖ при истинно положительных результатах РСА3 составит 10 335 668,48 руб. , а при ложноположительных – 5 099 113,04 руб .
Таким образом, обоснованные и необоснованные затраты на биопсию в стандартной диагностической модели составят 10 335 668,48 руб. (30,08% от 34 360 600 руб.) и 24 024 931,52 руб. (69,92% от 34 360 600 руб.), соответственно. Обоснованные и необоснованные затраты на биопсию в диагностической модели, основанной на РСА3, составят 10 335 668,48 руб (66,96% от 15 434 781,52 руб.) и 5 099 113,04 руб. (33,04% от 15 434 781,52 руб.), соответственно.
С помощью экономического моделирования (10 000 человек) продемонстрировано, что применение для диагностики РПЖ схемы, включающей определение РСА3 в моче с использованием праймеров российского производства (со стратификацией пациентов на основании результатов молекулярно-генетического исследования) является эко- номически более целесообразным в сравнении со стандартной схемой (при уровне сывороточного ПСА 4-10 нг/мл). Доля необоснованных затрат на биопсию в стандартной диагностической модели будет значительно выше, в сравнении с диагностической моделью, включающей РСА3 в моче: 24 024 931,52 руб. (69,92% от 34 360 600 рублей) и 5 099 113,04 рублей (33,04% от 15 434 781,52 рублей), соответственно. Предполагаемая выгода, достигнутая за счет исключения ненужных биопсий с помощью РСА3, составит 11 080 706,68 руб. Результаты экономического моделирования проиллюстрированы с помощью «дерева решений» (рис. 2).
Алгоритм применения РСА3
В соответствии с результатами настоящей работы, установлены следующие показания к исследованию экспрессии РСА3 в постмассажной моче методом ОТ-ПЦР в режиме реального времени: для принятия решения о биопсии ПЖ у пациентов с уровнем сывороточного ПСА от 4 до 10 нг/мл. Уровень экспрессии PCA3 в моче ≤ 1,23 является показанием к проведению биопсии ПЖ.
Согласно результатам, полученным на предыдущем этапе настоящего исследования, при пороговом уровне РСА3 в ткани ≤5,7, маркер демонстрирует диагностическую точность 88,0%, чувствительность 95,0% и специфичность 86,2% [41]. Таким образом, можно выделить следующие показания для оценки РСА3 в ткани ПЖ методом ОТ-ПЦР в режиме реального времени: для принятия решения о повторной биопсии (при отрицательных результатах первичной) у пациентов с уровнем сывороточного ПСА более 10 нг/мл или гиперэкспрессией PCA3 в моче. Уровень экспрессии PCA3 ≤ 5,73 в ткани ПЖ при отрицательных результатах стандартной биопсии – является показанием к проведению повторной биопсии.
Таким образом, предложен алгоритм диагностики РПЖ,
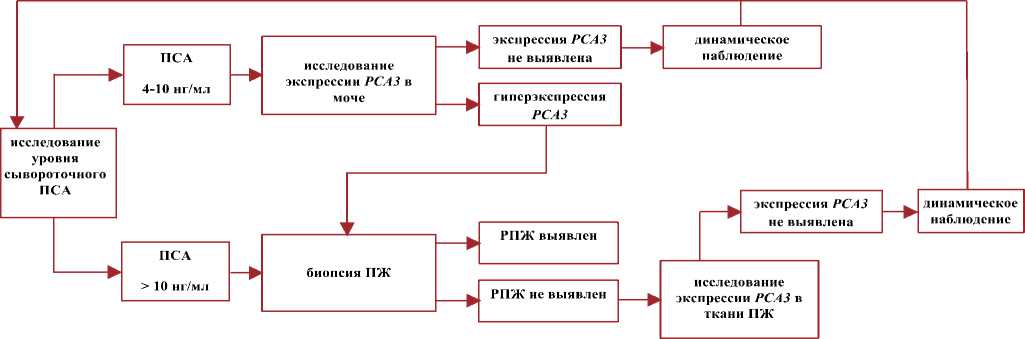
Рис. 3. Алгоритм диагностики РПЖ на основе РСА3
гиперэкспрессия
PC АЗ повторная биопсия ПЖ
включающий определение экспрессии PCA3 в моче и ткани ПЖ (риc. 3)
ОБСУЖДЕНИЕ
Данные о диагностической эффективности PCA3 в моче, продемонстрированные в настоящей работе, сопоставимы с результатами авторов, использовавших ОТ-ПЦР для определения экспрессии PCA3 в моче [7, 9-14].
Нами не было выявлено статистически значимой корреляции между экспрессией PCA3 в моче со степенью дифференцировки опухоли по Gleason, что сопоставимо с результатами других авторов, использовавших ОТ-ПЦР [12-14].
С помощью экономического моделирования продемонстрировано, что, несмотря на более высокую стоимость в сравнении с исследованием уровня сывороточного ПСА, определение экспрессии РСА3 в моче позволяет сократить расходы на раннюю диагностику РПЖ у пациентов с уровнем ПСА 4-10 нг/мл. Благодаря высокой диагностической значимости, РСА3 позволяет исключить значительное число ненужных биопсий. Результаты настоящего исследования отличны от данных других авторов [39, 40], которые исследовали экономическую эффективность тест-системы «Progensa». Вероятно, это обусловлено значительно более высокой стоимостью исследования экспрессии РСА3 с помощью коммерческой тест-системы «Progensa». Также причиной могут быть различия показателей диагностической значимости РСА3, которые варьируют в зависимости от применяемой методики исследования (настоящая работа выполнена с использованием оригинальных праймеров российского производства).
ВЫВОДЫ
Результаты настоящей работы подтверждают высокую диагностическую эффективность исследования экспрессии РСА3 в моче методом ОТ-ПЦР с обратной транскрипцией в режиме реального времени в отношении РПЖ.
Установлено, что прогнозировать степень агрессивности РПЖ на основании уровня экспрессии РСА3 в моче, не представляется возможным.
Продемонстрированы клинические и экономические преимущества определения РСА3 в моче в сравнении с сывороточным ПСА.
Разработана стратегия применения исследования экспрессии PCA3 в постмассажной моче и биоптатах. Предложен диагностический алгоритм, применение которого позволит оптимизировать затраты на раннее выявление РПЖ, за счет сокращения числа ненужных биопсий.
Резюме:
Актуальность. PCA3 демонстрирует высокую диагностическую значимость в отношении РПЖ. Немногочисленные исследования клинико-экономической эффективности PCA3, посвящены дорогостоящему тесту «Progensa». Экономические аспекты применения других методик оценки экспрессии PCA3 не изучены.
Цель работы - исследование диагностической значимости предложенной в НИИ урологии методики оценки экспрессии PCA3 в моче, основанной на ОТ-ПЦР в реальном времени с последующей оценкой экономической целесообразности опре-
Список литературы Клинико-экономическое обоснование стратегии определения PCA3 в моче при диагностике рака предстательной железы
- Adhyam M, Gupta AK. A Review on the Clinical Utility of PSA in Cancer Prostate. Indian J Surg Oncol 2012; 3(2):120-9.
- Louie KS, Seigneurin A, Cathcart P, Sasieni P. Do prostate cancer risk models improve the predictive accuracy of PSA screening? A meta-analysis. Ann Oncol 2015; 26(5):848-64.
- Salagierski M, Schalken JA. Molecular diagnosis of prostate cancer: PCA3 and TMPRSS2:ERG gene fusion. J Urol. 2012; 187:795-801.
- Bussemakers MJ, van Bokhoven A, Verhaegh GW, Smit FP, Karthaus HF, Schalken JA, et al. DD3: a new prostate-specific gene, highly overexpressed in prostate cancer. Cancer Res 1999;59:5975-9.
- Warrick JI, Tomlins SA, Carskadon SL, Young AM, Siddiqui J, Wei JT, et al. Evaluation of tissue PCA3 expression in prostate cancer by RNA in situ hybridization-a correlative study with urine PCA3 and TMPRSS2-ERG. Mod Pathol 2014;27(4):609-20.
- Popa I, Fradet Y, Beaudry G, Hovington Н, Beaudry G, Tetu B. Identification of PCA3 (DD3) in prostatic carcinoma by in situ hybridization. Mod Pathol 2007;20:1121-27.
- Hessels D, Klein Gunnewiek JM, van Oort I, Karthaus HF, van Leenders GJ, van Balken B, et al. DD3(PCA3)-based molecular urine analysis for the diagnosis of prostate cancer. Eur Urol 2003;44:8-15.
- Groskopf J, Aubin SM, Deras IL, Blase A, Bodrug S, Clark C, et al. APTIMA PCA3 Molecular Urine Test: Development of a Method to Aid in the Diagnosis of Prostate Cancer. Clin Chem 2006;52(6):1089-95.
- Van Gils MP, Hessels D, Van Hooij O, Jannink SA, Peelen WP, Hanssen SL. The time-resolved fluorescence-based PCA3 test on urinary sediments after digital rectal examination; a Dutch multicenter validation of the diagnostic performance. Clin cancer res 2007;13:939-43.
- Ouyang B, Bracken B, Burke B, Chung E, Liang J, Ho SM. A duplex quantitative polymerase chain reaction assay based on quantification of alpha-methylacyl-CoA racemase transcripts and prostate cancer antigen 3 in urine sediments improved diagnostic accuracy for prostate cancer. J Urol 2009;181(6):2508-13.
- Ng CF, Chiu PKF, Lam NY, Yeung R, Chow J, Chan B. The role of urine prostate cancer antigen 3 mrna levels in the diagnosis of prostate cancer among Hong Kong Chinese patients. Hong Kong Med J 2012;18:459-65.
- Foj L, Milà M, Mengual L, Luque P, Alcaraz A, Jiménez W, et al. Real-time PCR PCA3 assay is a useful test measured in urine to improve prostate cancer detection. Clinica Chimica Acta 2014;435:53-8.
- Сидоренков А.В., Говоров А.В., Пушкарь Д.Ю., Павлов К.А., Шкопоров А.Н., Хохлова Е.В., и др. Российская тест-система РСА3: первые результаты. Экспериментальная и клиническая урология 2014;2:44-9.
- Wang FB, Chen R, Ren SC, Shi XL, Zhu YS, Zhang W, et al. Prostate cancer antigen 3 moderately improves diagnostic accuracy in Chinese patients undergoing first prostate biopsy. Asian J Androl 2016;18:1-6.
- Marks LS, Fradet Y, Lim Deras I, Blase A, Mathis J, Aubin SM, et al. PCA3 molecular urine assay for prostate cancer in men undergoing repeat biopsy. Urology 2007;69:532-35.
- Haese A, de la Taille A, van Poppel H, Marberger M, Stenzl A, Mulders PFA, et al. Clinical utility of the PCA3 urine assay in european men scheduled for repeat biopsy. Eur Urol 2008;54:1081-88.
- Deras IL, Aubin SMJ, Blase A, Day JR, Koo S, Partin AW, et al. PCA3: a molecular urine assay for predicting prostate biopsy outcome. J Urol 2008;179:1587-92.
- Nakanishi H, Groskopf J, Fritsche HA, Bhadkamkar V, Blase A, Kumar SV, et al. PCA3 molecular urine assay correlates with prostate cancer tumor volume: implication in selecting candidates for active surveillance. J Urol 2008;179:1804-09.
- Shappell SB, Fulmer J, Arguello D, Wright BS, Oppenheimer JR, Putzi MJ. PCA3 Urine mRNA testing for prostate carcinoma: patterns of use by community urologists and assay performance in reference laboratory setting. Urology 2009;73:363-8.
- Wang R, Chinnaiyan AM, Dunn RL, Wojno KJ, Wei JT. Rational approach to implementation of prostate Cancer antigen 3 into clinical care. Cancer 2009;115:3879-86.
- Roobol MJ, Schroder FH, van Leeuwen P, Wolters T, van den Bergh RC, van Leenders GJ, et al. Performance of the prostate cancer antigen 3 (PCA3) gene and prostate-specific antigen in prescreened men: exploring the value of PCA3 for a first-line diagnostic test. Eur Urol 2010;58:475-81.
- Rigau M, Morote J, Mir MC, Ballesteros C, Ortega I, Sanchez A, et al. PSGR and PCA3 as biomarkers for the detection of Prostate cancer in urine. Prostate 2010;70:1760-7.
- Auprich M, Haese A, Walz J, Pummer K, De La Taille A, Graefen M, et al. External validation of urinary PCA3-based nomograms to individually predict prostate biopsy outcome. Eur Urol 2010;58:727-32.
- Vlaeminck-Guillem V, Campos-Fernandes JL, Champetier D, Chikh K, Decaussin-Petrucci M, Devonec M, et al. Value of PCA3 urinary test for prostate biopsy decision: the lyon-sud university hospital experience. Ann Biol Clin 2011;69:31-9.
- De La Taille A, Irani J, Graefen M, Chun F, De Reijke T, Kil P, et al. Clinical evaluation of the PCA3 assay in guiding initial biopsy decisions. J Urol 2011;185:2119-25.
- Pepe P1, Fraggetta F, Galia A, Skonieczny G, Aragona F. PCA3 score and prostate cancer diagnosis at repeated saturation biopsy. Which cut-off: 20 or 35?


