Клинико-эпидемиологическая оценка влияния факторов риска на развитие болезней системы кровообращения у ликвидаторов последствий Чернобыльской катастрофы
Автор: Мешков Н.А., Куликова Т.А., Вальцева Е.А.
Рубрика: Научные статьи
Статья в выпуске: 1 т.25, 2016 года.
Бесплатный доступ
В статье приведены результаты клинико-эпидемиологического исследования влияния факторов риска на развитие болезней системы кровообращения и цереброваскулярных болезней у ликвидаторов последствий аварии на ЧАЭС. Установлено, что вероятность развития болезней системы кровообращения у ликвидаторов последствий аварии значительно выше, чем у необлучённых мужчин из группы сравнения. Приоритетной патологией в структуре болезней системы кровообращения являются цереброваскулярные болезни, доля которых у ликвидаторов последствий аварии 1986 г. участия в 1,7 и 3,6 раза выше, чем соответственно у ликвидаторов последствий аварии 1987 и 1988 гг. Показано, что болезни системы кровообращения и цереброваскулярные болезни у ликвидаторов последствий аварии развиваются в более раннем возрасте, чем у необлучённых мужчин из группы сравнения - соответственно на 7,5 и 12,8 лет раньше. Различие в возрасте между ликвидаторами последствий аварии 1986 г. участия с цереброваскулярными болезнями и мужчинами группы сравнения с таким же диагнозом достигает 13,6 лет. Выявлены положительные корреляции цереброваскулярных болезней с дозой облучения и с артериальной гипертензией, с возрастом корреляция отрицательная. Влияние радиационного фактора подтверждено результатами нейровизуализационного и нейрофизиологического исследований.
Ликвидаторы последствий аварии (лпа), чаэс, болезни системы кровообращения, цереброваскулярные болезни, возраст, доза облучения, фактор риска, эпидемиологические исследования, частота заболеваний, вероятность заболевания
Короткий адрес: https://sciup.org/170170245
IDR: 170170245
Текст научной статьи Клинико-эпидемиологическая оценка влияния факторов риска на развитие болезней системы кровообращения у ликвидаторов последствий Чернобыльской катастрофы
Ведущее место в структуре заболеваемости ликвидаторов последствий аварии (ЛПА) на Чернобыльской АЭС занимают болезни системы кровообращения, среди которых приоритетными являются артериальная гипертензия (АГ), ишемическая болезнь сердца (ИБС) и цереброваскулярные болезни (ЦВБ). Выраженный рост ЦВБ наблюдался среди ЛПА на ЧАЭС в первые 5-10 лет после 1986 г. – в период с 1986 по 1993 гг. удельный вес этой патологии увеличился в 10 раз. Характерно значительное «омоложение» сердечно-сосудистой и цереброваскулярной патологии – в среднем на 10 лет – по сравнению с общей популяцией [1-7]. Цереброваскулярные болезни выявлены у 87% из обследованных ЛПА с дозой облучения ≤ 0,3 Гр [8]. По данным Национального радиационно-эпидемиологического регистра (НРЭР) к группе риска по ЦВБ относятся ликвидаторы 1986 г. участия в аварийно-восстановительных работах, облучённые в дозе более 0,15 Гр [9]. Цереброваскулярная патология является одной из основных причин снижения качества жизни, инвалидности и смертности ЛПА на ЧАЭС. Показано, что основной вклад в объяснённую дисперсию заболеваемости и смертности ЛПА от ЦВБ вносят возраст, доза облучения, год въезда в зону облучения и место жительства ликвидатора до прибытия в зону ЛПА на ЧАЭС [10]. Помимо перечисленных неустранимых (немодифицируемых) факторов, влияние на развитие ЦВБ оказывают и модифицируемые факторы: артериальная гипертензия и ише-
Мешков Н.А.* – зав. лаб., д.м.н., проф.; Вальцева Е.А. – вед. научн. сотр., к.б.н. ФГБУ «НИИ ЭЧ и ГОС им. А.Н. Сысина» Минздрава России.
Куликова Т.А. – зав. отд., к.м.н. ФГБУ «РНЦРР» Минздрава России.
мическая болезнь сердца, которые являются ведущими в развитии прогредиентных форм ЦВБ [5, 11, 12]. В необлучённой популяции обоего пола распространённость АГ и ИБС среди факторов риска сосудистых заболеваний головного мозга составляет соответственно 47,0% и 9,0% [13], а среди мужчин 40-59 лет – 15,6% [14]. По данным [15] среди участников ликвидации последствий чернобыльской катастрофы доли ИБС и АГ составляют соответственно 35,5% и 19,7%.
Цель исследования – оценка влияния немодифицируемых и модифицируемых факторов риска на развитие цереброваскулярных болезней у ликвидаторов последствий аварии на ЧАЭС.
Материалы и методы
Выполнено кросс-секционное исследование заболеваемости среди 691 ЛПА на ЧАЭС (группа наблюдения), проходивших обследование и лечение в отделении радиационной медицины ФГБУ «Российский научный центр рентгенорадиологии» Минздрава России за период 2006-2011 гг., и среди 129 мужчин из необлучённой популяции (группа сравнения). В обе группы не включались лица, перенёсшие острое нарушение мозгового кровообращения и черепномозговую травму. Статистически значимых различий между возрастом обследованных в основной группе 57,6 лет (95% ДИ: 55,8; 59,5) и группе сравнения 57,9 лет (95% ДИ: 55,0; 60,9) не выявлено (р=0,138).
Показатели патологической поражённости населения (частота выявленных заболеваний при обследовании населения) рассчитывались на 1000 обследованных с доверительными интервалами с вероятностью 95% и распределялись по классам болезней в соответствии с [16].
Для эпидемиологической оценки статистических связей между дозой облучения, возрастом и заболеваемостью ЛПА на ЧАЭС использовался комплекс методов математико-статистического анализа данных с помощью пакета прикладных программ Statistica 10.0 и Microsoft Excel: дисперсионный (ANOVA – Analysis of Variation), Nonparametric Statistics и корреляционнорегрессионный анализы. Выполнена оценка отношения шансов (odds ratio – ОR) и относительных рисков (relation risk – RR).
Результаты и обсуждение
Распределение ликвидаторов по периодам участия в проведении аварийно-восстановительных работ на ЧАЭС и дозе облучения представлено в табл. 1.
Как видно из табл. 1, средние дозы облучения в 1986 и 1988 гг. не превышали установленных дозовых пределов, в 1987 г. превышение составило 0,002 Гр.
Таблица 1
Распределение ЛПА по периодам проведения аварийно-восстановительных работ и дозе облучения
|
Период проведения работ, год |
Удельный вес ЛПА, % |
Доза облучения (95% ДИ), Гр |
|
1986 |
53,0 |
0,172 (0,163; 0,180) |
|
1987 |
30,5 |
0,102 (0,095; 0,110) |
|
1988 |
16,5 |
0,046 (0,038; 0,055) |
|
1986-1988 |
100 |
0,130 (0,123; 0,136) |
Таблица 2
Патологическая поражённость ЛПА и группы сравнения, на 1000 обследованных
|
Классы и коды болезней по МКБ-10 |
Патологическая поражённость, на 1000 обследованных (95% ДИ) |
|
|
ЛПА на ЧАЭС |
Группа сравнения |
|
|
II Новообразования |
50,7 (46,9; 54,4) |
54,3 (45,7; 55,4) |
|
IV Болезни эндокринной системы |
20,3 (17,3; 23,3) |
62,0 (53,6; 62,6) |
|
VI Болезни нервной системы |
88,3 (85,9; 90,7) |
85,3 (79,2; 85,9) |
|
IX Болезни системы кровообращения |
758,3 (726,4; 790,2) |
596,9 (512,3; 600,9) |
|
I11-I13 Артериальная гипертензия |
173,7 (145,4; 201,9) |
279,1 (201,7; 282,7) |
|
I20-I25 Ишемическая болезнь сердца |
150,5 (123,8; 177,2) |
155,0 (92,6; 160,0) |
|
I60-I69 Цереброваскулярные болезни |
387,8 (351,6; 424,2) |
77,5 (70,3; 79,4) |
|
X Болезни органов дыхания |
18,8 (15,9; 21,7) |
69,8 (61,8; 70,3) |
|
XI Болезни органов пищеварения |
27,5 (24,2; 30,8) |
325,6 (244,7; 326,9) |
|
XIII Болезни костно-мышечной системы |
42,0 (38,3; 45,6) |
201,6 (132,3; 203,2) |
|
XIV Болезни мочеполовой системы |
2,9 (1,6;4,1) |
93,0 (88,6; 93,1) |
|
Общая поражённость |
1160,6 (1087,0; 1234,2) |
1619,6 (1460,0; 1622,9) |
Патологическая поражённость ЛПА и в группе сравнения (ГС) представлена в табл. 2.
Ранжирование показало, что в обеих группах (табл. 2) на первом месте находятся болезни системы кровообращения (класс IX), второе и третье места в группе ЛПА занимают болезни нервной системы (класс VI) и новообразования (класс II), а в ГС – соответственно болезни органов пищеварения (класс XI) и костно-мышечной системы (класс XIII).
Результаты оценки шансов и рисков для различных классов и групп заболеваний среди ликвидаторов, подвергшихся облучению, по отношению к необлучённой группе сравнения представлены в табл. 3.
Таблица 3 Отношение шансов и рисков для различных классов и групп заболеваний среди ЛПА по отношению к группе сравнения
|
Классы и коды болезней по МКБ-10 |
ОR |
RR |
χ² |
р |
|
II Новообразования |
0,93 |
0,93 |
0,15 |
>0,05 |
|
IV Болезни эндокринной системы |
0,31 |
0,33 |
8,95 |
0,01 |
|
VI Болезни нервной системы |
1,04 |
1,04 |
0,00 |
>0,05 |
|
IX Болезни системы кровообращения, в том числе: |
2,86 |
1,36 |
26,89 |
0,000 |
|
I11-I13 Артериальная гипертензия |
0,54 |
0,62 |
8,54 |
0,01 |
|
I20-I25 Ишемическая болезнь сердца |
0,97 |
0,97 |
0,07 |
>0,05 |
|
I60-I69 Цереброваскулярные болезни |
7,54 |
5,00 |
45,3 |
0,000 |
|
X Болезни органов дыхания |
0,26 |
0,27 |
12,85 |
0,001 |
|
XI Болезни органов пищеварения |
0,06 |
0,08 |
144,64 |
0,000 |
|
XIII Болезни костно-мышечной системы |
0,17 |
0,21 |
46,83 |
0,000 |
|
XIV Болезни мочеполовой системы |
0,03 |
0,03 |
58,13 |
0,000 |
Сравнительный анализ частоты заболеваний, выявленных в группах наблюдения и сравнения, показал (табл. 3), что частота (RR=1,4) и вероятность заболеваний сердечно-сосудистой патологией (OR=2,9), в том числе ЦВБ (RR=5,0 и OR=7,5), среди ЛПА значительно выше, чем в группе сравнения. Относительный риск и вероятность заболеть другими выявленными заболеваниями у ЛПА меньше, чем в группе сравнения.
Структура патологической поражённости ЛПА и группы сравнения представлена на рис. 1.
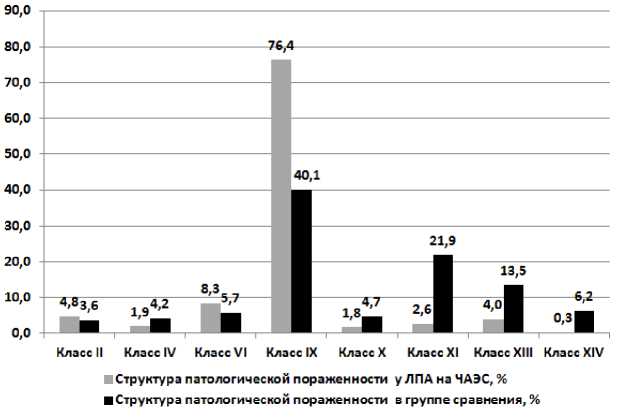
Рис. 1. Структура патологической поражённости ЛПА и группы сравнения, %.
Как показано на рис. 1, в структуре выявленных у ЛПА заболеваний повышен удельный вес новообразований (класс II), болезней нервной системы (класс VI) и БСК – соответственно в 1,3 (р>0,05), 1,5 (р<0,05) и 1,9 (р<0,001) раза.
Удельный вес АГ, ИБС и ЦВБ в структуре БСК в группах наблюдения и сравнения представлен на рис. 2.
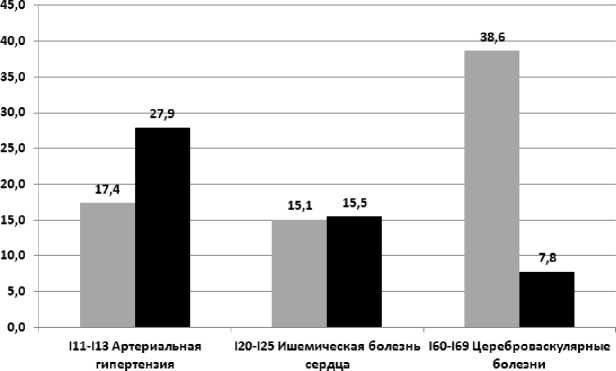
Удельный вес в структуре БСКуЛПА (1986-1988), %
■ Удельный вес в структуре БСК в группе сравнения, %
Рис. 2. Удельный вес артериальной гипертензии, ишемической болезни сердца и цереброваскулярных болезней в структуре болезней системы кровообращения у ЛПА и в группе сравнения, %.
На рис. 2 показано, что удельный вес АГ и ИБС в структуре БСК в группе сравнения соответственно в 1,6 (р>0,05) и 1,03 (р>0,05) больше, чем в группе наблюдения, тогда как удельный вес ЦВБ у ЛПА в 5,0 раз выше (р<0,01).
Частота болезней системы кровообращения, выявленных у ЛПА разных периодов участия в аварийно-восстановительных работах на ЧАЭС, представлена в табл. 4.
Таблица 4 Патологическая поражённость ЛПА болезнями системы кровообращения, участвовавших в разные периоды аварийно-восстановительных работ, на 1000 обследованных
|
Период аварийновосстановительных работ на ЧАЭС |
Класс IX БСК |
Коды диагнозов МКБ-10 |
||
|
I11-I13 АГ |
I20-I25 ИБС |
I60-I69 ЦВБ |
||
|
1986 |
726,8 (673,2; 780,3) |
183,1 (143,4; 222,7) |
158,5 (121,1; 195,9) |
390,7 (340,7; 440,7) |
|
1987 |
739,3 (670,4; 808,2) |
199,1 (145,2; 252,9) |
132,7 (86,9; 178,5) |
398,1 (332,1; 464,2) |
|
1988 |
605,3 (489,9; 720,6) |
96,5 (42,3; 150,7) |
157,9 (91,0; 224,8) |
350,9 (263,3; 438,5) |
Из табл. 4 видно, что частота заболеваний БСК среди участвовавших в аварийновосстановительных работах в 1987 г. выше, чем в периоды 1986 и 1988 гг., за исключением ИБС, частота которой, снизившись у ЛПА 1987 г. участия, выросла у ликвидаторов 1988 г. Достоверно выше по сравнению с участниками работ 1988 г. вероятность частоты заболеваний БСК у ЛПА 1986 г. участия (OR=1,73; χ²=5,53; р<0,05) и 1987 г. участия (OR=1,85; χ²=5,63; р<0,05), а также шансы заболеть АГ – OR=2,10 (χ²=4,17; р<0,05) и OR=2,33 (χ²=4,98; р<0,05) соответственно. Достоверных различий между частотой ЦВБ у ЛПА 1986 г. и ЛПА 1987 и 1988 гг. участия не установлено – соответственно OR=0,97 и OR=1,19 (р>0,05).
Распределение АГ, ИБС и ЦВБ по удельному весу в структуре БСК у ликвидаторов, принимавших участие в проведении аварийно-восстановительных работ на ЧАЭС в разные периоды, представлено на рис. 3.
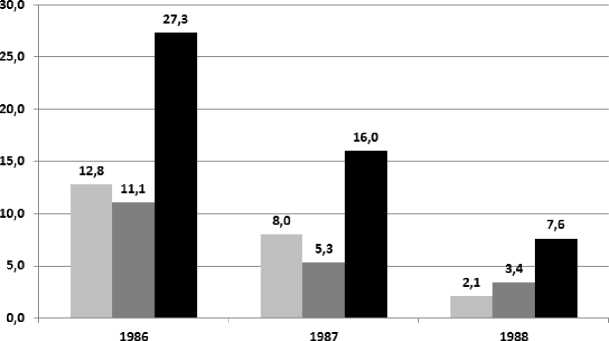
Удельный вес АГ в структуре БСКу ЛПА, % И Удельный вес ИБС в структуре БСКу ЛПА, % ■ Удельный вес ЦВБ в структуре БСКу ЛПА, %
Рис. 3. Удельный вес артериальной гипертензии, ишемической болезни сердца и цереброваскулярных болезней у ликвидаторов, принимавших участие в аварийновосстановительных работах на ЧАЭС в разные периоды, %.
На рис. 3 видно, что удельный вес АГ, ИБС и ЦВБ снижался в зависимости от периода участия ЛПА в аварийно-восстановительных работах на ЧАЭС, при этом доля ЦВБ оставалась более высокой по сравнению с АГ и ИБС, независимо от времени участия. Удельный вес ЛПА с АГ 1986 г. участия выше, чем ЛПА 1987 и 1988 гг. соответственно в 1,6 раза (χ²=9,68; р<0,01) и 6,1 раза (χ²=57,45; р<0,000), а ЛПА 1987 г. по сравнению с 1988 г. – в 3,8 раза (χ²=21,79; р<0,000). Доля ЛПА с ИБС 1986 г. участия превышает долю ЛПА 1987 и 1988 гг. участия с аналогичным заболеванием в 2,1 раза (χ²=16,67; р<0,001) и 3,2 раза (χ²=31,54; р<0,001), а ЛПА 1987 г. по отношению к ЛПА 1988 г. – в 1,6 раза (χ²=2,26; р>0,05). Доля ЛПА с ЦВБ, участвовавших в аварийно-восстановительных работах в 1986 г., в 1,7 (χ²=25,78; р<0,001) и 3,6 раза (χ²=86,49; р<0,001) превышает доли ЛПА с ИБС соответственно в 1987 и 1988 гг., доля ЛПА с ЦВБ 1987 г. участия выше, чем ЛПА 1988 г. участия с такой же патологией в 2,1 раза (χ²=18,42; р<0,001).
В ряде работ [1-7] приводятся данные о более раннем, чем в необлучённой популяции, развитии БСК и, в частности, цереброваскулярных болезней. В связи с этим выполнена сравнительная оценка возраста ЛПА и группы сравнения с диагнозами АГ, ИБС и ЦВБ. Результаты представлены на рис. 4.
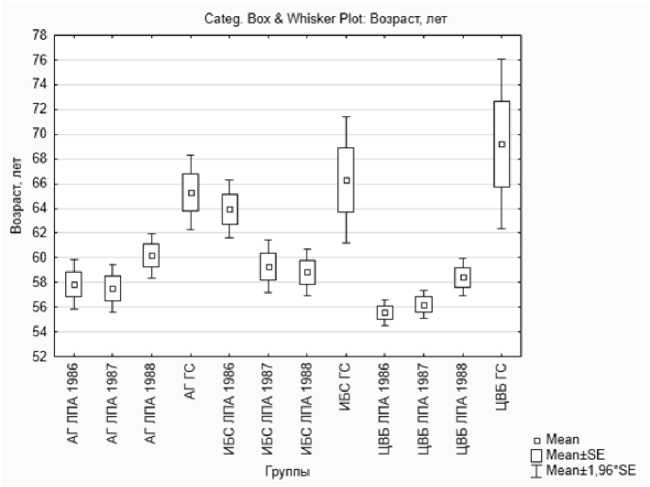
Рис. 4. Возраст ЛПА с диагнозами артериальной гипертензии, ишемической болезни сердца и цереброваскулярных болезней.
Установлено, что возраст ЛПА с БСК на 7,5 лет меньше, чем в группе сравнения (Mann-Whitney U Test p<0,001; Kolmogorov-Smirnov Test p<0,001). Сравнение возрастов ЛПА с диагнозами АГ, ИБС и ЦВБ с группой сравнения (ГС) показало, что АГ развивается на 6,1-7,8 лет раньше у ЛПА, чем в ГС, как у принимавших участие в аварийно-восстановительных работах в 1986 г. (Mann-Whitney U Test p=0,001; Kolmogorov-Smirnov Test p<0,001), так и в 1987 г. (Mann-Whitney U Test p=0,004; Kolmogorov-Smirnov Test p<0,001), и в 1988 г. (Mann-Whitney U Test p=0,41; Kolmogorov-Smirnov Test p<0,1) (рис. 4). Возраст ЛПА 1986 г. участия с ИБС всего лишь на 2,5 года (р>0,05) меньше по сравнению с ГС, но у ЛПА, участвовавших в работах в 1987 и 1988 гг., эта разница достигает соответственно 7,0 (Mann-Whitney U Test p=0,06; Kolmogorov-
Smirnov Test p≤0,025) и 7,5 (Mann-Whitney U Test p=0,13; Kolmogorov-Smirnov Test p≤0,05) лет. Наибольшая разница в возрасте выявлена у ЛПА с ЦВБ: возраст у ЛПА 1986 г. участия на 13,6 лет меньше, чем в ГС (Mann-Whitney U Test p<0,001; Kolmogorov-Smirnov Test p≤0,001), у ЛПА 1987 и 1988 гг. – соответственно на 13,0 (Mann-Whitney U Test p<0,001; Kolmogorov-Smirnov Test p≤0,005) и 10,8 (Mann-Whitney U Test p=0,004; Kolmogorov-Smirnov Test p≤0,005) лет. Полученные данные сопоставимы с результатами других исследований [1-7].
Ранняя манифестация цереброваскулярных заболеваний наблюдается не только у ЛПА, но и, в частности, у ветеранов боевых действий в Афганистане, что обусловлено воздействием факторов риска мирного периода жизни [17].
Цереброваскулярные болезни развиваются под воздействием неблагоприятных экзогенных и эндогенных факторов, среди которых выделяют неустранимые (немодифицируемые) и устранимые (модифицируемые) факторы. К первым у ЛПА относятся возраст и дозы облучения, а ко вторым – АГ и ИБС. Другие факторы риска – масса тела, курение, употребление алкоголя и др.– в данном исследовании не рассматривались.
С целью оценки влияния факторов риска на развитие сердечно-сосудистых заболеваний у ЛПА изучали ассоциативные связи этой патологии с возрастом, дозой облучения, АГ и ИБС. Результаты представлены в табл. 5.
Таблица 5 Статистические связи не модифицируемых и модифицируемых факторов риска с заболеваниями ЛПА артериальной гипертензией, ишемической болезнью сердца и цереброваскулярными болезнями
|
Факторы риска |
Заболевания |
Коэффициенты |
P < |
|
|
регрессии R |
детерминации R² |
|||
|
Артериальная гипертензия |
- 0,836 |
0,699 |
0,369 |
|
|
Возраст |
Ишемическая болезнь сердца |
0,987 |
0,975 |
0,099 |
|
Цереброваскулярные болезни |
- 0,924 |
0,854 |
0,249 |
|
|
Артериальная гипертензия |
0,997 |
0,994 |
0,049 |
|
|
Доза облучения |
Ишемическая болезнь сердца |
0,961 |
0,924 |
0,177 |
|
Цереброваскулярные болезни |
0,998 |
0,996 |
0,040 |
|
|
Артериальная гипертензия Ишемическая болезнь сердца |
Цереброваскулярные болезни |
0,989 0,980 |
0,979 0,961 |
0,092 0,125 |
Установлено, что связь артериальной гипертензии и цереброваскулярных болезней с возрастом обратная и статистически не значимая, а ишемической болезни сердца – прямая и близкая к достоверной (р<0,099). Артериальная гипертензия и цереброваскулярные болезни прямо и статистически значимо связаны с дозой облучения (табл. 5). Выявленные статистические связи АГ и ЦВБ с дозой облучения подтверждают значимость этого фактора риска в развитии сердечно-сосудистой патологии, что может быть связано с деструктивными изменениями стенок сосудов вследствие раннего развития атеросклероза [18]. Роль АГ как модифицируемого фактора в этиопатогенезе ЦВБ у ЛПА менее значима (р<0,092), чем доза облучения.
Результаты эпидемиологического анализа подтверждаются клиническими, нейровизуали-зационными и экспериментальными данными.
Клиническая симптоматика ЦВБ у ЛПА представлена цефалгическим, психоорганическим, психовегетативным, вестибуло-атактическим, эпилептиформным и астено-вегетативным синдромами, из которых чаще встречались цефалгический и психоорганический синдромы. Клини- ческая картина характеризуется преобладанием неврозоподобных состояний с астенической и астенодепрессивной симптоматикой, выраженными вегетативными и эмоциональными расстройствами, с широким спектром нейропсихологических нарушений, представляющих собой проявления психоорганического синдрома с прогредиентным течением.
Нейровизуализационное исследование методом магнитно-резонансной томографии (МРТ) выявило дисциркуляторную энцефалопатию у 75% ЛПА, участвовавших в аварийновосстановительных работах в 1986 г., и у 22% участников ЛПА 1987 г. У ЛПА 1986 г. участия в аварийно-восстановительных работах на ЧАЭС обнаружено расширение субарахноидальных пространств конвекситальных отделов больших полушарий в лобных и теменных долях, расширение периваскулярных пространств и проявления лейкоареоза. У ЛПА с психоорганическим синдромом чаще обнаруживались гиперинтенсивные очаги сосудистого характера и расширение периваскулярных пространств.
Методом рентгеновской компьютерной томографии (КТ) выявлены органические поражения головного мозга с явлениями атрофии по корковому и центральному типу, единичных и множественных очагов размягчения, обусловленных сосудистыми циркуляторными расстройствами. Методом однофотонной эмиссионной компьютерной томографии (ОФЭКТ) обнаружены гипометаболические очаги разной степени выраженности, локализованные в глубинных отделах лобных, височных, теменных и затылочных долей.
Нейрофизиологическое исследование методом электроэнцефалографии (ЭЭГ) выявило у ЛПА дезорганизацию корковой ритмики с признаками диффузной ирритации коры, наличие острых колебаний, перераспределение колебаний в отделы полушарий, не свойственные здоровому мозгу, нарушение взаимоотношений между колебаниями различных диапазонов. Наиболее характерные изменения ЭЭГ проявлялись в виде увеличения уровня биопотенциалов, особенно колебаний альфа-диапазона, перераспределения их в центрально-лобные отделы полушарий, часто с формированием своеобразного «фокуса» альфа-колебаний, имеющих меньшую частоту, по сравнению с колебаниями в затылочно-теменных областях, или колебаний тета-диапазона, с локализацией в центрально-лобных областях коры, являющихся зоной проекции диэнцефальных образований. У 50% ЛПА 1986 г. участия отмечены эпилептиформные колебания, носившие диффузный характер или проявлявшиеся в виде пароксизмальных вспышек с максимальной амплитудой в центрально-лобных областях коры больших полушарий.
При сравнении с данными ЭЭГ у здоровых людей установлено, что у них наиболее выражены колебания альфа-диапазона, максимальные по амплитуде в затылочно-теменных областях коры, колебания других диапазонов (дельта-, тета- и бета-) были незначительными по амплитуде. В состоянии покоя у 6-ти из 60 обследованных альфа-колебания по амплитуде проявлялись и в центральных областях коры, но меньше, чем в затылочно-теменных отделах. После функциональных нагрузок такое проявление альфа-ритма наблюдалось у 33,3% обследованных. Эпилептоидные формы активности у здоровых лиц не были выявлены ни в состоянии покоя, ни после функциональных нагрузок.
У больных с сердечно-сосудистыми, неврологическими и онкологическими заболеваниями эпилептиформные изменения также отсутствовали, но у отдельных из них имелись колебания в альфа- и других диапазонах и нарушения амплитудных взаимоотношений.
Сопоставление результатов исследования с литературными данными [19, 20] даёт основание полагать, что выявленные нарушения обусловлены нарушением межполушарной асим- метрии, рассогласованием взаимодействия коры и подкорковых структур с преимущественным поражением глубинных отделов головного мозга. Фактом, свидетельствующим о вовлечении в патологический процесс глубинных структур мозга, является максимальное проявление эпи-лептоидных форм активности в зоне проекции этих структур мозга.
Аналогичные результаты получены и в экспериментальном исследовании на обезьянах (Макака-резус), подвергшихся тотальному облучению в дозе 1,5 Гр. ЭЭГ-исследование выявило у облучённых обезьян патологические изменения в виде разнообразных эпилептиформных разрядов и различную мощность основных ритмов ЭЭГ в правом и левом полушариях [21]. Картирование метаболизма методом ОФЭКТ спустя 1,5 года после облучения выявило у облучённых обезьян в отличие от обезьян из группы сравнения неравномерное распределение активности липидов. Межполушарная асимметрия распределения активности липидов сопоставима по локализации с межполушарной асимметрией по данным ЭЭГ, что свидетельствуют о разной степени поражения различных отделов мозга. Выявленные изменения метаболизма липидов могут служить причиной нарушений, возникающих в мембранах нейронов или глии, что в свою очередь находит отражение в формировании пароксизмальной электрической активности мозга. Среди причин, лежащих в основе патологических изменений функций мозга, важное место занимают нарушения регионарного кровотока. Морфологические исследования мозга обезьян выявили выраженный периваскулярный отек средних и мелких сосудов, капилляров и выраженные гипоксические изменения со стороны нейронов, что дает основание охарактеризовать наблюдавшуюся гистологическую картину как дисциркуляторно-гипоксический синдром [21].
Таким образом, результаты нейровизуализационного (МРТ, КТ и ОФЭКТ) и нейрофизиологического (ЭЭГ) исследований в клинике и эксперименте свидетельствуют о ведущей роли радиационного фактора в развитии патологических изменений функций головного мозга и дисциркуляторно-гипоксического синдрома, лежащих в основе патогенеза цереброваскулярных заболеваний у ликвидаторов последствий аварии на Чернобыльской АЭС.
Выводы
-
1. Болезни системы кровообращения у ликвидаторов последствий аварии на Чернобыльской АЭС и в группе сравнения занимают первое место, но частота и вероятность заболеваний сердечно-сосудистой патологией у ЛПА значительно выше (RR=1,4 и OR=2,9; р<0,001). На втором и третьем местах находятся болезни нервной системы и новообразования, частота и вероятность заболеваний которыми сопоставима с группой сравнения. Частота заболеваний БСК у ЛПА 1986 г. и 1987 г. участия в аварийно-восстановительных работах на ЧАЭС превышала показатели 1988 г. в 1,2 раза (р<0,05), а частота АГ – соответственно в 1,9 и 2,1 раза (р<0,05).
-
2. В структуре заболеваний ЛПА доля новообразований, болезней нервной системы и БСК выше, чем в группе сравнения – соответственно в 1,3 (р>0,05), 1,5 (р<0,05) и 1,9 (р<0,001) раза. Доля ЛПА с АГ 1986 г. участия выше показателей 1987 и 1988 гг. соответственно в 1,6 (р<0,01) и 6,1 (р<0,001), а в 1987 г. по сравнению с 1988 г. – в 3,8 раза (р<0,001). Доля ЛПА с ИБС 1986 г. участия выше, чем доли ЛПА 1987 и 1988 гг. в 2,1 и 3,2 раза (р<0,001), а ЛПА с ИБС 1987 г. в сравнении с 1988 г. – в 1,6 раза (р<0,05). Доля ЛПА с ЦВБ 1986 г. участия выше, чем доли ЛПА с ЦВБ 1987 и 1988 гг. участия в 1,7 и 3,6 раза (р<0,001), а доля ЛПА с ЦВБ 1987 г. в 2,1 раза (р<0,001) выше доли ЛПА 1988 г.
-
3. Установлено, что возраст развития болезней системы кровообращения у ЛПА на 7,5 лет опережает развитие этой патологии в необлучённой группе сравнения, возраст развития АГ – на 6,1-7,8 лет. Возраст ЛПА с ИБС 1986 г. участия – на 2,5 года, а у ЛПА 1987 и 1988 гг. участия на 7 и 7,5 лет меньше, чем у необлучённых мужчин группы сравнения. Различие в возрасте между ЛПА с ЦВБ и необлучённой группой сравнения достигает у ЛПА 1986 г. участия 13,6 лет, у ЛПА 1987 г. и 1988 г. – соответственно 13 и 10,8 лет.
-
4. Из не модифицируемых факторов риска статистически значимые связи с дозой облучения установлены только у артериальной гипертензии (р<0,049) и цереброваскулярных болезней (р<0,04), связь с возрастом у этих заболеваний обратная и статистически не значимая. Среди модифицируемых факторов риска близкая к достоверной (р<0,092) связь цереброваскулярных болезней установлена только с артериальной гипертензией.
-
5. Клиническая картина цереброваскулярных болезней у ЛПА на ЧАЭС характеризуется неврозоподобными состояниями с астенической и астено-депрессивной симптоматикой, выраженными вегетативными и эмоциональными расстройствами, широким спектром нейропсихологических нарушений, представляющих собой проявления психоорганического синдрома. У ЛПА 1986 г. психопатологическая симптоматика с выраженными вегетативными и нейропсихологическими расстройствами встречается значительно чаще, чем у ЛПА 1987 и 1988 гг.
-
6. Результаты нейровизуализационного и нейрофизиологического исследования позволяют заключить, что изменения в головном мозге вызваны радиационным воздействием в малых дозах, а клинические проявления цереброваскулярных болезней вызваны нарушением межполушарной асимметрии, первичным рассогласованием взаимодействия коры и подкорковых структур с последующим поражением глубинных структур мозга, входящих в лимбико-ретикулярный комплекс с максимальным нарушением гипоталамо-гипофизарной системы, сопровождающимся диффузной ирритацией коры головного мозга.
Список литературы Клинико-эпидемиологическая оценка влияния факторов риска на развитие болезней системы кровообращения у ликвидаторов последствий Чернобыльской катастрофы
- Василенко И.Я. Радиобиологические проблемы малых доз радиации//Военно-медицинский журнал. 1993. № 3. С. 28.
- Григорьев Ю.Г., Попов В.И., Шафиркин А.В., Антипенко Ж.Б. Соматические эффекты хронического гамма-облучения. М.: Энергоатомиздат, 1986. 195 с.
- Ушаков И.Б., Давыдов Б.И., Солдатов С.К. Отдалённые последствия при условно малых дозах облучения//Медицина труда и промышленная экология. 2000. № 1. С. 15.
- Мешков Н.А., Куликова Т.А. Болезни системы кровообращения у ликвидаторов последствий аварии на ЧАЭС в отдалённом периоде//Военно-медицинский журнал. 2005. Т. 326, № 8. С. 98.
- Мешков Н.А., Куликова Т.А. Хроническая цереброваскулярная патология у ликвидаторов последствий аварии на Чернобыльской АЭС. М.: Комтехпринт, 2006. 204 с.
- Мешков Н.А. Критерии связи цереброваскулярной болезни с участием в ликвидации последствий аварии на Чернобыльской АЭС//Вестник Российской военно-медицинской академии. 2008. № 3(23), прилож. 2. Ч. 1. С. 225.
- Мешков Н.А., Куликова Т.А., Фокеева М.В. Эффективность лечения сердечно-сосудистой патологии у ликвидаторов последствий аварии на Чернобыльской атомной электростанции//Радиация и риск. 2011. Т. 20, № 3. С. 47-57.
- Никулин А.В., Грибачева И.А., Дергилев А.П. Клинические и нейровизуализационные особенности дисциркуляторной энцефалопатии у ликвидаторов последствий аварии на Чернобыльской АЭС в отдалённом периоде//Консилиум. 2004. № 9. С. 28-33.
- Иванов В.К., Максютов М.А., Чекин С.Ю., Петров А.В., Цыб А.Ф., Бирюков А.П., Круглова З.Г., Матяш В.А. Риски цереброваскулярных заболеваний среди ликвидаторов аварии на ЧАЭС//Радиационная биология. Радиоэкология. 2005. Т. 45, № 3. С. 261-270.
- Иванов В.К., Горский А.И., Чекин С.Ю., Кочергина Е.В., Карпенко С.В. Радиационно-эпидемиологическая классификация заболеваемости и смертности ликвидаторов от цереброваскулярных заболеваний методами кластерного анализа и главных компонент//Радиация и риск. 2014. Т. 23, № 4. С. 8-21.
- Живолупов С.А., Самарцев И.Н. Современный клинический анализ цереброваскулярных заболеваний: узловые вопросы дифференциальной диагностики и патогенетического лечения//Фарматека. 2012. № 7. С. 87-94.
- Зволинская Е.Ю., Александров А.А. Оценка риска развития сердечно-сосудистых заболеваний у лиц молодого возраста//Кардиология. 2010. Т. 50, № 8. С. 37-47.
- Машин В.В., Белова Л.А., Сапрыгина Л.В., Кравченко М.А., Варакин Ю.Я., Гнедовская Е.В., Суслина З.А. Факторы риска сосудистых заболеваний головного мозга по данным скрининга популяции среднего возраста г. Ульяновска//Анналы клинической и экспериментальной неврологии. 2014. Т. 8, № 1. С. 4-9.
- Кваша Е.А., Смирнова И.П., Горбась И.М., Давыденко Н.В., Воликов В.Г. Эпидемиология цереброваскулярной патологии в Украине. По данным 20-летнего исследования (материалы научно-практической конференции «Артериальная гипертония и ассоциированная сосудистая патология (гериатрические аспекты)». Киев, 8-9 октября 2008 г.)//Проблемы старения и долголетия. 2002. Т. 11, № 3. С. 302-303.
- Пимбурский В.Ф. Болезни системы кровообращения у военнослужащих-участников ликвидации последствий чернобыльской катастрофы: автореф. дис.. канд. мед. наук. СПб., 2005. 28 с.
- Международная статистическая классификация болезней и проблем, связанных со здоровьем. Десятый пересмотр. Официальное русское издание. В 3-х т. Женева: ВОЗ, 1995.
- Альтман Д.Ш. Клинико-иммунологические особенности ранних форм хронических цереброваскулярных заболеваний и темп старения участников современных военных конфликтов: автореф. дис.. канд. мед. наук. Челябинск, 2006. 54 с.
- Мироненко Т.В., Торба К.В., Пицул Н.Л., Тачко Г.П., Никитина Е.В., Василенко В.Н. Клинические особенности мозговых инсультов у ликвидаторов последствий аварии на ЧАЭС//Международный неврологический журнал. 2007. № 2. С. 39-47.
- Болдырева Г.Н. Межцентральные отношения в коре головного мозга человека в норме и при очаговом поражении диэнцефальных структур: автореф. дис. … докт. мед. наук. М., 1978. 34 с.
- Батищева Е.И. Характеристика клинико-неврологических доплерографических и компьютерно-томографических изменений у ликвидаторов последствий аварии на Чернобыльской АЭС с пароксизмальными вегетативными нарушениями: дис. … канд. мед. наук. М., 2006. 130 с.
- Мешков Н.А., Рыжов Н.И., Федорова Н.Л., Кузнецова Г.Д., Холодова Н.Б. Отдалённые последствия радиационных воздействий на неврологический статус организма (клинико-экспериментальное исследование)//Военно-медицинский журнал. 1993. Т. 314, № 4. С.70-73.


