Клинико-молекулярные аспекты муцинозных опухолей яичников: этиопатогенез, индивидуализация лечения
Автор: Кедрова Анна Генриховна, Леваков Сергей Александрович, Шабловский Олег Радомирович, Ванке Никита Сергеевич, Нечаева О.В., Максименко Т.А.
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 3 (3), 2010 года.
Бесплатный доступ
Для определения прогноза и оценки факторов, влияющих на подбор индивидуального лечения, ретроспективно проанализировано 34 истории болезни пациенток с муцинозными опухолями яичников (МОЯ), имеющих высокий риск развития псевдомиксомы брюшины. Выявили, что МОЯ имеют клинические, биохимические и гистоиммунохимические особенности, позволяющие прогнозировать риск рецидива и индивидуализировать лечение.
Маркеры муцинозных опухолей яичников, раковый антиген (са19, раковоэмбриональный антиген (рэа)
Короткий адрес: https://sciup.org/14338331
IDR: 14338331
Текст научной статьи Клинико-молекулярные аспекты муцинозных опухолей яичников: этиопатогенез, индивидуализация лечения
В течение нескольких лет имеет место дублирование работ, направленных на обнаружение наиболее эффективных программ диагностики и лечения опухолей яичников (ОЯ). Разочаровывающие результаты общей выживаемости больных раком яичников (РЯ) после современной стандартной терапии даже при оптимальной циторедуктивной операции заставляют искать новые пути совершенствования и индивидуализации лечения. В этом помогают уже известные факторы прогноза, которые подразделяются на несколько больших групп.
Опухолевый фактор включает распространенность, гистологический тип, степень инвазии, дифференцировки и плоид-ность опухоли.
Лечебные факторы можно подразделить на хирургический, включающий радикальность операции, ее объем и травматичность, и лекарственный, зависящий от чувствительности опухоли к химиотерапии.
Биохимические факторы — маркеры, определяемые в сыворотке крови или асцитической жидкости: раковые антигены (СА-125, СА 19,9), секреторный белок 4 эпидидимиса (HЕ), хорионический гонадотропин (ХГ), раково-эибриональный антиген (РЭА), альфа-фетопротеин (АФП), ингибин В.
Молекулярные факторы , определяемые непосредственно в опухоли, экспрессия поверхностных антигенов, выявленных с использованием моноклональных антител, гистоиммунохимический метод: CD 7, CK20, CA-125, эстрогеновые и прогестероновые рецепторы (ER/PR), сосудистые факторы роста (VEGF), эпидермальные факторы роста (EGF), ген аппо-птоза p53, ингибитор транскрипции, ген WT1 (от Wilms' tumor 1), и др.
Иммунологические факторы – это опу-холь-инфильтрирующие лимфоциты — (TIL), количественный и качественный состав лимфоцитов в асцитической жидкости, лимфоциты с активационным антигеном HLA-DR, NK-клетки, с молекулами адгезии (CD56+ CD3-).
В совокупности указанные факторы должны учитываться для определения прогноза заболевания и выбора адекватного лечения. Одним из недостаточно изученных типов эпителиальных новообразований яичников являются муцинозные опухоли, диагностика и лечение которых имеет свои особенности. Их частота, как правило, не превышает 10% среди эпителиальных новообразований яичников, а анализ анамнестических данных показал, что из экстрагенитальной патологии, располагающей к их возникновению, можно отнести ожирение, сахарный диабет, заболевания щитовидной железы. Также в анамнезе у больных зафиксированы высокая частота хронических воспалительных процессов гениталий, позднее менархе, заболевания ЖКТ, печени, поджелудочной железы, курение [1]. Проблемы точной дооперационной диагностики муцинозных опухолей связаны с отсутствием или малой информативностью клинических и диагностических критериев на этапе полного предоперационного обследования больной (табл. 1).
По данным кооперированных исследований, правильная дифференциальная оценка новообразований яичников возможна у 71% больных [2], а при муцинозных опухолях чувствительность ультразвукового метода составляет 83,3%, при положительной диагностической значимости 93,8% и точности 78,9% [3]. Такие многокамерные опухоли обязательно содержат кистозный эхогенный компонент с несколькими участками усиления локального кровоснабжения при наличии шероховатостей или утолщений на внутрикапсуль-ных перегородках (рис. 1) с индексом резистентности артериальных сосудов (ИР) в диапазоне от 0,51 до 0,7 (медиана 0,52).
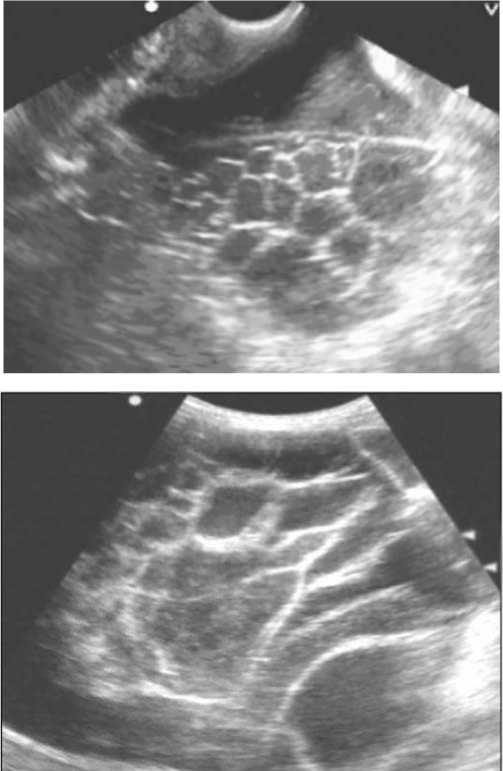
Рис.1. Многокамерная опухоль с перегородками различной толщины. Муцин визуализируется в виде эхогенных включений точечной, линейной или неправильной формы.
Таблица 1
Унифицированный объем обследования для определения тактики лечения и выбора объема операции при подозрении на рак яичников
|
Первичный осмотр гинеколога |
-осмотр шейки матки и влагалища в зеркалах,
|
|
Первичные вспомогательные методы обследования |
-УЗТ органов брюшной полости и забрюшинного пространства |
|
Биохимические методы |
-определение уровня маркеров СА-125, HE4, Са-19,9 -определение биохимических и клинических показателей крови и мочи |
|
Радиодиагностические методы для оценки состояния смежных органов и систем |
-ирригоскопия, гастроскопиия, цистоскопия,
|
|
Функциональная оценка |
-ЭКГ, спирометрия, консультация терапевта |
|
Дополнительные, уточняющие методы диагностики |
- КТ, МРТ, ПЭТ, в/в урография, лапароскопия, сканирование костей скелета |
Уровень маркера СА-125 мало показателен, так как часто не превышает дискретного значения (30 МЕ/мл), а вот концентрации CA-19,9 и РЭА повышены у 6578% больных (среднее значение 230 МЕ/мл; диапазон 49-472 МЕ/мл) [4, 5, 6]. Основным параметром прогноза остается стадия заболевания, но даже при прочих равных условиях разброс в 5-летней выживаемости при I-II стадиях составляет от 50 до 90% [7, 8]. Это связано как с наличием ошибок при хирургическом стадиро-вании, так и с неадекватностью последующей терапии, при этом огромную роль имеют биологические особенности опухоли [9]. Например, сравнительная характеристика серозных и муцинозных опухолей показала, что среди доброкачественных и пограничных ОЯ процентное соот- ношение муцинозных несколько выше (15-30%), чем при РЯ (до 10%), что связано с их меньшей агрессивностью и медленным ростом [10]. Однако они часто достигают крупных размеров (рис. 2 a, б), содержимое капсулы опухоли обязательно содержит слизь и муцин (рис. 3) за счет внутриклеточного слизеобразования.
Муцин располагается в клетках в виде мелких капелек и выявляется при окраске муцикармином, альциановым синим или IIIИК-методом. Наряду с указанным эпителием можно обнаружить кубический, местами уплощенный, а в отдельных наблюдениях и цилиндрический, трубного типа (рис. 4).
Поверхность муцинозной цистаденомы покрыта низким цилиндрическим эпителием, подлежащая строма образована
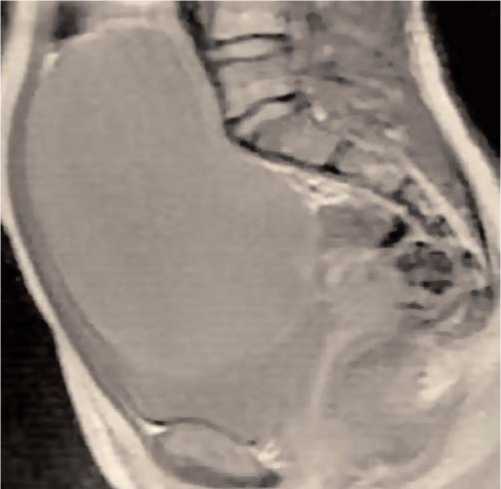
Рис. 2а. МРТ. Муцинозная цистаденома яичника
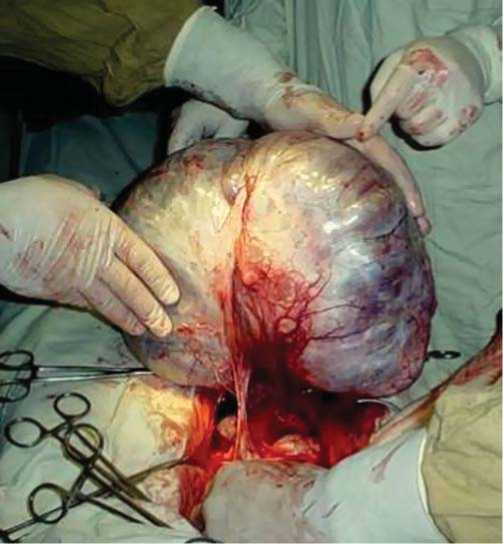
Рис.2б. Муцинозная цистаденома яичника. Макропрепарат.
высоким призматическим эпителием со светлой цитоплазмой, что напоминает эпителий цервикальных желез или кишечный тип, в связи с чем выделяют интестинальный тип опухоли (рис. 5) или цервикальный.
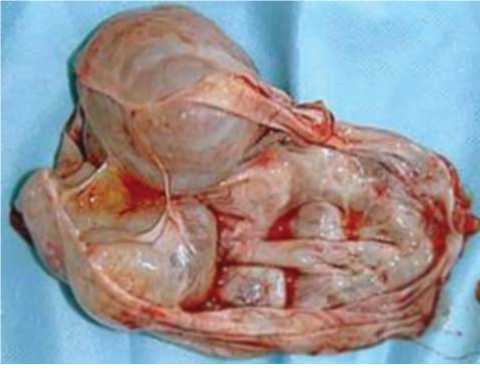
Рис. 3. Вскрыта одна из камер муцинозной опухоли яичника.
Как правило, клетки муцинозных опухолей яичников имеют минимальный по- лиморфизм и невысокую митотическую активность, индекс пролиферации не превышает 10,5% [11].
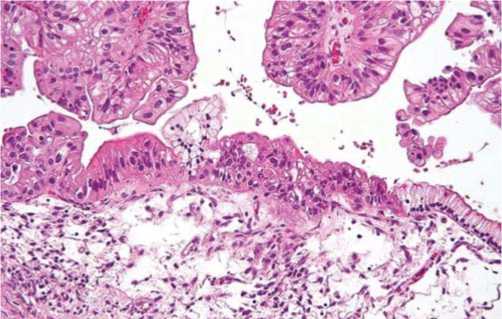
Рис 4. Муцинозная цистаденокарцинома. Гистологические критерии: дезорганизация структуры, выраженная стратификация эпителия, сосочки, микроккисты, некрозы, железисто-трубчатые и криброзные комплексы клеток с формированием аденоматозных структур.
Однако при нарушении целостности муцинозного образования возникает серьезное осложнение – асцит, а в некоторых случаях – псевдомиксома брюшины (рис.6) [12].
Подход к хирургическому лечению муцинозных опухолей яичников должен быть радикальным и малотравматичным, выполняться из срединного разреза для снижения риска вскрытия капсулы образования и соответствовать всем правилам операций при новообразованиях с высоким риском малигнизации (рис. 7).
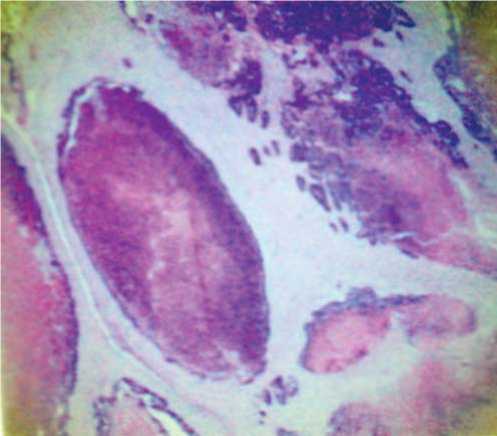
Рис. 5. Муцинозная цистаденокарцинома, метастатическая (интестинальный тип). Критерии: инфильтрация, повышенное слизеобразование, наличие поверхностных инмплантов, сегментарные некрозы в железистом эпителии.
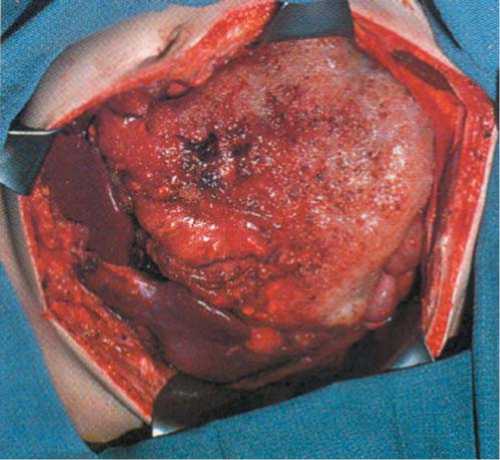
Рис. 6. Псевдомиксома брюшины (код МКБ-10: М8486/6-C78.6) осумкованная слизь в полости, выстланной эпителием, частично замещенным соединительной тканью, которая распространяется по висцеральной брюшине.
У молодых женщин, желающих сохранить фертильность, допустимо выполнение односторонней сальпингоофорэкто-мии при муцинозном раке яичников Iа стадии, но этот подход увеличивает риск рецидивирования на 5-8% [13, 14]. Разви- тие отсроченных рецидивов заболевания (через 3-7 лет) показывает отсутствие необходимости в адъювантной химиотерапии и возможности для выполнения органосохраняющих операций с ранней беременностью после них (на первом году) [15]. С учетом всех данных необходимо подчеркнуть, что операция должна выполняться онкогинекологом в специализированном стационаре. При наличии выраженного спаечного процесса в брюшной полости и невозможности выполнить тщательную ревизию стадию заболевания завышают, так как у 30-35% больных с начальным РЯ, первично оперированных в неспециализированных стационарах, повторное стадирование онкогинекологами привело к изменению стадии [16, 17].
Окончательный диагноз и прогноз устанавливают после удаления опухоли и ее гистологического, а иногда и гистоимму-нохимического иследований (табл. 2).
Согласно современной клинико-гистологической классификации ВОЗ (2007 г.), муцинозные опухоли яичников разделены на 3 группы:
-
1. Доброкачественные (коды 8470/0, 9015/0): а) цистаденома; б) аденофиброма и цистаденофиброма.
-
2. Пограничные (интестициальные или цервикальные тип): M8472/3 – муцинозная цистаденома пограничной злокачественности; M8473/3 – папиллярная муцинозная цистаденома пограничной злокачественности; M9015/3 – муцинозная аденофиброма пограничного типа. ИЛИ
- - не инвазивные (только внутриже-лезистые или внутриэпителиальные изменения); - с инвазией, мало отличаются от высокодифференцированной карциномы.
-
3. Злокачественные первичные и метастатические (желудок, аппендикс, поджелудочная железа, желчевыводящие протоки, шейка матки, эндометрий, молочная железа). Коды 8480/3, 8470/3, 9015/3: аденокарцинома, цистаденокарцинома, аденокарцинофиброма, цистаденокарци-нофиброма.
Выделить первичное поражение и метастатическое при муцинозных опухолях достаточно трудно, в этом помогают данные операционных находок при тщательной ревизии органов брюшной полости.
Определение степени дифференцировки злокачественных муцинозных опухолей опирается на два показателя: строение и степень ядерной атипии (укрупнение ядер, агрегация и конденсация хроматина, появление эозинофильных ядрышек). Эти критерии часто достаточно субъективны.
Микроскопически можно выделить ки-шечно- и эндоцервикальноподобную неоплазию. Необходимый учет митозов бывает крайне затруднительным из-за вариабельности митотической активности, которая зависит от выбранного участка опухоли и изменяется при прогрессировании. В связи с этим оценка соотношения зрелых и незрелых элементов зависит от количества исследуемых участков, а усредненные значения приводят к большому числу заключений с «умеренной дифференцировкой» (G2, 3).
Гистоиммунохимический анализ и определение геномных нарушений методами ДНК/FISH-гибридизации, РНК/ISH или протеомным анализом белков (IHC), детерминирующих развитие опухоли, являются приоритетной областью современных молекулярно-генетических исследований, так как позволяют выделить особенности в пределах одного из подтипов РЯ (табл. 2). Такой подход необходим для индивидуализации лечения [18, 19]. Молекулярными маркерами будут являться гены семейства KRAS (CK20), типичные для колоректального и муцинозного рака яичников. Мутации же гена р53 не типичны для муцинозных опухолей, но очень часто встречаются при серозном РЯ [19].
Прогноз при муцинозных новообразованиях благоприятный, например, при Iа стадии и пограничной муцинозной опухоли общая выживаемость составляет 99,5%. Из особенностей их лечения необходимо отметить отсутствие данных о преимуществе комбинированного подхода при начальных стадиях, т.е. химиотерапия
Таблица 2
Муцинозный рак. Гистоиммунохимическое исследование.
|
Маркеры опухоли |
Муцинозный РЯ |
Серозный РЯ |
Колоректальный |
Апендикс |
Желудок |
Поджелудочная железа |
|
CK7 |
+ |
+ |
- |
(-) |
+ |
+ |
|
CK20 |
(+) |
- |
+ |
+ |
(+) |
+ |
|
C-125 |
0 |
+ |
- |
- |
- |
- |
|
РЭА |
+ |
(-) |
+ |
+ |
+ |
± |
|
ER/PR |
- |
+ |
- |
- |
- |
- |
|
WT* |
- |
+ |
- |
- |
- |
- |
|
+ -обычно присутствует; - обычно отсутствует; (+) часто присутствует; (-) -часто отсутствует *WT – маркер опухоли Вильмса, выявляется в большинстве случаев при + Са-125 и CD 34, т.е. может быть использован для идентификации как эндотелиальных клеток (CD34 +), так и опухолевых клеток с экспрессией СА-125. |
||||||
1.Срединная лапаротомия, взятие смывов с брюшины малого таза, латеральных каналов, поверхности диафрагмы, печени.
При подозрении на диссеминацию РЯ производится биопсия измененных участков.
2. Удаление матки с придатками и экстирпация большого сальника.
При органосохраняющих операциях – удаляется весь измененный яичник, б. сальник и производится резекция контрлатерального яичника.
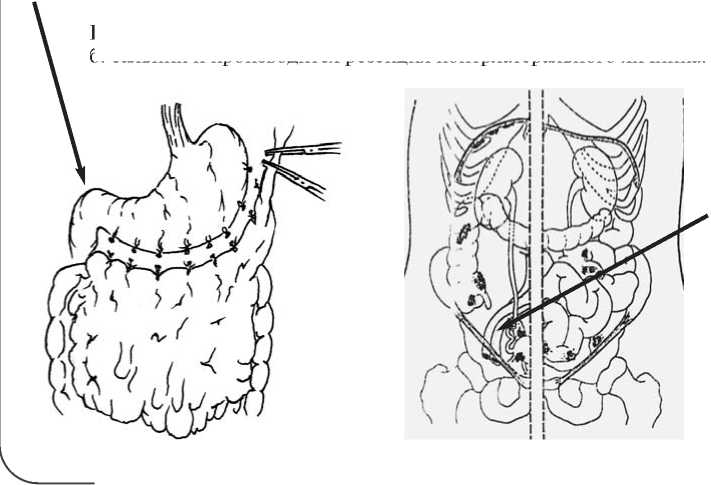
3. Тщательная ревизия органов брюшной полости и забрюшинных лимфатических узлов, при их увеличении выполняется лимфаденэктомия.
При муцинозных опухолях целесообразно выполнить аппендэктомию [Bristow R., Karlan B. // Surgery for Ovarian Cancer.
2006 UK]
Рис. 7. Хирургические правила при новообразованиях яичников может дополнять операцию только при III-IV стадии заболевания или при высоком риске развития псевдомиксомы брюшины. В этих случаях особую роль отводят внутрибрюшинному введению препаратов платины [20]. По мнению ряда авторов, высокая летальность при РЯ обусловлена не только поздней диагностикой заболевания, но и недостаточным применением наиболее эффективных комбинированных и комплексных методов лечения. Муцинозный РЯ часто характеризуется стойкой рефрактерностью к базовой пла-тино/циклофосфан и платино/таксаны химиотерапии, что связано с его «плохим прогнозом» при распростаненных стадиях. При этом после полной хирургической резекции опухоли применение схемы «платина/иринотекан» показало лучшие результаты лечения [21].
Материалы и методы.
За 2008-2010 гг. нами отобраны 34 больных (табл. 3) с муцинозной цистаденокар- циномой яичника, интестинальный тип. У всех больных имелся повышенный риск развития псевдомиксомы брюшины, т.к. визуализировалось прорастание капсулы опухоли с ее вскрытием до операции или хирургическая микроперфорация, связанная с выраженным спаечным процессом в брюшной полости. Во всех случаях операцию выполняли в стандартном объеме: экстирпация матки с придатками, удаление большого сальника с тщательной ревизией органов брюшной полости и забрюшинного простанства. Апендектомия выполнена в 3 наблюдениях из-за наличия визуальных изменений в червеобразном отростке. Последующую химиотерапию начинали с внутрибрюшинного введения цисплатина 100 мг/м2 на 8-12-е сут после операции. Катетер для данного введения устанавливали во время операции и удаляли после введения препарата. Следующие курсы проводили 1 раз в 3 нед., в/в по схемам: паклитаксел 175 мг/м2 + карбоплатин AUC 6 или
Таблица 3
|
Характеристики |
Число пациенток(%) |
|
Гистологический тип Муцинозная цистаденокарцинома |
34(100%) |
|
FIGO стадия |
|
|
I |
6 (17,6%) |
|
II |
8 (23,6%) |
|
III |
19(55,9%) |
|
IV (подкапсульные метастазы в печени) |
1 (2,9%) |
|
Дифференцировка опухоли |
|
|
Пограничный тип или высокая степень (G1) |
13 (38,2%) |
|
Умеренная дифференцировка G2 |
15 (44,2%) |
|
Низкая дифференцировка G3 |
6(17,6%) |
|
Возраст от 40 до 50 лет |
4 (11,8%) |
|
От 50 до 60 лет |
22 (64,7%) |
|
Старше 60 |
8 (23,6%) |
|
Остаточная опухоль в см |
16 (47,5%) |
|
< 1 |
11 (32,4%) |
|
>1 |
7(20,6%) |
|
СА125 в пределах нормы (34 МЕ/мл) |
18 (52,9%) |
|
< 500 МЕ/мл |
(38,2%) |
|
>500 МЕ/мл |
3 (8,9%) |
|
Са -19,9 в пределах нормы (до 37 МЕ/мл) |
6 (17,6%) |
|
<500 МЕ/мл |
12 (35 ,3%) |
|
>500 МЕ/мл |
16 (47,1%) |
|
РЭА в пределах нормы (до 10 нг/мл) |
19 (55,9%) |
|
От 11 до 30 нг/мл |
8 (23,5%) |
|
>30 нг/мл |
7 (20,6%) |
|
Исходы после комбинированного лечения (продолжительность наблюдения от 8 до 24 мес. |
|
|
Полная регрессия (с нормализацией маркера) |
25 (73,5% ) |
|
Частичная регрессия |
6 (17,6% ) |
|
Прогрессирование |
3 (8,8% ) |
Клиническая характеристика больных муцинозной карциномой яичников
иринотекан 120 мг/м2 1 день + цисплатин 70 мг/м2. Различное сочетание повышенных маркеров сыворотки не увеличивало информативность дооперационной диагностики, так как у 5 пациенток с муцинозной аденокарциномой пограничного типа были значительно повышены маркеры СА-19,9 или РЭА, а у 4 больных с муцинозным РЯ III стадии показатели превышали дискретные значения всего на 10-15%. Основная цель определения уровня маркеров – мониторинг заболевания и оценка эффективности терапии. Сочетание повышения РЭА и СА 19,9 не является специфичным для опухолей яичников и не применяется в скрининге, но при муцинозном РЯ они были повышены у 28 (82,3%) больных, что давало возможность контролировать эффективность лечения и активность опухоли. Например, после радикальной операции уровень СА 19,9 нормализовался у 9 (32,1%) пациенток и еще у 8 (28,6%) больных – после дополнительных 2-3 курсов химиотерапии.
Обращало на себя внимание то, что иногда при выраженном клиническом и биохимическом эффекте (схема с иринотеканом) объективные ультразвуковые данные показывали регрессию лишь спустя 2-3 мес., а динамика уровня маркеров, повышенных до операции, точно коррелировала с эффективностью лечения, оцениваемой по клиническому статусу.
Обсуждение
Еще один вопрос, часто волнующий клиницистов, связан с морфологической диагностикой муцинозных новообразований яичника, так как участки муцинозной карциномы часто присутствуют в погра-
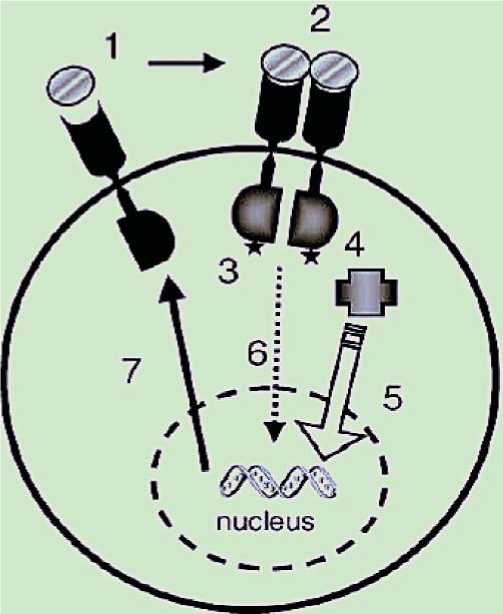
-
1 – строительство лиганда (препараты антагонисты рецепторов – панитумумаб или антитела)
-
2 – димеризация рецептора (ингибиторы димеризации?)
-
3 – процесс фосфорилирования (ингибиторы киназного пути)
-
4 – белки-адапте ры (ингибиторы активности)
-
5 – сигнальная тр анс дукция (киназные ингибиторы, ras. Сорафениб, сунитиниб)
-
6 – транслокация генов (ингибиторы?)
-
7 – биосинтез ДНК-генная терапия)
Рис.8. Узконаправленная терапия – шаг в будущее.
Ген KRAS: участвует в трансдукции сигнала; активируется в том числе и сигналами от рецепторов эпидермальных факторов роста (EGFR); стимулирует синтез белков, вовлечённых в процессы пролиферации и ангиогенеза; играет роль в прогрессии опухоли.
Для определения требуется парафиновый блок с образцами опухоли пациентки.
Метод диагностики – секвенирования ДНК (ПЦР).
ничных опухолях хаотично, для выявления таких очагов необходимо выполнять большое число срезов из разных участков опухоли и иметь мнение двух-трех опытных морфологов. В некоторых случаях для дифференциального диагноза первичного или вторичного поражения, а также для индентификации рака в пограничной опухоли необходимо выполнять гистоим-мунохимическое исследование со строго специфическим маркером галектином 4 (LGALS4) и Mac 2 [19, 24].
Таким образом, муцинозные опухоли яичников имеют отличительные особен ности: могут развиваться из яичниковых инклюзионных кист при дикой мутации гена KRAS, проходят стадии развития через опухоль пограничного типа с исходом в прогрессирование в инвазивную форму или в карциному различной степени дифференцировки. Изучение генного профиля опухоли позволит определить не только путь канцерогенеза, но и подобрать высокоспецифическую терапию (рис. 8) для каждой конкретной больной, что приведет к лучшим отдаленным результатам.
На сегодняшний день такие препараты могут вызвать стойкую стабилизацию заболевания и возобновлять чувствительность к препаратам платины, но, к сожалению, пока не приводят к полной регрессии опухоли.
Список литературы Клинико-молекулярные аспекты муцинозных опухолей яичников: этиопатогенез, индивидуализация лечения
- Teramukai S., K. Ochiai, H. Tada, et.al. A new prognostic index of advanced epithelial ovarian cancer (PIEPOC): A JMTO OC01-01 study//ASCО 2006, abs. 5061.
- Pecorelli et.al. Staging Classification and clinical practice Guidelines for Gynacological Cancer. A collaboration between FIGO and IGCS 2006, Kuala Lumpur, FIGO.
- Чекалова М.А., Шабанов М.А., Поддубная И.В., Горелова И.А. Ультразвуковая диагностика муцинозных новообразований яичников//Ультразвуковая и функциональная диагностика. 2006. № 2. С. 39-47.
- Liu P., Moon J., Alberts D.S. et al. A modified CA-125 progression criterion in ovarian cancer (OC) patients (pts) receiving maintenance treatment following complete clinical response (cCR) to primary therapy//ASCO 2006, abs.5080.
- Tanabe H., Katsumata N., Matsumoto K. et.al. CA125 nadir as a prognostic factor in advanced ovarian carcinoma: A retrospective study of 84 patients achieving clinical CR//ASCO 2006, Abs. 5007.
- Nadal R.M., B. M. Ojeda, V. Artigas, et.al. Stratification of the normal range of CA125 after chemotherapy as a predictive factor in carcinoma of the ovary//ASCO 2006, abs. 5059.
- Aabo K., Adams M., Adnitt P. et al. Chemotherapy in advanced ovarian cancer: four systematic meta-analyses of individual patient data from 37 randomized trials. Advanced Ovarian Cancer Trialists Group//Br. J. Cancer. 1998; 78: 1479-87.
- Berek J.S., Bertelsen K., du Bois A. et al. Epithelial ovarian cancer: 1998 consensus statements.//Ann. Oncol. 1999. 10 Suppl 1: 87-92.
- Hoskins W.J. Surgical staging and cytoreductive surgery of epithelial ovarian Cancer//Cancer. 1993;71: 1534-1540.
- Горелова И.А.//Муцинозные опухоли яичников различного потенциала злокачественности. Автореф. на соиск. степ. канд. мед. наук. 2008. Москва.
- Yamao K., Yanagisawa A., Takahashi K. Clinicopathological Features and Prognosis of Mucinous Cystic Neoplasm With Ovarian-Type Stroma: A Multi-Institutional Study of the Japan Pancreas Society//Pancreas. 2010 Sep 29.
- Schmuck R.B., Pietzner K., Buckendahl A. Cervical manifestation of a borderline type ovarian cancer with pseudomyxoma peritonei -a case report//Anticancer Res. 2010. Jul; 30(7):2991-4.
- Piver S.M. Optimal surgical therapy in stage I-II ovarian malignecies//Int. J. Radiat Oncol. Biol. Phys. 1982; 8: 247-249.
- Landoni F., A. Maggioni, T. Dell'anna et.al. Randomized trial of systematic lymphadenectomy (LY) vs nodal sampling (SA) at second look surgery (SLS) in ovarian cancer patients: Final results.//ASCO 2006, Abs.5068.
- Young R.C., Brady M.F. Randomized Clinical Trial of adjuvant treatment of women with early (FIGO I-IIa high risk) ovarian cancer -GOG Proc.//ASCO 1999:18: 357a.
- Bagley C.M., Young R.S., Schein P.S. Ovarian carcinoma metastatic to the diaphragm -frequently undiagnosed at laparotomy//Am. J. Obstet Gynecol. 1973, 116: 397-400.
- Харитонова Т.П., Поддубная И.В., Мартынова Ж.А. и соавт. Оптимизация лечения распространенного рака яичников//Врач. 2008. № 8. С. 35-36.
- Tang L., Yang J., Ng S.K., Rodriguez N. Autoantibody profiling to identify biomarkers of key pathogenic pathways in mucinous ovarian cancer//Eur. J. Cancer. 2010 Jan;46(1):170-9.
- Heinzelmann-Schwarz V.A., Gardiner-Garden M., Henshall S.M. A distinct molecular profile associated with mucinous epithelial ovarian cancer//Br. J. of Cancer. 2006. 94, 904-913.
- Bolis G., Colombo N., Pecorelli S. Adjuvant treatment for early epithelial ovarian cancer: results of two randomised clinical trials comparing cisplatin to no further treatmant or chonic phosphate (32P) G.I.C.O.G.//Ann. Oncol. 1995: 6: 887-93.
- Wamunyokoli F.W., Bnome J.Y., Lee C.M. Expression profiling of mucinous tumor of theovary indentify genes of clinic-pathologic impotance//Clin. Cancer Res. 2006, 12(3P). P. 690-700.
- Nomura Kouichi, Shigeo Aizawa, Hiroshi Hano. Ovarian mucinous border-line tumors of intestinal type without intraepithelial carcinoma: Are they still tumors of low malignant potential?//Pathology International, June 2004, Vol. 54, Issue 6. P. 420-24.
- Kolomainen D.F., A'Hern R., Coxon F.Y. et. al. Can patients with relapsed, previously untreated, stage i epithelial ovarian cancer be successfully treated with salvage therapy?//J. Clin. Oncol. 2003. Vol. 21, Issue 16: 3113-18.
- Lee J.H., Zhang X., Shin B.K., Lee E.S. Mac-2 binding protein and galectin-3 expression in mucinous tumours of the ovary: an annealing control primer system and immunohistochemical study//J. Pathology. 2009;41(3):229-33.


