Клинико-морфологические аспекты регенерации линейных ран в эксперименте
Автор: Файзуллина Н.З., Валеева А.Н., Шоркина О.И.
Статья в выпуске: 3 т.219, 2014 года.
Бесплатный доступ
Применение препарата «Ангиоген» в процессе заживления ран на ранних этапах сопровождается ускорением сроков заживления с формированием соединительной ткани в раневой щели и более ранней эпителизацией поверхности дефекта; предотвращением развития осложнений в виде воспалительной клеточной инфильтрации с деструкцией ткани и наличием очагов некроза. Подобный эффект реализуется за счет улучшения кровоснабжения с увеличением количества вновь образованных сосудов непосредственно в операционной ране, а также активации микроциркуляторных процессов в близлежащих тканях.
Крыса, кожная рана, ангиоген
Короткий адрес: https://sciup.org/14288342
IDR: 14288342 | УДК: 619:615.038-092:591.8:577.99
Текст научной статьи Клинико-морфологические аспекты регенерации линейных ран в эксперименте
В настоящее время уделяется большое внимание разработке лекарственных веществ, которые могли бы оптимизировать процессы репаративной регенерации, воздействуя непосредственно на очаг поражения и не оказывающих отрицательного влияния на организм в целом [1]. Это и послужило основанием для создания нового лекарственного препарата «Ангиоген» и проведение исследований по оценке его действия в рамках доклинических испытаний.
Целью исследований явилось изучение влияние препарата Ангиоген на заживление линейных ран у крыс в эксперименте.
Материалы и методы исследований. В эксперименте использовались 18 нелинейных белых крыс самцов, живой массой 300-350 г. Животные были разделены на 2 группы – контрольную и опытную, по 9 в каждой. В области пояснично–крестцового отдела проводили линейный полнослойный разрез кожи и подкожной клетчатки, длиной 4,5-5 см, при введении 2 % -го раствора рометарав дозе 0,2 мл/100г массытела животного. Накладывали 4-5 прерывистых узловатых шва.
Контрольная группа – сразу после операции и далее 1 раз в день животным подкожно вводили физиологический раствор в дозе 0,1 мл/100 г веса в двух точках на расстоянии 1 см от края в проксимальном и дистальном участках разреза в течение 6 дней.
Опытная группа - после операции и далее 1 раз в день животным вводили Ангиоген подкожно в дозе 0,1 мл/100 г веса по идентичной схеме. Наружная обработка ран у животных обеих групп не проводилась.
Были использованы клинический и морфологический методы исследований. При проведении клинического метода учитывали состояние животных и операционной раны на 3, 5, 7, 10 сутки после операции, скорость и степень эпителизации.
Для поведения морфологических исследований по 6 животных (по 3 из каждой группы) выводили из эксперимента на 3, 7, 10 сутки.
Отбор проб кожи, подкожной клетчатки и частично мышц проводили из трех точек – проксимальный и дистальный края раны (рубца) и средняя часть раны.
Подготовку гистопрепаратов проводили по стандартной методике и окрашивали гематоксилином и эозином, по методу Ван Гизона [2,3].
Площадь кровеносных сосудов определяли в процентах от общей площади гистологического среза. Подсчет был проведен при помощи морфометрической сетки случайного шага [4]. На каждом препарате просматривали не менее 20-40 полей зрения.
Результаты исследований. Послеоперационный период у подопытных животных протекал без осложнений, операционные раны заживали по первичному натяжению. Однако, в единичных случаях у крыс контрольной группы отмечался диастаз, занимающий 20-50% от длины раны. Подопытные крысы переносили введение препарата без признаков аллергической реакции.
Результаты морфологических исследований . Как показали наши исследования, процесс заживления раны в средней ее части несколько отличается от проксимального и дистального отделов, тогда как в последних он практически идентичен, что позволило нам обнаруженные здесь изменения объединить в одну группу («Края раны»).
-
3 сутки. Контроль, средняя часть раны. По краям раны обнаруживалась лейкоцитарная инфильтрация, визуализировались тяжи из фибробластов, щелевидные полости и сосуды синусоидного типа (рис. 1).
При этом в подлежащих тканях также наблюдалась воспалительная клеточная инфильтрация и некротические изменения. Признаки эпителизации раны отсутствовали.
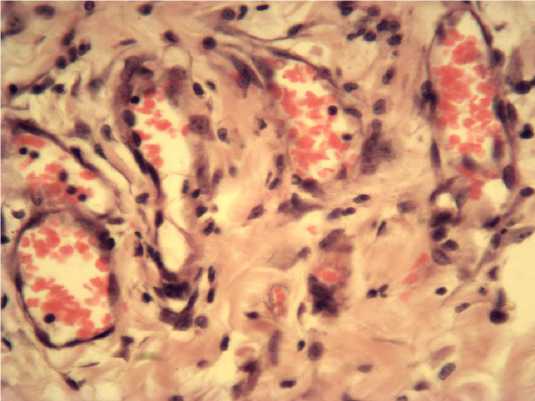
Рис. 1. Новообразованные сосудысинусоидного типа в средней части раны на 3 сутки эксперимента. Контрольная группа. Окраска гематоксилином и эозином. х 400.
Контроль, Края раны. На данном сроке уже активировался процесс эпителизации. Происходило «наползание» эпителия на лейкоцитарнонекротический слой. Кроме того, имело место полнокровие и расширение просвета сосудов, отек, иногда с отслойкой эпидермиса, нейтрофильная или лимфогистиоцитарная инфильтрация.
Опыт, Средняя часть раны. Заживление осуществлялось аналогично контрольной группе, но имело некоторые особенности. Так, лимфоцитарно-макрофагальная инфильтрация практически полностью замещала нейтрофильную. Возрастало число вновь образованных сосудовсинусоидного типа, отсутствовали некротические изменения и воспалительная реакция в подлежащих тканях. Опыт, Края раны. В отличие от контроля, в тканях, расположенных вблизи раны, отсутствовал отек, а гистологическая картина кожи здесь соответствовала норме. Эпителизация осуществлялась аналогично контрольной группе.
-
7 сутки. Контроль, Средняя часть раны. Полость раны заполнена молодой соединительной тканью. Сосуды синусоидного типа, сформированные на 3 сутки, трансформировались в вены, артерии и, в меньшей степени, в капилляры.Происходил процесс эпителизации. Контроль, Края раны. Картина в целом была аналогична средней части раны, но с более выраженной эпителизацией. Эпителий в большинстве случаев был многослойным с признаками дифференцировки и четкими слоями.
Опыт, Средняя часть раны. В отличие от контрольной группы, в ране отсутствовала воспалительная клеточная инфильтрация и обнаруживалось больше кровеносных сосудов. В эпителиальном пласте более четко определялись все слои с дифференцированными клетками, но еще также без признаков ороговения (Рис.2).
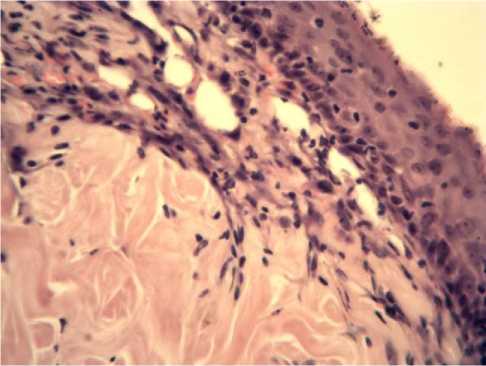
Рис. 2. Многослойный плоский эпителий с четкими слоями и дифф. клетками без признаков ороговения. Средняя часть раны на 7 сутки. Опытная группа. Окраска гематоксилином и эозином. х 400.
Опыт, Края раны. По сравнению с контролем, были отмечены явные различия в реакции кровеносного микроциркуляторного русла. Так, на фоне эпителизации и формирования в раневой щели соединительной ткани, здесь обнаружено большое количество сформированных сосудов венозного и артериального типа, как вновь образованных, так и проникающих в рану со стороны близлежащих здоровых тканей.
-
10 сутки. Производили снятие швов.
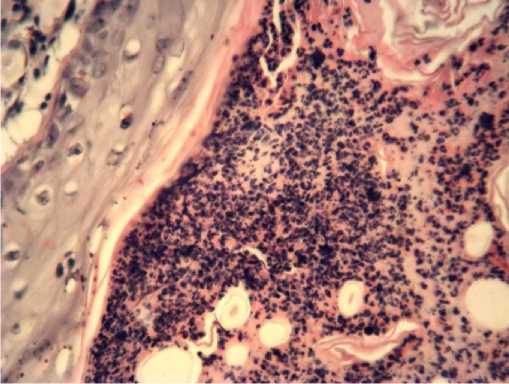
Рис.3. Выраженная лимфогистиоцитарная инфильтрация субэпителиальной области средней части раны на 10 сутки эксперимента. Контрольная группа. Окраска гематоксилином и эозином. х 400.
Контроль, средняя часть раны. Отмечалось полное заживление раны путем формирования соединительной ткани. Поверхность бывшего дефекта была покрыта многослойным плоским ороговевающим эпителием. В отдельных случаях обнаруживались небольшие лимфогистиоцитарные инфильтраты (рис. 3).
Контроль, Края раны. Полное заживление раны с эпителизацией, с формированием соединительной ткани по всей длине разреза.
Опыт, Средняя часть. Полное заживление раны. Поверхность бывшего дефекта была покрыта многослойным плоским ороговевающим эпителием с четко различимыми слоями и дифференцированными клетками. Очаги лимфогистиоцитарной инфильтрации отсутствовали (рис. 4).
Опыт, Края раны. Полное заживление раны с эпителизацией, с формированием соединительной ткани по всей длине разреза, восстановлением структуры кожи. Разница с контролем отсутствовала.
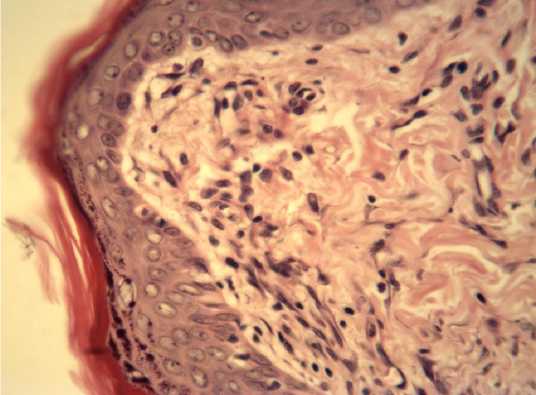
Рис. 4. Нормальная гистологическая структура эпидермиса средней части раны на 10 сутки эксперимента. Опытная группа.Окраска гематоксилином и эозином. х 400.
Заключение. Таким образом, наибольшие различия в динамике раневого процесса отмечены на 3-и и 7-е сутки. Установлено, что подкожное введение препаратаАнгиогенсопровождается сокращением сроков заживления с формированием соединительной ткани в раневой щели и более ранней эпителизацией поверхности дефекта, а так же предотвращением развития осложнений в виде воспалительной клеточной инфильтрации с деструкцией ткани и наличием очагов некроза. Указанные изменения коррелируют с увеличением площади сосудов в зоне регенерации и активной васкуляризацией прилегающих тканей.
ЛИТЕРАТУРА: 1. Ефимов Е.А. Сравнительное исследование заживления полнослойных ран у новорожденных и половозрелых крыс. Бюллетень экспериментальной биологии и медицины. 1988 .—№ 6.— С.75—77. 2. Меркулов Г.А. Курс патологической техники.-М.:Медгиз, 1956. 3. Ромейс Б. [Romies В.]. Микроскопическая техника. – М.: Изд-во иностр. лит., 1954. – 720 с. 4. Стефанов С.Б. Морфометрическая сетка случайного шага как средство ускоренного измерения элементов морфогенеза.— Цитология.—1974.—№ 6.—С.785—787.
КЛИНИКО-МОРФОЛОГИЧЕСКИЕ АСПЕКТЫ РЕГЕНЕРАЦИИ ЛИНЕЙНЫХ РАН
В ЭКСПЕРИМЕНТЕ
Файзуллина Н.З., Валеева А.Н., Шоркина О.И.
Резюме
Применение препарата «Ангиоген» в процессе заживления ран на ранних этапах сопровождается ускорением сроков заживления с формированием соединительной ткани в раневой щели и более ранней эпителизацией поверхности дефекта; предотвращением развития осложнений в виде воспалительной клеточной инфильтрации с деструкцией ткани и наличием очагов некроза. Подобный эффект реализуется за счет улучшения кровоснабжения с увеличением количества вновь образованных сосудов непосредственно в операционной ране, а также активации микроциркуляторных процессов в близлежащих тканях.
CLINICAL AND MORPHOLOGICAL ASPECTS
REGENERATION LINEAR WOUNDS IN THE EXPERIMENT
Fayzullina N.Z., Valeeva A.N., Schorkina O.I.


