Клинико-морфологический анализ дисфункции кондуита Contegra у пациентов первого года жизни
Автор: Журавлева И.Ю., Ничай Н.Р., Докучаева А.А., Сойнов И.А., Иванцов С.М., Кейль И.М., Омельченко А.Ю., Горбатых Ю.Н., Горбатых А.В.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Случаи из клинической практики
Статья в выпуске: 1 т.20, 2016 года.
Бесплатный доступ
Клапаносодержащий кондуит Contegra (Medtronic) с 1999 г. используют для реконструкции выводного отдела правого желудочка в хирургии врожденных пороков сердца. В литературе противоречивы и малочисленны сведения об иммунных воспалениях ксеновены. Мы представляем клинический случай выраженной клеточной иммунной реакции на ксенокондуит Contegra.
Протезирование пути оттока в легочную артерию, дисфункция кондуита, разрастание псевдоинтимы
Короткий адрес: https://sciup.org/142140729
IDR: 142140729
Текст научной статьи Клинико-морфологический анализ дисфункции кондуита Contegra у пациентов первого года жизни
Citation: Zhuravleva IYu, Nichai NR, Dokuchaeva AA, Soinov IA, Ivantsov SM, Keil IM, Omelchenko AYu, Gorbatykh YuN, Gorbatykh AV. Clinical morphological analysis of Contegra dysfunction in infants. Patologiya krovoobrashcheniya i kardiokhirurgiya [Circulation Pathology and Cardiac Surgery]. 2016;20(1):56-61. (In Russ.).
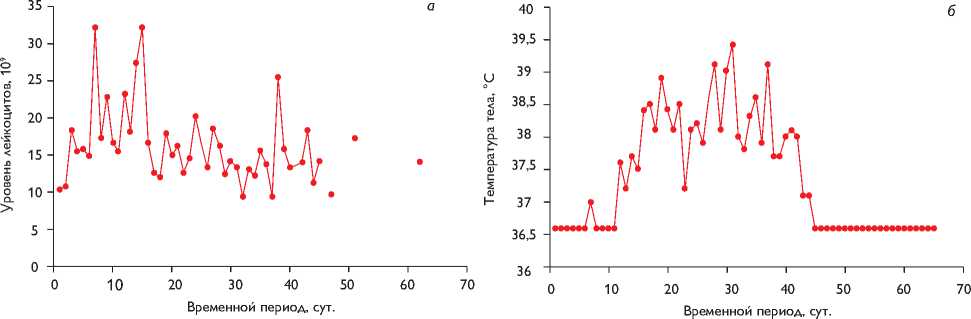
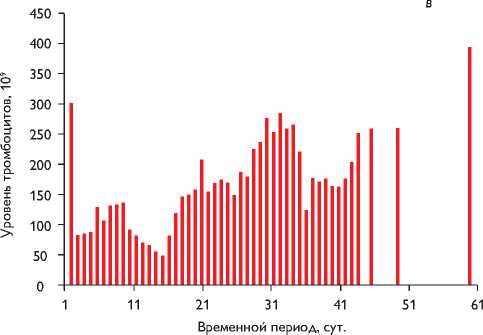
Рис. 1. Динамика температурной кривой и показателей общего анализа крови: а – уровень лейкоцитов в послеоперационном периоде (109); б – температура тела (°С); в – уровень тромбоцитов в послеоперационном периоде (109)
ки трункального клапана в области задней комиссуры и шовной полукисетной аннулопластики в проекции левой створки. Пластику восходящего отдела аорты выполняли с помощью заплаты из ксеноперикарда. Устранили недостаточность на трикуспидальном клапане (шовная по-лукисетная аннулопластика в проекции задней створки), ушили дефект межпредсердной перегородки и сформировали путь оттока в легочную артерию клапаносодержащим ксенокондуитом Medtronic Contegra № 12. Продолжительность искусственного кровообращения (ИК) составила 124 мин.
Предимплантационное отмывание ксенокондуита проводили согласно инструкции производителя и опубликованным рекомендациям [1, 7]. Кондуит отмывали в физиологическом растворе 3 раза по 10 мин, после моделирования формы протез дополнительно промывали в физиологическом растворе для удаления остатков консерванта со свежесрезанных краев. Данная технология позволяет минимизировать цитотоксический эффект, обусловленный остаточной концентрацией глутаральдегида в тканях [7].
Послеоперационный период протекал тяжело с явлениями выраженной сердечно-легочной недостаточности, резидуальной легочной гипертензией с эпизодами легочных кризов, гастроинтестинальной дисфункцией. В течение 23 суток ребенок находился на искусственной вентиляции легких, 30 суток – на инотропной поддержке.
Со 2-х по 14-е сутки после операции отметили нарастание лейкоцитоза свыше 25 х 109/л (рис. 1, а) со сдвигом лейкоцитарной формулы до миелоцитов и метамиелоцитов к 7-м суткам. С 15-х по 27-е сутки определили снижение лейкоцитов до 15 х 109/л. С 11-х суток наблюдали подъем температуры тела до субфебрильных, затем (15–41-е сутки) до фебрильных значений (рис. 1, б). Несмотря на поликомпонентную антибактериальную терапию в сочетании с противогрибковыми препаратами и двумя курсами
а
б
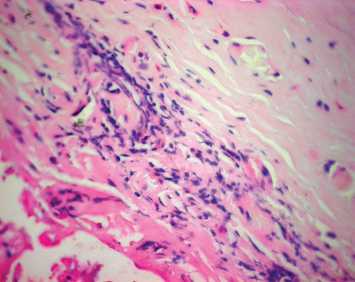
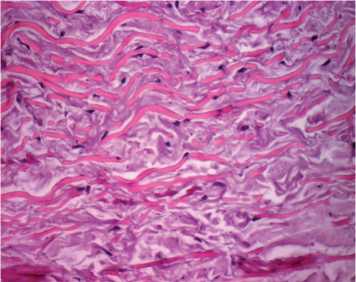
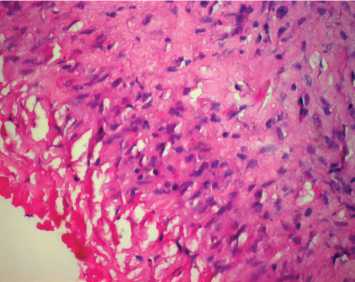
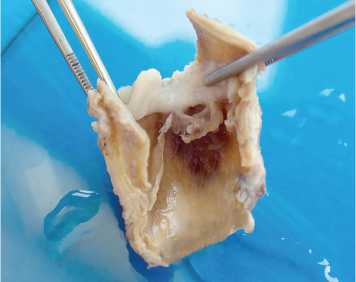
Рис. 2. Макро- и микроскопическая картина ксеновенозного кондуита Contegra: a – макроскопическая картина удаленного кондуита Contegra. Кондуит разрезан параллельно оси. Отчетливо видна плотная псевдоинтима белого цвета в зоне дистального анастомоза с переходом на створки; б – стенка удаленного кондуита Contegra; интимальная и субинтимальная часть. Волокна гомогенизированы, умеренный отек, массивная клеточная инфильтрация. Окраска гематоксилином и эозином; в – стенка неимплантированного кондуита Contegra. Волокна эластина окрашены в ярко-розовый цвет, коллагена – в фиолетовый. Окраска гематоксилином и эозином; г – гиалиноподобная соединительная ткань псевдоинтимы. На токовой поверхности фибрин. Массивная клеточная инфильтрация. Окраска гематоксилином и эозином. Исходное увеличение х 400
пентаглобина (таблица), сохранялась стойкая фебрильная лихорадка, сдвиг лейкоцитарной формулы влево, тромбоцитопения (рис. 1, в). Совокупность имеющихся данных свидетельствовала об активном воспалительном процессе, однако признаков инфицирования послеоперационного шва не было. Убедительные клинические и рентгенологические данные пневмонии отсутствовали. При МСКТ органов грудной, брюшной полостей и головного мозга также не обнаружили очагов инфекционного процесса. В послеоперационном периоде (2, 5, 19, 24, 26, 33, 40, 42-е сутки) гемокультуры были отрицательными, концентрация прокальцитонина нормализовалась после 12 суток.
К 43-м суткам послеоперационного периода состояние пациента стабилизировали: нормализовалась температура тела, уменьшился лейкоцитоз, количество тромбоцитов увеличилось до 2,58 х 105, ребенка перевели в соматическое отделение. На 64-е сутки пациента выписали в удовлетворительном состоянии. В течение всего послеоперационного периода, по данным ЭхоКГ, пиковый градиент давления на уровне ксенокондуита не превышал 10–15 мм рт. ст. (средний 5–6 мм рт. ст.).
Через 9 мес. пациент повторно поступил в клинику с признаками обструкции пути оттока в легочную артерию. Возраст ребенка на момент госпитализации составил 1 год 1 мес., вес 7 400 г. По данным ЭхоКГ, градиент на уровне кондуита в легочной позиции: пиковый – 80 мм рт. ст., средний – 60 мм рт. ст. По результатам предоперационного МСКТ сердца и магистральных сосудов, проксимальный анастомоз между графтом и правым желудочком сужен до 9 мм, далее аневризматически расширяется до 16 х 19 мм; дистальный анастомоз с бифуркацией легочной артерии циркулярно сужен до 4,8 мм; обе легочные артерии в устьях имеют изгиб с деформацией просвета до 6,5 мм и дальнейшим расширением до 10 мм. С момента выписки пациента из стационара не выявляли эпизодов подъема температуры тела. В общем анализе крови при поступлении признаков воспалительной реакции нет.
Ребенку выполнили оперативное вмешательство: репротезирование пути оттока в легочную артерию клапаносодержащим ксеновенозным кондуитом Medtronic Contegra 12 мм. Отмывали ксенокондуит перед имплантацией в правожелудочковую позицию по описанному выше способу. Длительность ИК составила 52 мин. Интраоперационно установили, что стенозы на уровне проксимального и дистального анастомозов обусловлены рубцовой деформацией и выраженным разрастанием псевдоинтимы. Послеоперационный период протекал с явлениями умеренной сердечно-легочной недостаточности без признаков выраженного воспалительного ответа. Ребенок экстубирован на 3-и сутки, переведен в соматическое отделение на 5-е сутки и выписан из стационара в удовлетворительном состоянии на 22-е сутки после операции.
При макроскопическом исследовании удаленного кондуита Contegra обнаружили большое количество плотной хрящеподобной соединительной ткани, рыхло прикрепленной проксимально к створкам кондуита с полным ограничением подвижности двух створок, а дистально – к линии анастомоза. Толщина соединительно-тканного образования максимальна в зоне дистального анастомоза, токовая поверхность гладкая (рис. 2, а).
При микроскопическом исследовании выявили умеренный отек и выраженный фиброз стенки кондуита (рис. 2, б ), гомогенизацию волокнистой основы: эластические и коллагеновые волокна не дифференцируются, в отличие от стенки неимплантированного кондуита Contegra (рис. 2, в ). Видны множественные разрывы, являющиеся результатом биодеградации протеза. Визуализируется массивная лимфоцитарная инфильтрация
Спектр антибактериальной и противомикробной терапии
Сутки п/о
Сульперазон
Меронем
Максипим
Зивокс Цифран Тиенам Микамин Тазацин
Амикацин Пентаглобин Флуконазол
Бисептол
200 мг х 3 р/сут.
200 мг х 3 р/сут.
170 мг х 3 р/сут.
80 мг х
3 р/сут.
150 мг х 3 р/сут.
200 мг х 3 р/сут.
40 мг х
3 р/сут.
40 мг х
2 р/сут.
55 мг х 4 р/сут.
8 мг х
1 р/сут.
400 мг х 3 р/сут.
40 мг х 3 р/сут.
60 мг х 1 р/сут.
40 мг х
2 р/сут.
с вкраплениями тучных клеток, нейтрофилов и моноцитов, что свидетельствует об иммуногенной воспалительной реакции. Клеточная инфильтрация наиболее выражена в интимальной части стенки. Соединительная ткань псевдоинтимы (рис. 2, г ) имеет плотную гиалиноподобную структуру, инфильтрирована лимфоцитами. На поверхности, обращенной к кровяному руслу, видны массивные скопления фибрина и клеточного детрита, сопровождающегося лимфоцитарной инфильтрацией – очаги некроза.
Обсуждение
Формирование гиперпластического стеноза в зоне дистального анастомоза кондуита Contegra связывают, как правило, с иммунологическими реакциями на ксеноткань либо с цитотоксическими эффектами глутарового альдегида – основного консерванта биоматериала [8–10]. Трактовка результатов, полученных при гистологическом исследовании кондуитов, удаленных при реоперациях, диаметрально противоположна. Meyns B. c соавторами отрицают наличие воспалительной реакции, основываясь на сохранении структурной целостности стенки ксеновены. В то же время группа исследователей из Берна в двух работах [8, 10] представляет доказательства выраженной клеточной иммунной реакции на ксенографт в виде лимфоцитарной инфильтрации стенки кондуита и наличия в инфильтратах плазматических клеток, что в полной мере согласуется с данными, полученными в нашем исследовании. Более того, мы наблюдали выраженную лимфоцитарную инфильтрацию и в ткани псевдоинтимы, тогда как цитируемые работы свидетельствовали об отсутствии клеточных элементов в отложениях фибрина на интимальной поверхности графта. По-видимому, в нашем случае это можно расценивать как проявление более выраженной иммунной атаки на ксенографт.
Морфологические данные с клинической картиной послеоперационного периода свидетельствуют об активном асептическом воспалении, приведшем к биодеградации имплантата в течение первого года. Вероятно, в нашем наблюдении в развитии дисфункции сыграли роль оба фактора: цитотоксические эффекты глутарового альдегида – в раннем послеоперационном периоде, иммунная реакция – через 3–6 мес. [9, 11].
Различие клинического течения послеоперационного периода первичной и повторной операций, возможно, обусловили два фактора, ранее обсуждаемые в литературе. Известно, что выраженность иммунного ответа на ксенокондуит потенцирует длительное искусственное кровообращение [9]. При первичной операции длительность ИК составила 124 мин, при повторной – 54 мин. Кроме того, цитотоксические и иммунологические реакции тем сильнее выражены, чем больше относительная площадь контакта кондуита с тканями реципиента [9]. С учетом одинакового размера ксенокондуита Contegra (12 мм) в обоих случаях при повторной операции данное соотношение уменьшилось в связи с увеличением массы тела ребенка в 2 раза.
В целом данный клинический пример отражает сложность механизмов развития дисфункции ксенове-нозного кондуита в легочной позиции у пациентов педиатрической группы, а также вариабельность иммунного ответа. Полагаем, что для дальнейшего изучения патогенеза стеноза дистального анастомоза кондуита Contegra каждый случай дисфункции нуждается в тщательном клинико-морфологическом анализе.
Исследование выполнено при поддержке гранта президента РФ № МК-8107.2016.7. Авторы заявляют об отсутствии конфликта интересов.
Список литературы Клинико-морфологический анализ дисфункции кондуита Contegra у пациентов первого года жизни
- Holmes A.A., Co S., Human D.G., LeBlanc J.G., Campbell A.I.M. The Contegra conduit: Late outcomes in right ventricular outflow tract reconstruction//Annals of Pediatric Cardiology. 2012. Vol. 5 (1). Р. 27-33 DOI: 10.4103/0974-2069.93706
- Shi-MinYuan. The Contegra Valved Bovine Conduit: A Biomaterial for the Surgical Treatment of Congenital Heart Defects//Arq. Bras. Cardiol. 2012. Vol. 99 (6). P. 1159-1165.
- Yong M.S., Yim D., d'Udekem Y., Brizard C.P., Robertson T., Galati J.C., Konstantinov I.E. Medium-term outcomes of bovine jugular vein graft and homograft conduits in children//ANZ J. Surg. 2015. Vol. 85 (5). P. 381-385 DOI: 10.1111/ans.13018
- Urso S., Rega F., Meuris B., Gewillig M., Eyskens B., Daenen W., Heying R., Meyns B. The Contegra conduit in the right ventricular outflow tract is an independent risk factor for graft replacement//Eur. J. Cardio-thorac. Surg. 2011. Vol. 40 (3). P. 603-609 DOI: 10.1016/j.ejcts.2010.11.081
- Лукьянов А.А., Караськов А.М., Горбатых Ю.Н., Наберухин Ю.Л., Омельченко А.Ю., Хапаев Т.С., Горбатых А.В., Сергеевичев Д.С. Ближайшие и отдаленные результаты операции Росса у пациентов педиатрической группы//Патология кровообращения и кардиохирургия. 2014. № 2. С. 5-9.
- Meyns B., Van Garsse L., Boshoff D., Eyskens B., Mertens L., Gewillig M., Fieuwsc S., Verbeken E., Daenen W. The Contegra conduit in the right ventricular outflow tract induces supravalvular stenosis//J. Thorac. Cardiovasc. Surg. 2004. Vol. 128 (6). P. 834-840.
- Mery C.M., Guzman-Prune F.A., DeLeon L.E., Zhang W., Terwelp M.D., Bocchini C.E., Adachi I., Heinle J.S., McKenzie D., Fraser C.D., Jr. Risk factors for development of endocarditis and reintervention in patients undergoing right ventricle to pulmonary artery valved conduit placement.//J. Thorac. Cardiovasc. Surg. 2004. Vol. 151 (2). P. 432-441.e2.
- Gber V., Berdat P., Pavlovic M., Pfammatter J.-P., Carrel T.P. Adverse Mid-Term Outcome Following RVOT Reconstruction Using the Contegra Valved Bovine Jugular Vein//Ann. Thorac. Surg. 2005. Vol. 79 (2). P. 625-631 DOI: 10.1016/j.jtcvs.2010.06.068
- Wojtalik M., Mrowczynski W., Zeromski J., Bartkowski R. Does contegra xenograft implantation evoke cellular immunity in children?//Interact. Cardiovasc. Thorac. Surg. 2003. Vol. 2 (3). P. 273-278.
- Schoenhoff F.S., Loup O., Gahl B., Banz Y., Pavlovic M., Pfammatter J.-P., Carrel T.P., Kadner A. The Contegra bovine jugular vein graft versus the Shelhigh pulmonic porcine graft for reconstruction of the right ventricular outflow tract: A comparative study//J. Thorac. Cardiovasc. Surg. 2011. Vol. 141 (3). P. 654-661 DOI: 10.1016/j.jtcvs.2010.06.068
- Boudjemline Y, Beyler C, Bonnet D, Sidi D. Surprising outcome similarities between Contegra bovine jugular vein conduit and Shelhigh No-React porcine pulmonary valve condit: role of immunological reaction.//Eur. J. Cardiothorac. Surg. 2003. Vol. 24 (5). P. 850-851 DOI: 10.1016/S1010-7940(03)00509-8


