Клинико-орфологические особенности H. pylori-ассоциированных заболеваний гастродуоденальной зоны: возрастные аспекты
Автор: Шульгина Екатерина Михайловна, Симонова Жанна Георгиевна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 4, 2021 года.
Бесплатный доступ
Цель исследования - изучить клинико-морфологические особенности H. fylori-ассоциированных заболеваний гастродуоденальной зоны в зависимости от возраста пациентов. Материалы и методы. В процессе проспективного клинического исследования были сформированы три группы пациентов разного возраста, имеющих H. pylori-ассоциированные заболевания гастродуоденальной зоны. Изучали клиническую картину, морфологические особенности гастродуоденальной зоны до и послеэрадикационной терапии. Период наблюдения больных составил в среднем 172 дня. Всем пациентам выполнялась ззофагогастродуоденоскопия с биопсией. Результаты. У100 % пациентов молодого возраста (I группа) установлены выраженные диспепсические расстройства. Диспепсический индекс соответствовал высокой степени тяжести. Для пациентов II и Ш групп при менее выраженной клинической картине морфологические изменения слизистой оболочки желудка оказались более существенны. В старшей группе (Ш группа) атрофические преобразования тела желудка выявлены у 30,5 % пациентов, привратника желудка -у 11 %, кишечная метаплазия - у 2,8 %. В отличие от пациентов молодого и среднего возраста, имеющих выраженный диспепсический синдром, для пациентов пожилого возраста характерна малосимптомная клиническая картина, которая сопровождалась морфологическими преобразованиями гастродуоденальной зоны с возможностью прогрессирования. Выводы. Эффективная эрадикационная терапия способствует достижению клинико-эндоскопической и морфологической ремиссии состояния гастродуоденальной зоны и создает условия для предотвращения прогрессирования воспалительного каскада.
Helicobacter pylori, заболевания гастродуоденальной зоны, эрадикационная терапия, возрастные особенности
Короткий адрес: https://sciup.org/14122883
IDR: 14122883 | УДК: 616.33-022.7:579 | DOI: 10.34014/2227-1848-2021-4-89-99
Текст научной статьи Клинико-орфологические особенности H. pylori-ассоциированных заболеваний гастродуоденальной зоны: возрастные аспекты
Изучение механизмов прогрессирования морфологических изменений слизистой оболочки гастродуоденальной зоны, исследование проблемы инфицирования и реинфицирования H. pylori представляют перспективное направление медицинской науки, определяя формирование персонализированного подхода к терапии пациентов разных возрастных групп.
Цель исследования. Изучить клиникоморфологические особенности H. рylori-ассо-циированных заболеваний гастродуоденальной зоны в зависимости от возраста пациентов.
Материалы и методы. Открытое проспективное клиническое исследование проводилось в условиях амбулаторного приема на базе ЛПУ Кировской области. Критерии включения пациентов в исследование: 1) наличие за- болеваний гастродуоденальной зоны, ассоциированных с Нelicobacter рylori; 2) возраст от 18 до 74 лет; 3) информированное согласие пациента. Критерии исключения: 1) анемический синдром; 2) печеночная недостаточность, ХБП≥3 ст.; 3) нестабильная стенокардия, стенокардия напряжения; 4) ОИМ, ОНМК давностью менее 1 года; 5) сахарный диабет в стадии декомпенсации; 6) ХСН; 7) онкологические заболевания.
Обследование больных проводилось на основе информированного добровольного согласия согласно требованиям биомедицинской этики, предъявляемым Хельсинкской декларацией Всемирной медицинской ассоциации (2000), и Приказу № 3909н Минздравсоцразвития России от 23 апреля 2012 г.
Анализ результатов исследования проводился с помощью прикладных программ Excel 2013 и Статистика 10 (StatSoft, США). Количественные данные, имеющие распределение, близкое к нормальному, представляли с помощью средней арифметической и стандартного отклонения (M±σ); количественные данные, имеющие распределение, отличное от нормального, – в виде медианы (Me) и межквартильного размаха между 25-м и 75-м процентилями (Q1; Q3). Для сравнения количественных признаков в трех группах применялся критерий Краскела – Уоллиса. Полученный фактический материал обрабатывался путем сравнения средних величин (М) по t-кри- терию Стьюдента и сравнения долей с помощью Z-критерия. Распределение в совокупности представлено 95 % доверительным интервалом (CI 95 %).
Результаты. В процессе исследования были сформированы три группы пациентов: I группа – в возрасте до 40 лет (n=33, средний возраст – 27,5 [19,4; 35] года); II группа – от 40 до 60 лет (n=58, средний возраст – 56 [52; 59,8] лет); III группа – от 60 до 74 лет (n=36, средний возраст – 66 [61,2; 70,6] лет) (табл. 1).
В I группе картину диспепсии представили следующие симптомы: боли в эпигастрии – у 33 (100 %) пациентов; тяжесть, дискомфорт в эпигастрии после еды – у 25 (75,6 %); тяжесть, дискомфорт в эпигастрии, не связанные с приемом пищи, – у 12 (36,4 %); жжение в эпигастрии – у 21 (63,6 %); изжога – у 33 (100 %); ночная изжога, отрыжка кислым – у 2 (6,1 %) пациентов. Диспепсический индекс у пациентов I группы составил 12,3 [11,1; 13,5] балла, что свидетельствует о высокой степени выраженности диспепсического синдрома. Среди пациентов II и III групп диспепсический синдром уже не имел такой выраженности.
Во II группе детализация клинической симптоматики выявила снижение аппетита, нарушение сна – у 48 (39,7 %), снижение работоспособности – у 39 (67,2 %) пациентов. Боли в эпигастрии имелись у 18 (31 %) пациентов; тяжесть, дискомфорт в эпигастрии после еды – у 32 (55,1 %); тяжесть, дискомфорт в эпигастрии, не связанные с приемом пищи, – у 28 (48,3 %); жжение в эпигастрии, изжога, отрыжка кислым – у 32 (55,1 %); ночная изжога – у 2 (3,4 %) пациентов. Диспепсический индекс оказался в рамках среднего уровня (10,9 [8,7; 13,1] балла).
В III группе отмечалось превалирование астенизации: снижение аппетита, нарушение сна – у 25 (69,4 %), снижение качества жизни – у 25 (69,4 %), снижение работоспособности, слабость и утомляемость – у 36 (100 %) пациентов. Присутствие синдрома диспепсии отметили лишь 11 (30,5 %) чел., при этом боли в эпигастральной области – лишь 5 (13,8 %) пациентов. ДИ соответствовал легкой степени тяжести диспепсического синдрома (5,1 [3,9; 6,3] балла).
Таблица 1
Table 1
Клиническая характеристика пациентов с H. pylori-ассоциированными заболеваниями гастродуоденальной зоны
Clinical characteristic of patients with H. pylori-associated gastroduodenal zone diseases
Примечание. р – уровень статистической значимости различий.
Note. p – the level of statistical significance of differences.
Степень обсемененности Н. рylori у больных рассматриваемых групп не зависела от поражения слизистой оболочки рассматриваемой зоны.
Период наблюдения за пациентами составил 172 [160; 182] дня. Всем больным была проведена эрадикационная терапия H. рylori по схеме первой линии (Клинические рекомендации РГА, 2018) длительностью 14 дней (дважды в день: ИПП 20 мг, кларитромицин 500 мг, амоксициллин 1000 мг). Эффективность эрадикационной терапии оценивалась методом определения антигена Н. рylori в кале и ПЦР-диагностикой. Мониторирование клинической картины продемонстрировало наиболее значимые изменения у пациентов молодого возраста (I группа) (табл. 2).
Таблица 2
Table 2
Динамика клинического статуса пациентов с H. pylori-ассоцииpованными заболеваниями гастродуоденальной зоны (до и после лечения), абс. (%)
Dynamics of clinical status of patients with H. pylori-associated gastroduodenal zone diseases (before and after treatment), abs. (%)
|
Показатель Parameter |
I группа Group 1 (n=33) |
II группа Group 2 (n=58) |
III группа Group 3 (n=36) |
|||
|
До лечения Before treatment |
После лечения After treatment |
До лечения Before treatment |
После лечения After treatment |
До лечения Before treatment |
После лечения After treatment |
|
|
Боли в эпигастрии Epigastric pain |
33 (100) |
1 (3) |
18 (31) |
3 (5,2) |
5 (13,8) |
1 (2,8) |
|
р=0,0001 |
р=0,01 |
р=0,04 |
||||
|
Показатель Parameter |
I группа Group 1 (n=33) |
II группа Group 2 (n=58) |
III группа Group 3 (n=36) |
|||
|
До лечения Before treatment |
После лечения After treatment |
До лечения Before treatment |
После лечения After treatment |
До лечения Before treatment |
После лечения After treatment |
|
|
Тяжесть, дискомфорт в эпигастрии после еды Heaviness, discomfort in epigastria after eating |
25 (75,6) |
7 (21,2) |
32 (55,1) |
10 (17,2) |
11 (30,5) |
2 (5,6) |
|
р=0,0001 |
р=0,0001 |
р=0,04 |
||||
|
Тяжесть, дискомфорт в эпигастрии без связи с едой Heaviness, discomfort in epigastria regardless to food intake |
12 (36,4) |
3 (9,1) |
28 (48,3) |
3 (5,2) |
16 (16,7) |
1 (2,8) |
|
р=0,0001 |
р=0,0001 |
р=0,001 |
||||
|
Жжение в эпигастрии Epigastric burning |
21 (63,6) |
7 (21,2) |
32 (55,1) |
10 (17,2) |
11 (30,5) |
2 (5,6) |
|
р=0,0001 |
р=0,0001 |
р=0,04 |
||||
|
Изжога Pyrosis |
33 (100) |
2 (6,1) |
32 (55,1) |
3 (5,2) |
11 (30,5) |
1 (2,8) |
|
р=0,0001 |
р=0,0001 |
р=0,01 |
||||
|
Нарушение сна Insomnia |
4 (12,1) |
0 |
48 (39,7) |
5 (8,6) |
25 (69,4) |
9 (25) |
|
р=0,0001 |
р=0,0001 |
р=0,09 |
||||
|
Нарушение работоспособности Performance impairment |
2 (6,1) |
0 |
34 (58,6) |
5 (8,6) |
36 (100) |
9 (25) |
|
р=0,0001 |
р=0,0001 |
р=0,001 |
||||
Примечание. р – уровень статистической значимости различий в группах до и после лечения.
Note. p – the level of statistical significance of differences in groups before and after treatment.
Так, в I группе произошло снижение частоты эпигастральных болей (100 vs 3 %, р=0,0001), тяжести и дискомфорта после еды (75,6 vs 21,2 %, р=0,0001), тяжести, дискомфорта в эпигастрии, не связанных с приемом пищи (36,4 vs 9,1 %, р=0,0001), жжения в эпигастрии (63,6 vs 21,2 %, р=0,0001), изжоги (100 vs 6,1 %, р=0,0001) (табл. 2). Таким образом, эрадикационная терапия способствовала улучшению эндоскопических и морфологических характеристик гастродуоденальной зоны, а также самочувствия пациентов.
Во II и III группах динамика клинической характеристики была менее выраженной. Во II группе снизилась частота болей в эпигастрии (31 vs 5,2 %, р=0,01), тяжести и дискомфорта после еды (55,1 vs 17,2 %, р=0,0001), жжения в эпигастрии, изжоги (55,1 vs 17,2 %, р=0,0001). С учетом изначально малосимптом-ной и стертой клиники у пациентов старшей возрастной группы динамика клинической картин оказалась малоубедительной. При этом па- циенты указывали на улучшение работоспособности (100 vs 25 %, р=0,001) (табл. 2). Наибольшая динамика диспепсического индекса была отмечена у больных I и II групп (рис. 1).
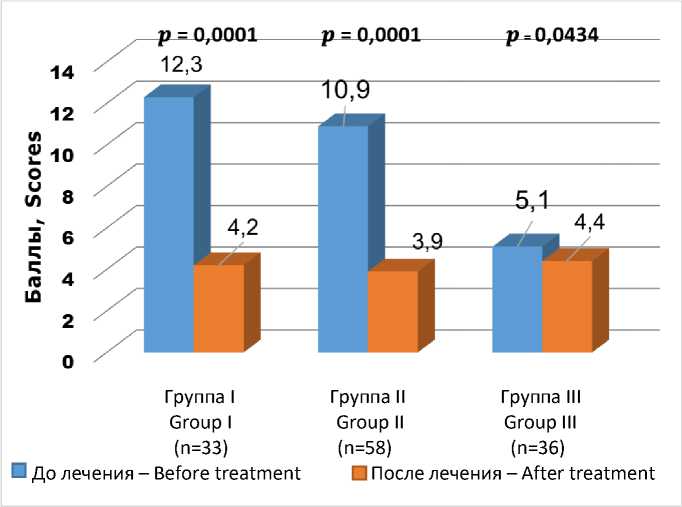
Рис. 1. Динамика диспепсического индекса у пациентов I, II и III групп в процессе исследования (до и после лечения)
Fig 1. Dyspeptic index monitoring in patients (Groups 1, 2 and 3) in the course of study (before and after treatment)
Таблица 3
Table 3
Динамика морфологического статуса гастродуоденальной зоны у пациентов с H. pylori-ассоциированными заболеваниями (до и после лечения) (Me [Q1; Q3]), баллов
Dynamics of gastroduodenal zone morphological status in patients with H. pylori-associated diseases (before and after treatment) (Me [Q1; Q3]), scores
Примечание. р – уровень статистической значимости различий между показателями в группах до и поcле лечения.
Note. p – the level of statistical significance between groups before and after treatment.
Эффективность проведенной эрадикации составила 89,3 %. При этом уровень компла-ентности пациентов оказался равным 97,6 %.
Обсуждение. Инфекция H. pylori расценивается как медленно текущая, что прежде всего обусловлено высокой степенью адаптации и длительным персистированием бактерии в организме человека. Известная роль бактерии как предиктора системного воспаления и канцерогенеза диктует необходимость более глубокого изучения клиникоморфологических особенностей Н. рylori-ас-социированных заболеваний в ракурсе возрастных аспектов.
Выводы:
Список литературы Клинико-орфологические особенности H. pylori-ассоциированных заболеваний гастродуоденальной зоны: возрастные аспекты
- Маев И.В., Андреев Д.Н., Самсонов А.А., Дичева Д.Т., Парцваниа-Виноградова Е.В. Эволюция представлений о дефиниции, классификации, диагностике и лечении гастрита, ассоциированного с инфекцией Helicobacter pylori (по материалам Киотского консенсуса, 2015). Фарматека. 2016; 6: 24–33.
- Ивашкин В.Т., Маев И.В., Лапина Т.Л., Шептулин А.А., Трухманов А.С., Абдулхаков Р.А. Лечение инфекции Helicobacter pylori: мейнстрим и новации (обзор литературы и резолюция Экспертного совета Российской гастроэнтерологической ассоциации 19 мая 2017 г.). Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2017; 27 (4): 4–21. DOI: 10.22416/1382-4376-2017-27-4-4-21.
- Лазебник Л.Б., Ткаченко Е.И., Абдулганиева Д.И., Абдулхаков Р.А., Абдулхаков С.Р. VI Национальные рекомендации по диагностике и лечению кислотозависимых и ассоциированных с Helicobacter pylori заболеваний (VI Московские соглашения). Экспериментальная и клиническая гастроэнтерология. 2017; 2: 3–21.
- Correa P. Helicobacter pylori and gastric carcinogenesis. Am. J. Surg. Pathol. 1995; 19: 37–43.
- Маев И.В., Казюлин А.Н. Новые возможности профилактики рака желудка. Терапевтический архив. 2017; 4: 101–109. DOI: 10.17116/terarkh2017894101-109.
- Bray F. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J. Clin. 2018; 6: 394–424.
- Morgan D.R., Crowe S.E. Helicobacter pylori infection. Sleisenger and Fordtran's Gastrointestinal and Liver Disease: Pathophysiology, Diagnosis, Management. Philadelphia; 2015: 856–884.
- Сhen H.N., Wang Z., Li X., Zhou Z.G. Helicobacter pylori eradication cannot reduce the risk of gastric cancer in patients with intestinal metaplasia and dysplasia: evidence from a meta-analysis. Gastric. Cancer. 2016; 19 (1): 166–175.
- Rugge M., Fassan M., Pizzi M., Farinati F., Stumiolo G.C., Plebani M., Gracham D.Y. Operative link for gastritis assessment vs operative link on intestinal metaplasia assessment. World J. Gastroenterol. 2011; 17 (41): 4596–4601.
- Симонова Ж.Г., Приходько М.Н., Шульгина Е.М. Хронический гастрит и пожилой возраст: есть ли проблема? Ульяновский медико-биологический журнал. 2020; 4: 30–39. DOI: 10.34014/2227-18482020-4-30-39.
- Филатов М.А., Симонова Ж.Г. Синдром диспепсии у больных стабильной стенокардией. Вятский медицинский вестник. 2020; 3 (67): 45–50.
- Yoshida T. Cancer development based on chronic active gastritis and resulting gastric atrophy as assessed by serum levels of pepsinogen and Helicobacter pylori antibody titer. Int. J. Cancer. 2014; 134 (6): 1445–1457.
- Маев И.В., Самсонов А.А., Андреев Д.Н. Инфекция Helicobacter pylori. Москва: ГЭОТАР – Медиа; 2016.
- Correa P. Gastric cancer: overview. Gastroenterol. Clin. North Am. 2013; 42 (2): 211–217.
- Fukase K., Kato М., Kikuchi S., Inoue R., Uemura N., Okamoto S.H. Japan Gast Study Group Effect of eradication of Helicobacter pylori on incidence of metachronous gastric carcinoma after endoscopic resection of early gastric cancer: an open-label, randomized controlled trial. Lancet. 2008; 372: 392–397.


