Клиникохморфогенетические варианты атрофического поражения слизистой оболочки желудка
Автор: Наумова Л.А., Пушкарев С.В., Чичагова Е.Е., Саблина О.Ф.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4-1 т.26, 2011 года.
Бесплатный доступ
Цель исследования: изучить особенности морфогенеза атрофического процесса в слизистой оболочке желудка. Проведено клинико-морфологическое (световая микроскопия гастробиоптатов, иммуногистохимия) исследование у 117 пациентов с атрофией слизистой оболочки желудка (СОЖ) при отсутствии (1-я группа) и наличии Helicobacter (Н.) pylori-инфекции (2-я группа), изучены особенности экспрессии трансформирующего фактора роста бета (TGF-?) и рецепторов к нему 1-го типа (TGF-?R1) в железистом и стромальном компартментах СОЖ. Выделены два варианта морфогенеза атрофического процесса (АП) в СОЖ. Первый развивается при отсутствии H. pylori#инфекции, ассоциируется с сочетанным влиянием нескольких эндогенных факторов риска развития хронического гастрита, преобладанием дисрегенераторных изменений в теле желудка с выраженной тенденцией к атрофии желез. Клинически он отличается высокой частотой системности атрофического поражения слизистых оболочек желудочно-кишечного тракта, преобладанием среди жалоб дистензионных болей. Второй вариант ассоциируется с сочетанным влиянием эндо- и экзогенных факторов, в частности, наличием H. pylori-инфекции, патогенетических механизмов "химического" гастрита, преобладанием дисрегенераторных и склеротических изменений в антральном отделе желудка. При исследовании эпителио-стромальных отношений по состоянию системы TGF-? - TGF-?R1 отмечены как общие, так и различные для каждого из вариантов проявления ее дисбаланса, отражающие особенности их морфогенеза. Полиэтиологичность АП в целом и наличие его различных морфогенетических вариантов требуют особого диагностического алгоритма и патогенетически обоснованной терапии в каждом конкретном случае. Определение баланса в системе TGF-? - TGF-?R1 может стать важным маркером нарушения эпителио-стромальных отношений при формировании групп риска по развитию рака желудка среди пациентов с АП в СОЖ.
Атрофия слизистой желудка, варианты морфогенеза, трансформирующий фактор роста бета
Короткий адрес: https://sciup.org/14919615
IDR: 14919615 | УДК: 616.33-002.27
Текст научной статьи Клиникохморфогенетические варианты атрофического поражения слизистой оболочки желудка
Атрофия относится к ярким проявлениям несостоятельности процессов регенерации и на тканевом уровне характеризуется как выраженный дисрегенераторный процесс с формированием двух противоположных тенденций в поведении эпителия – к атрофии и очаговой гипер-, мета- и дисплазии на фоне прогрессирующих склеротических изменений, отражающих нарушения эпителио-стромальных отношений [1, 8, 11].
К одной из важных характеристик эпителио-стро-мальных отношений относится состояние системы транс-формирущего фактора роста в (TGF- β ) и рецепторов к нему, в частности 1-го типа – TGF- β R1. Являясь полипеп-тидным клеточным регулятором, TGF- β участвует в регуляции пролиферации и дифференцировки клеток, процессах репарации, апоптоза, клеточной миграции и адгезии, продукции экстрацеллюлярного матрикса. Усиление экспрессии TGF- β ассоциируется со многими заболеваниями: склерозом, алиментарным ожирением и даже артериальной гипертензией через участие в регуляции экспрессии эндотелина-1 и высвобождении ренина. Дисбаланс в системе TGF- β – TGF- β R1 может ассоциироваться с прогрессированием атрофических изменений и играть ключевую роль в возникновении многих форм рака [13, 16, 17].
Характер эпителио-стромальных отношений во многом, на наш взгляд, определяет дальнейшие морфогене- тические потенции АП, а понимание морфогенетических вариантов последнего – особенности лечения.
Материал и методы
Обследованы 117 пациентов (42 мужчины и 75 женщин) в возрасте от 18 до 58 лет с эндоскопически диагностированной атрофией СОЖ и клиническим диагнозом ХАГ. Первую группу составили 65 больных (средний возраст – 37,0±4,4 лет) без сопутствующей H. pylori-инфекции в анамнезе и на момент обследования, вторую – 52 человека (средний возраст – 32,8±7,0 лет) с H. pylori-позитивным процессом.
Иммуногистохимическое исследование выполнялось стрептавидин-биотиновым иммунопероксидазным методом на серийных парафиновых срезах с использованием моноклональных антител к TGF β и TGF β R1, в обоих случаях в разведении 1 : 40 (Novocastra, Великобритания). Для отрицательного контроля первичные антитела заменяли неиммунной сывороткой. Оценку результатов исследования проводили по условной 6-балльной шкале.
Для описания количественных признаков использовали среднее значение, стандартную ошибку среднего значения, для качественных – долю, стандартную ошибку; дисперсионный анализ (выявление межгрупповых различий) проводили с использованием t-критерия Стъю-дента и χ 2 критерия Пирсона при уровне значимости p<0,05. Статистическая обработка данных проводилась с использованием программного пакета Excel 2002 (Microsoft, США).
Результаты
При сопоставимости рассматриваемых групп по возрасту пациентов, длительности заболевания (10,3±2,1 и 5,9±1,4 лет) и общности ряда проявлений АП сравнительный анализ позволил выделить два его различных клинико-морфогенетических варианта, обозначенных соответственно группам как первый и второй (табл. 1).
Оба варианта ассоциировались с сочетанным влиянием нескольких эндогенных факторов риска хронического гастрита [11]. Это высокая частота висцеральных признаков дисплазии СТ; сопутствующих эндокринопа-тий, среди которых преобладали дисфункции половых желез с клиническими маркерами дис- и гиперэстроге-немии [10]; сопутствующей патологии ГПДЗ, в частности хронической описторхозной инвазии (12,3 и 11,5%), ассоциирующейся, как известно, с увеличением частоты атрофического поражения СОЖ.
Второй морфогенетический вариант АП отличали сочетанное влияние эндо- и экзогенных факторов риска хронического гастрита [11], в частности наличие H. pylori-инфекции, патогенетических звеньев “химического гастрита” (дуоденогастральный рефлюкс, продолжительные погрешности в питании), скудная клиническая симптоматика.
Сравнительный анализ морфогенетических вариантов в возрастном аспекте (табл. 2) показал, что с возрастом увеличивается частота сопутствующих эндокрино-патий преимущественно за счет дисфункции половых желез. Признаки дисплазии СТ практически с одинаковой частотой встречаются во всех возрастных подгруппах. С возрастом нарастает также частота системных проявлений АП и сопутствующих заболеваний ГПДЗ.
Таблица 1
Клинические особенности морфогенетических вариантов АП
|
Особенности анамнеза и проявлений АП |
1-я группа, n=65 |
2-я группа, n=52 |
||
|
абс. |
% |
абс. |
% |
|
|
Признаки дисплазии СТ |
49 |
75,4±5,3 |
43 |
82,7±5,2 |
|
Сопутствующие эндокринопатии, |
||||
|
в том числе дисфункции: |
45 |
69,2±5,7 |
27 |
51,9±6,9 |
|
– половых желез |
36 |
55,4±6,2 |
25 |
48,1±6,9 |
|
– щитовидной железы |
22 |
33,8±5,9* |
9 |
17,3±5,2 |
|
Сопутствующая патология ГПДЗ |
54 |
83,1±4,7 |
37 |
71,2±6,3 |
|
Системность атрофического поражения СО ЖКТ |
38 |
58,5±6,1** |
18 |
34,6±6,6 |
|
Симптомы желудочной диспепсии: |
51 |
78,5±5,1 |
36 |
69,2±6,4 |
|
– дистензионные боли |
36 |
55,4±6,2** |
18 |
34,6±6,6 |
|
– спастические боли |
12 |
18,5±4,8 |
17 |
32,7±6,5 |
|
Астено-невротический синдром |
39 |
60,0±6,1* |
21 |
40,4±6,8 |
|
Эпизоды ↓ массы тела |
13 |
20,0±5,0** |
3 |
5,8±3,2 |
|
Продолжительные погрешности в питании |
21 |
32,3±5,8 |
30 |
57,7±6,9# |
Примечание: ↓ – уменьшение; СО ЖКТ – слизистые оболочки желудочно-кишечного тракта; ГПДЗ – гепато-панкреато-дуоденальная зона; различия между группами значимы: * – р<0,05; ** – р<0,025; # – р<0,01.
Таблица 2
Клинические особенности морфогенетических вариантов АП в возрастном аспекте (%)
|
Клинические особенности |
1-я группа |
2-я группа |
||||
|
18–29 лет |
30–44 лет |
45 и старше |
18–29 лет |
30–44 лет |
45 и старше |
|
|
Сопутствующие эндокринопатии, в том числе дисфункции: |
53,6* |
85,7# |
94,4 |
22,2 |
66,7# |
83,3 |
|
– половых желез |
32,1 |
78,6 |
77,8 |
22,2 |
53,3# |
58,3 |
|
– щитовидной железы |
10,7 |
57,1* |
55,6 |
3,7 |
20,0 |
58,3^ |
|
Сопутствующая патология ГПДЗ |
71,4 |
100,0# |
100,0 |
70,4 |
100,0# |
91,7 |
|
Признаки дисплазии СТ |
89,3 |
78,6^ |
44,4 |
77,8 |
73.3 |
66,7 |
|
Системность АП |
46,4 |
78,6# |
100,0 |
44,4 |
66,7 |
91,7 |
Примечание: р<0,05 при сравнении: * – соответствующих возрастных подгрупп 1 и 2-й группы; # – подгруппы 15–29 лет и 30–44 лет внутри своей группы; ^ – возрастной подгруппы 30–44 и 45 лет и старше внутри своей группы.
двенадцатиперстной кишки (7,7%).
Таблица 3
Частота основных патогистологических изменений в СОЖ по передней стенке и малой кривизне (%)
|
Патогистологические изменения |
1-я группа |
2-я группа |
||||||
|
передняя стенка |
малая кривизна |
передняя стенка |
малая кривизна |
|||||
|
ПЯЭ |
ЖЭ |
ПЯЭ |
ЖЭ |
ПЯЭ |
ЖЭ |
ПЯЭ |
ЖЭ |
|
|
Выраженная гиперплазия |
30,6 |
32,7 |
27,6 |
22,4 |
22,7 |
43,2# |
33,3 |
50,0** |
|
Дисплазия |
18,4 |
20,4 |
25,9** |
31,0 |
13,6 |
25,0 |
10,4 |
31,3# |
|
ПКГ |
24,5* |
6,9 |
15,9 |
8,3 |
||||
|
Признаки мукоидизации желез |
55,1 |
60,3 |
84,1* |
* |
70,8 |
|||
|
Признаки структурной атрофии желез: |
77,6 |
89,7 |
68,2 |
83,3 |
||||
|
– ↓ плотности желез |
63,3 |
** |
67,2 |
** |
38,6 |
45,8 |
||
|
– кистозная трансформация |
46,9 |
75,9* |
** |
54,5 |
62,5 |
|||
|
Фавеолярная гиперплазия |
46,9 |
70,7* |
** |
52,3 |
54,2 |
|||
|
↓ толщины СОЖ |
24,5 |
25,9 |
** |
15,9 |
10,4 |
|||
Примечание: ПЯЭ – покровно-ямочный эпителий; ЖЭ – железистый эпителий; ПКГ – париетальноклеточная гиперплазия; ↓ – уменьшение; р<0,05 при сравнении: # –ПЯЭ и ЖЭ одной локализации; * – передней стенки и малой кривизны внутри группы; ** – с другой группой.
Таблица 4
Примечание: ЛФ – лимфоидные фолликулы; р<0,05 при сравнении: # – ПЯЭ и ЖЭ одной локализации; * – тела и антрального отдела внутри группы; ** – с другой группой.
Таблица 5
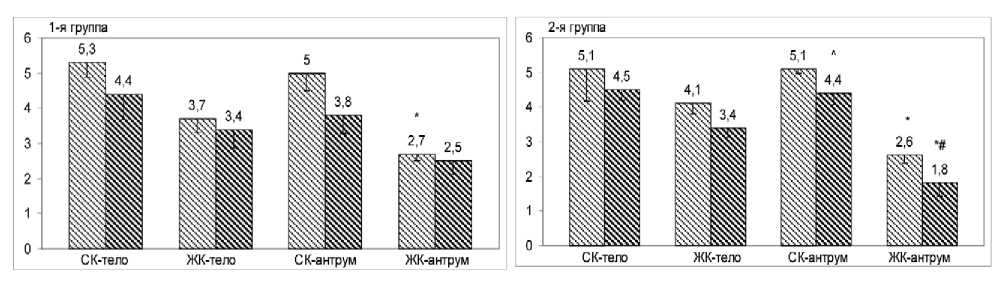
Оценка выраженности дисрегенераторных изменений в СОЖ по условной 6-балльной шкале
** – соответствующих показателей в другой группе.
Обсуждение
Таким образом, независимо от возможных причинных факторов атрофия предстает как выраженный дис-регенераторный процесс с разнонаправленными нарушениями пролиферации и дифференцировки клеточных популяций СОЖ или дисрегуляторный процесс, вероятно, обусловленный разноуровневыми нарушениями регуляции регенерации. Последние могут быть тесно связаны с характером сопутствующей патологии, в частности дисплазией СТ (высокая частота ее признаков в обеих группах) – важнейшей интегративной системой организма и составляющей сосудисто-эпителио (паренхима-тозно)-стромальных отношений [3]. Дисбаланс в системе TGF- β – TGF β -R1 патогенетически также может быть связан с дисплазией СТ через участие TGF- β в морфогенезе СТ [2]. В качестве еще одного возможного эндогенного фактора метаболической, структурной и функциональной дезорганизации СОЖ может рассматриваться гиперэстрогенемия [9]. Все это значительно расширяет представления о пато- и морфогенетических вариантах
АП в СОЖ, традиционно ассоциирующегося лишь с его А (аутоиммунный) и В (бактериальный) типами [11].
Заключение
Список литературы Клиникохморфогенетические варианты атрофического поражения слизистой оболочки желудка
- Давыдовский И.В. Общая патология человека. -М.: Медицина, 1969. -559 с.
- Кадурина Т.И., Горбунова В.Н. Дисплазия соединительной ткани: руководство для врачей. -СПб.: Элси-СПб, 2009. -704 с.
- Казначеев В.П., Субботин М.Я. Этюды к теории общей патологии. -2-е изд. -Новосибирск: Наука, 2006. -256 с.
- Коваленко В.Л, Казачков Е.Л., Казимирова А.А. Значение некоторых ростовых факторов в патогенезе хронического гастрита у детей//Архив патологии. -2008. -№ 2. -С. 3-5.
- Наумова Л.А., Пальцев А.И., Беляева Я.Ю. Особенности клинико-морфологических проявлений атрофического процесса в желудке при отсутствии и наличии инфицированности H. pylori (I этап)//Экспериментальная и клиническая гастроэнтерология. -2005. -№ 2. -С. 22-28.
- Наумова Л.А., Пушкарев С.В. Соединительная ткань как система: отдельные клинические аспекты//Вестник СурГУ. Медицина. -2009. -№ 3. -С. 45-56.
- Наумова Л.А., Шевчишина О.Ф., Дятлова А.Ю. Отдельные аспекты структурных проявлений ассоциированного с дисплазией соединительной ткани атрофического процесса в слизистой оболочке желудка//Кубанский научный медицинский вестник. -2009. -№ 6 (111). -С. 60-62.
- Наумова Л.А., Пушкарев С.В. Атрофический процесс -клинико-морфологические аспекты (на примере поражения слизистых оболочек бронхов и желудка)//Вестник СурГУ. Медицина. -2010. -№ 5. -С. 98-114.
- Степанов Ю.М., Кушлинский Н.Е. Экспрессия рецепторов эстрогенов и простагландинов группы Е у больных атрофическим гастритом с предраковыми изменениями эпителия//Онкология. -2001. -Т. 3, № 1. -С. 16-8.
- Фролова И.И., Листергази Г.М., Радзинский В.Е. Иммуногистохимические исследования дискератоза и неопластических изменений экзоцервикса при гинекологической патологии//Архив патологии. -2002. -№ 6. -С. 23-6.
- Чернин В.В. Хронический гастрит. -Тверь: Триада, 2006. -304 с.
- Шехтер А.Б., Серов В.В. Воспаление, адаптивная регенерация и дисрегенерации (анализ межклеточных взаимодействий//Архив патологии. -1991. -№ 7. -С. 7-4.
- Blobe G.C., Shiemann, H.F., Lodish H.F. Role of transforming growth factor B in human disease//N. J. Med. -2000. -Vol. 342, No. 18. -P. 1350-358.
- Сoradini D., Casarsa C., Oriana S. Epithelial cell polarity and tumorogenesis: new perspectives for cancer detection and treatment//Acta Pharmacologica Sinica advance online publication 18 April 2011 [Электронный ресурс]. -URL: http://maciej.bioinfo.pl.
- Correa P. Helicobacter pylori and gastric carcinogenesis//Am. J. Surg. Pathol. -1995. -No. 19, Suppl. 1 -P. 37-3.
- Glasgow E., Mishra L. Transforming growth factor-в signaling and ubiquitinatinators in cancer//Endocrine#Related Cancer. -2007. -Vol. 1, No. 15 -P. 59-2.
- Herfs M., Hubert P., Khold N. Transforming growth factor upregulation reduces the density of Langerhance cells in Epithelial Methaplasia by affecting E-cadherin expression//Am. J. Pathol. -2008. -Vol. 172. -P. 1391-402.


