Клональное размножение in vitro малины душистой
Автор: Соловых Н.В.
Журнал: Международный журнал гуманитарных и естественных наук @intjournal
Рубрика: Биологические науки
Статья в выпуске: 8-2 (83), 2023 года.
Бесплатный доступ
Оптимизированы минеральный, углеводный и гормональный составы питательных сред для размножения in vitro малины душистой. Установлено, что использование питательных сред по прописям QL и Андерсона позволяет получить более высокие коэффициенты размножения, чем применение традиционной для растений рода Rubus среды MS. Наилучший результат (коэффициент размножения 1,76, средняя длина побегов 18 мм) зарегистрирован на среде MS с половинными концентрациями азота, фосфора, калия и магния. Применение тидиазурона (ТДЗ) в концентрациях 0,1-0,2 мг/л в процессе размножения малины душистой in vitro позволило получить коэффициенты мультипликации на 37-67,7% больше, чем при использовании 6-БАП. ТДЗ вызывает незначительное уменьшение средней длины образующихся побегов. Поэтому на этапе мультипликации, предшествующем укоренению, его следует заменять на 6-БАП. В качестве источника углеводного питания наиболее эффективно использование сахарозы или глюкозы в концентрациях, равных 20 г/л.
Малина душистая, in vitro, клональное размножение, питательные среды, цитокинины, сахара
Короткий адрес: https://sciup.org/170200628
IDR: 170200628 | DOI: 10.24412/2500-1000-2023-8-2-22-26
Текст научной статьи Клональное размножение in vitro малины душистой
Клонирование растений in vitro в последние десятилетия широко используется в селекционной работе для быстрой мультипликации ценных генотипов и в производственной практике для получения оздоровленного высококачественного посадочного материала. Список видов, для которых разработаны технологии клонального микроразмножения, постоянно пополняется [1-3 и др.]. Это в полной мере относится к таким видам рода Rubus , как красная малина, ежевика, малиноежевичные гибриды [4, 5 и др.]. Для душистой малины ( Rubus odoratus L.) исследования по размножению in vitro единичны. Удалось осуществить клонирование этого вида в искусственной культуре, используя среду с минеральным составом по прописи MS [6], содержащую 30 г/л сахарозы, 0,5 мг/л гибберелловой кислоты (ГК), 0,1 мг/л β-индолил-3-масляной кислоты (ИМК) и 1 мг/л 6-бензиламинопурина (6-БАП). Но коэффициент размножения in vitro по сравнению с другими видами рода Rubus остаётся низким [5].
В то же время, культура обладает большой ценностью. Крупные светло-зелёные листья душистой малины в сочетании с крупными розовыми цветками и продолжительное цветение позволяют использовать её в качестве декоративного растения. Селекционеры рекомендуют активнее включать этот вид в селекционный процесс, так как он, помимо хороших декоративных качеств, обладает прямостоячими побегами, не требующими подвязки на шпалеры. Душистая малина является также донором устойчивости к пурпуровой пятнистости, вызываемой сумчатым грибом Didymella applanata Sace [7], обладает высокой морозостойкостью.
Клональное размножение растений включает несколько этапов, а именно: введение эксплантов в стерильную культуру, мультипликация микрочеренков на искусственных питательных средах, укоренение растений in vitro, и адаптация их in vivo . Каждый из перечисленных этапов требует оптимизации методик применительно к виду.
Целью настоящего исследования являлся подбор минерального, углеводного и гормонального состава питательных сред для этапа мультипликации душистой малины in vitro .
Материалы и методы исследований
В стерильную культуру вводили освобождённые от кроющих чешуй латеральные почки с одревесневших побегов малины душистой, взятые в первой декаде сентября. Введение осуществляли по стандартной методике [8]. Стерилизацию проводили 0,1%-м раствором сулемы (хлорида ртути) в течение 60-90 секунд с последующей промывкой проавтоклавированной дистиллированной водой. Экспланты на этапе введения в культуру in vitro культивировали на среде с минеральным составом по прописи MS, содержащей 0,2 м/л 6-БАП и 0,5 мг/л ГК.
Для оптимизации минерального состава питательных сред на этапе мультипликации микрочеренки малины душистой высаживали на среды по прописям MS, Андерсона [9] QL [10] в модификации A. Standardi и F. Catalano [11]. Использовали также среду MS с уменьшенным вдвое содержанием солей макроэлементов (1/2MS). При подборе оптимального минерального состава в среды вносили 30 г/л сахарозы, 0,5 мг/л ГК, 0,1 мг/л ИМК и 1 мг/л 6-БАП.
Для снятия апикального доминирования в качестве вещества с цитокининовой активностью использовали производное дифенилмочевины тидиазурон (ТДЗ) в концентрациях 0,1, 0,2 и 0,3 мг/л. Контролем служил 6-БАП (синтетический цитокинин из группы аденина) в концентрации 1 мг/л. Пригодность 6-БАП для размножения малины душистой была продемонстрирована ранее [5].
Для оптимизации углеводного питания в среды включали дисахарид сахарозу или моносахарид глюкозу в концентрациях 10, 20 или 30 г/л. Выбор сахаров и их концентраций определён предварительно полученными данными по размножению других видов рода Rubus в присутствии различных углеводов [3-5].
Культуральные сосуды как на этапе введения в культуру, так и на этапе мультипликации содержали в условиях интенсивного освещения 2500 Лк. Световой день составил 16 часов, температура 23±2оС.
Через 30 суток после высадки были проведены учёты коэффициентов размножения и длины вновь образовавшихся побегов. В каждом варианте опыта использовали шесть биологических повторностей по 10 эксплантов в каждой. Математическая обработка экспериментальных данных проведена с помощью статистического пакета программы Microsoft Excel.
Результаты исследований и их обсуждение
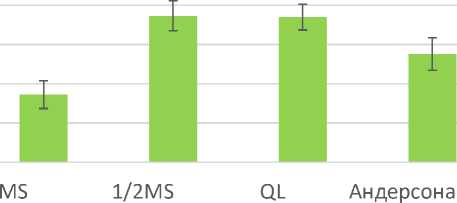
Сравнение коэффициентов размножения и средней длины образовавшихся побегов на разных питательных средах показало относительно более высокую эффективность использования среды QL, которая отличается от традиционной для растений рода Rubus среды MS более низким содержанием нитрата аммония (в четыре раза). Аналогичный результат был получен при использовании среды MS с уменьшенным вдвое содержанием солей макроэлементов (т.е. была уменьшена не только концентрация аммонийного и нитратного азота, но и концентрации дигидрофосфата калия и сульфата магния). Коэффициенты размножения на средах QL и ½MS оказались соответственно на 56% и 69,3% выше, а средняя длина образовавшихся побегов на 114,8% и 116% выше, чем названные морфометрические показатели на полной среде MS. Во всех перечисленных вариантах различия с контролем (полной средой MS) статистически существенны (P<0,05).
На среде Андерсона, содержащей вчетверо меньше нитрата аммония и нитрата калия, но примерно равное количество фосфатов по сравнению со средой MS, также наблюдается тенденция к увеличению коэффициента размножения и средней длины образовавшихся побегов (рис. 1, 2). Однако статистически различия по названным показателям с контрольным вариантом (полная среда MS) не являются существенными.
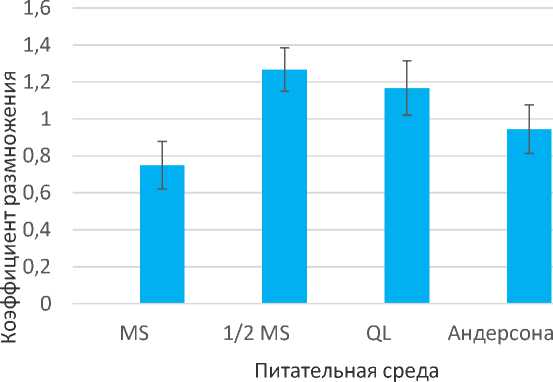
Рис. 1. Коэффициенты размножения малины душистой на средах с различным минеральным составом (30 суток культивирования)
Питательные среды
Рис. 2. Средняя длина побегов малины душистой на средах с различным минеральным составом (30 суток культивирования)
Была продемонстрирована достаточно высокая эффективность применения тиди-азурона в качестве вещества с цитокининовой активностью. Концентрации ТДЗ равные 0,1-0,2 мг/л оказались оптимальными и позволили получить коэффициенты размножения от 1,74±0,14 до 2,13±0,11, что на 37-67,7% больше, чем при использовании 6-БАП. Однако тидиазурон приводил к незначительному (в среднем на 18,3%) уменьшению длины образовавшихся побегов. Хотя это уменьшение не является статистически значимым, ТДЗ не может быть рекомендован для последнего этапа мультипликации, предшествующего укоренению.
Сравнение эффективности применения сахарозы и глюкозы в качестве источников углеводного питания малины душистой не позволило выявить существенных различий между названными сахарами, хотя и наблюдалась тенденция к увеличению коэффициента размножения на средах с глюкозой. Удалось доказать, что концентрация углеводов 30 г/л, обычно применяемая для растений рода Rubus , не является оптимальной для душистой малины. Для размножения растений этого вида in vitro более эффективно вносить в питательные среды сахарозу или глюкозу в концентрациях 20 г/л (рис. 3).
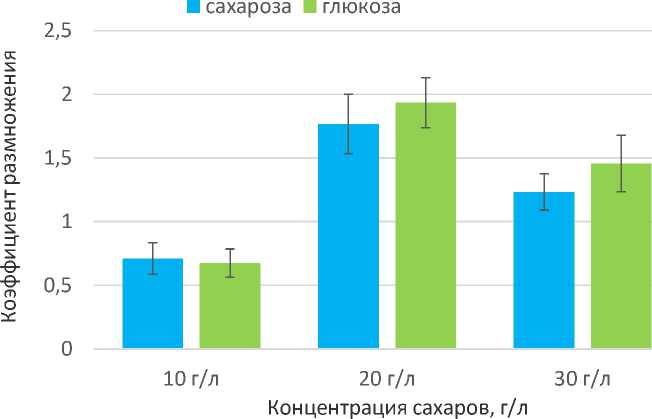
Рис. 3. Коэффициенты размножения малины душистой на среде MS с различным содержанием сахаров в присутствии 0,5 мг/л ГК, 0,1 мг/л ИМК и 1 мг/л 6-БАП (30 суток культивирования).
Используя полученные в описанных экспериментах данные об оптимальном минеральном, углеводном и гормональном составах сред, удалось увеличить коэффициент размножения душистой малины до 4,27±0,43. Для этого использовали среду по прописи MS с уменьшенной вдвое концентрацией солей макроэлементов, содержащую 0,1 мг/л ИМК, 0,5 мг/л ГК, 0,2 мг/л ТДЗ и 20 г/л глюкозы.
Заключение
Для размножения in vitro малины душистой оптимальными являются питательные среды с более низким содержанием аммонийного и нитратного азота по сравнению с традиционно применяемой для растений рода Rubus средой по прописи MS. Снижение в среде MS концентрации солей макроэлементов вдвое или замена её на среду QL в модификации A. Standardi и
-
F. Catalano позволяют увеличить коэффициент размножения малины душистой на 56-69%.
Применение тидиазурона в концентрациях 0,1-0,2 мг/л для снятия апикального доминирования при мультипликации малины душистой позволило получить коэффициенты размножения от 1,74±0,14 до 2,13±0,1, что на 37-67,7% выше, чем при использовании 6-БАП. ТДЗ вызывает незначительное уменьшение средней дины образующихся побегов, поэтому на этапе мультипликации, предшествующем укоренению, его следует заменять на 6-БАП.
При размножении in vitro малины душистой в качестве источника углеводного питания наиболее эффективно использование дисахарида сахарозы или моносахарида глюкозы концентрациях, равных 20 г/л.
Список литературы Клональное размножение in vitro малины душистой
- Деменко В.И. Микроклональное размножение садовых растений: Учебное пособие. -М.: РГАУ - МСХА им. К.А. Тимирязева, 2007. - 55 с.
- Муратова С.А. Размножение садовых культур in vitro /С.А. Муратова, Д.Г. Шорников, М.Б. Янковская. - Мичуринск-наукоград РФ, ВНИИГиСПР им. И.В. Мичурина, ОАО Тамбовская типография «Пролетарский светоч». 2008. - 68 с.
- Муратова С.А. Влияние различных углеводов на регенерацию, размножение и рост растений in vitro / С.А. Муратова, Р.В. Папихин, М.Б. Янковская // Плодоводство и ягодо-водство России. - 2008. - Т. XXXI. - Вып. 2. - С. 86-94.
- Джигадло Е.Н. Методические рекомендации по использованию биотехнологических методов в работе с плодовыми, ягодными и декоративными культурами / Е.Н. Джигадло, М.И. Джигадло, Л.В. Голышкина. - Орёл: ГНУ ВНИИСПК. 2005. - 51 с.
- Соловых Н.В. Размножение in vitro растений рода Rubus / Н.В. Соловых, С.А. Муратова // Сибирский вестник сельскохозяйственной науки. - 2011. - №1 (217). -С. 32-39.
- Murashige T. A revised medium for rapid growth and bioassays with tobacco tissue cultures / T. Murashige, F. Skoog // Physiol. Plant. - 1962. - V. 15, №13. - Р. 473-497.
- Чеснокова И.Н. Биология возбудителя пурпуровой пятнистости малины и наследование устойчивости к болезни. Диссертация ...кандидата биол. наук. 03.00.05 Мичуринск. 1982. - 134 с.
- Индукция морфогенеза и тканевая селекция плодовых и ягодных культур: метод. рекомендации / сост. В.М. Тюленев, Л.В. Осипова, И.Г. Тихонова, С.Л. Расторгуев, Р.П. Евсеева. Мичуринск: ВНИИ Генетики и селекции плодовых растений, 1996. - 75 с.
- Anderson W.C. Tissue culture propagation of red and black raspberries, Rubus idaeus and Rubus occidentalis / W.C. Anderson // Acta Horticulturae. - 1980. - №112. - P. 13-20.
- Quoirin M. Improved medium for in vitro culture of Prunus sp. / M. Quoirin, P. Lepoivre // Acta Hortic. - 1977. - V. 78. - P. 437-442.
- Standardi A. Tissue culture propagation of kiwifruit / A. Standardi, F. Catalano // Comb. Proc. Intern. Plant propagators' soc. - 1984. - Vol. 34. - P. 236-243.


