Количественная масс-спектрометрия в диагностике гриппа и контроле действия лекарственного препарата "Триазавирин"
Автор: А. В. Протасов, Р. А. Бубляев, О. А. Миргородская
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Системный анализ приборов и измерительных методик
Статья в выпуске: 1 т.30, 2020 года.
Бесплатный доступ
Для совершенствования методов диагностики и лечения заболевания гриппом в настоящей работе проведены количественные масс-спектрометрические исследования активности двух основных карбоксипептидаз — ангиотензинпревращающего фермента и карбоксипептидазы-N. Проведены сравнения уровней активности этих пептидаз для здоровых и инфицированных вирусом гриппа A/Aichi/2/68 (H3N2) мышей, а также для мышей, пролеченных экспериментальным противогриппозным препаратом "Триазавирин". Анализ, подобный продемонстрированному в данной работе, может быть с успехом использован при сравнительной оценке эффективности и других антигриппозных препаратов, а также для понимания направления их воздействия на инфицированный организм.
Ангиотензин I, ангиотензинпревращающий фермент, карбоксипептидаза N, брадикинин, количественная масс-спектрометрия,
Короткий адрес: https://sciup.org/142221539
IDR: 142221539 | УДК: 543.51: 577.1: 66.096.3 | DOI: 10.18358/np-30-1-i5561
Фрагмент статьи Количественная масс-спектрометрия в диагностике гриппа и контроле действия лекарственного препарата "Триазавирин"
ВЫВОДЫ
Наиболее значимые изменения активности пептидаз происходят в бронхиальных смывах, нежели в сыворотках крови больных животных. Введение препарата здоровому животному приводит к увеличению активности АПФ, но в значительно меньшей степени по сравнению с инфицированными животными. При введении препарата больным животным происходит заметное снижение активности АПФ до уровня, соответствующего здоровым животным. Это говорит об избирательности воздействия препарата на ренин-ангиотензиновую систему. По результатам работы можно сделать общий вывод о том, что подобный скрининг может быть с успехом использован при сравнительной оценке эффективности и других антигриппозных препаратов, а также для понимания направления их воздействия на инфицированный организм.
Текст научной статьи Количественная масс-спектрометрия в диагностике гриппа и контроле действия лекарственного препарата "Триазавирин"
Грипп в различных его формах в виде сезонных вспышек или пандемий остается серьезной проблемой общественного здравоохранения. Инфекция гриппа у человека может протекать по-разному: от бессимптомной инфекции до осложненных форм, включая тяжелую вирусную пневмонию и обострение имеющихся хронических заболеваний. Сезонные эпидемии гриппа ежегодно могут поражать до 15 % населения. Это указывает на важность создания новых и улучшения существующих вакцин и лекарств.
Вирус гриппа заражает в основном эпителиальные клетки верхних дыхательных путей, распространяясь затем и на клетки нижних дыхательных путей. Значительное число пораженных клеток, возникающее при недостаточном иммунном ответе организма, собственно, и приводит к нарушению функции органов и систем органов, в первую очередь нервной и сердечно-сосудистой систем. Эти нарушения проявляются в общих и локальных изменениях в регуляции кровоснабжения органов и тканей.
В регуляции кровяного давления и водно-солевого баланса принимает участие ренин-ангио-тензиновая система, которая является наиболее важной и достаточно хорошо изученной. Участником этой системы является ангиотензин II — конечный продукт каскада протеолитических процессов. Свое влияние ангиотензин II оказывает через ангиотензиновые рецепторы, являющиеся медиаторами основного сосудосуживающего эф- фекта, включающего вазоконстрикцию, синтез и секрецию альдостерона, секрецию вазопрессина, запуск норадренергической активности и регуляцию синтеза ренина в почках. Рецепторы ангиотензина II обнаружены в сердце, кровеносных сосудах, почках, надпочечниках, легких и головном мозге. Ангиотензин II образуется из ангиотензина I в результате отщепления двух C-концевых аминокислот ангиотензинпревращающим ферментом (АПФ).
Помимо ангиотензина I, АПФ гидролизует и другие пептиды плазмы крови, а также инактивирует пептид, обладающий сосудорасширяющим действием, — брадикинин [1]. Брадикинин играет важную роль в регуляции кровообращения в условиях острых воспалительных реакций различного патогенеза [2]. Он является одним из самых сильных сосудорасширяющих средств в организме, повышает проницаемость капилляров и способствует выходу жидкости из кровеносного сосуда (вызывает отек). С этой точки зрения брадикинин вместе с гистамином и простагландинами относят к медиаторам воспаления.
В метаболизме брадикинина, помимо АПФ, участвуют еще по крайней мере две протеиназы — аминопептидаза P и неприлизин (карбоксипептидаза N), которые отличаются продуктами гидролиза. АПФ расщепляет связь (7–8), а аминопептидаза и карбоксипептидаза отщепляют соответственно N и C концевые аминокислоты.
Таким образом, активность протеиназ, участвующих в метаболизме ангиотензина I и брадикинина в тканях дыхательных путей, будет отражать развитие патологического процесса при гриппе, что и являлось предметом изучения в настоящей работе.
Оптимальным материалом для исследования можно считать бронхиальный смыв — лаваж. Традиционно активность пептидаз измеряют с использованием хромогенных или флюорогенных субстратов, а также в условиях сложных смесей в присутствии ингибиторов. Однако выбор и синтез специальных субстратов и ингибиторов сам по себе является сложной задачей [3]. Кроме того, упомянутые протеиназы относятся к металлопротеиназам, что указывает на то, что можно ожидать перекрестного действия ингибиторов. Поэтому в данной работе использовались нативные субстраты, активность во времени которых измерялась методом количественной масс-спектрометрии, ранее разработанным и опробованным авторами [4, 5].
МАТЕРИАЛЫ И МЕТОДЫ
Тестируемые препараты
Исследуемый препарат "Триазавирин", предоставлен ООО "Завод Медсинтез".
Экспериментальные животные
Белые беспородные мыши предоставлены питомником Рапполово, Ленинградская область. Вес животных 16–18 г.
Животных содержали в стандартных условиях в соответствии с методическими документами, используемыми при работе. Все процедуры с животными в исследовании были рассмотрены и утверждены Комиссией по биоэтике ФГБУ "НИИ гриппа им. А.А. Смородинцева" Минздрава России на предмет соответствия регулирующим актам.
Вирусы гриппа
Для работы был использован штамм вируса гриппа A/Aichi/2/68 (H3N2), адаптированный к мышам, полученный из рабочей коллекции вирусов ФГБУ "НИИ гриппа им. А.А. Смородинце-ва" Минздрава России.
Введение препарата животным
Препарат "Триазавирин" был использован в дозировке 200 мг/кг, вводился перорально в объеме 0.2 мл один раз в сутки по лечебно-профилактической схеме (за 24, за 1 ч и через 24, 48 и 72 ч после заражения).
Заражение животных и забор проб
Мышей заражали интраназально под легким эфирным наркозом вирусом в дозе 1 МЛД50 на мышь в объеме 50 мкл (МЛД — мышиная летальная доза). На 3-й день после заражения, через 2 ч после введения препарата животных подвергали эвтаназии, забирали кровь и бронхиальный смыв (лаваж).
Получение стандарта из ангиотензина II и брадикинина
Стандарты подготавливались из ангиотензина II и брадикинина ("Sigma-Aldrich"). Навеску 2.1 мг пептида растворяли в 20 мкл 10 % трифторуксусной кислоты (ТФУ, "Sigma-Aldrich") в H 2 18O (97 % 18O, "Cambridge Isotope Laboratories
Andover", MA, USA) и инкубировали в твердотельном термостате при 70 °С в течение 90 мин для протекания изотопного обмена, после чего высушивали в вакуумном испарителе SpeedVac ("Eppendorf"). Содержимое пробирки растворяли в воде и использовали в качестве стандарта для определения концентрации пептидов.
MALDI-TOF масс-спектрометрия
Исследуемые образцы смешивали с матрицей HCCA ("Bruker", Германия), наносили на мишень GroundSteel ("Bruker", Германия) и анализировали на масс-спектрометре MALDI-TOF / TOF ultrafleXtreme ("Bruker", Германия) в режиме обнаружения положительных ионов. Для каждого спектра было суммировано 5000 лазерных импульсов. Идентификация белков проводилась с использованием MASCOT ( для доступа к базе данных NCBI (Национальный центр биотехнологической информации, , в параметрах в качестве переменных модификаций было указано окисление метионинов. Ошибка определения массы была ограничена до 50 ppm.
Условия гидролиза пептидазами
Растворы пептидов ангиотензина I и брадикинина смешивались с сывороткой (разбавление в 25 раз) и лаважем (без разбавления). Смеси инкубировались при 37 °С в течение 15, 40 и 60 мин. Реакция останавливалась добавлением аликвот в 2 % ТФУ. В анализируемые пробы вносился стандарт ожидаемого продукта гидролиза 18О-ангиотен-зин II для ангиотензина I или 18О-брадикинина для брадикинина.
Р ЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТА И ИХ ОБСУЖДЕНИЕ
Общая характеристика
В настоящей работе исследовались образцы сыворотки крови и бронхиальных смывов здоровых и больных мышей. Выбор этих двух биологических сред для сравнительных исследований обусловлен тем, что они позволяют выявить изменения как в составе крови, так и в легких. В результате экспериментов на животных анализировались изменения активности протеаз, которые характеризуют состояние животных при развитии инфекции и в процессе лечения гриппа препаратом "Триазавирин".
В данной работе для нормировки активности ферментов в бронхиальных смывах использовался альбумин, количество которого было определено по указанной методике [4, 5], а для измерения активности карбокспептидаз использовались природные субстраты — ангиотензин I и брадикинин.
Масс-спектрометрический контроль за гидролизом ангиотензина I ангиотензинконвертирующим ферментом в сыворотке и лаваже
На рис. 1 представлены масс-спектры начального гидролиза ангиотензина I в бронхиальных смывах. Показано образование ангиотензина II ( m / z = 1046.6) из внесенного в сыворотку ангиотензина I ( m / z = 1296.8) под действием АПФ. Видно, что при этом в образце отсутствуют продукты гидролиза, не характерные для АПФ.
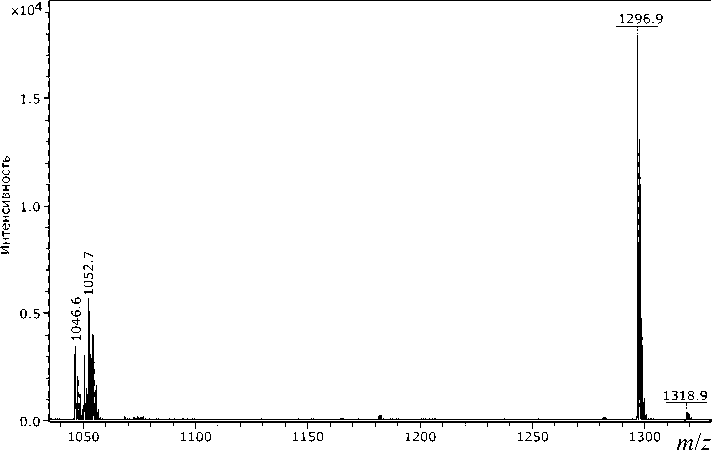
Рис. 1. MALDI-MS ангиотензина I ( m / z = 1296.8) через 40 мин гидролиза пептидазами в лаваже мыши при 37 °С в присутствии стандарта ( m / z = = 1052.7) к ангиотензину II ( m / z = 1046.6)
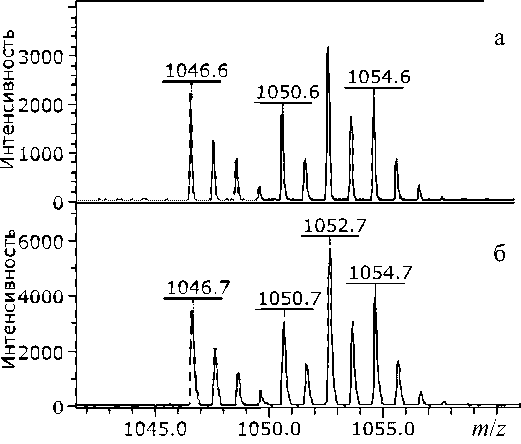
Рис. 2. Фрагменты масс-спектров для ангиотензина II и его стандарта в биологических средах.
а — в сыворотках, б — в бронхиальных смывах
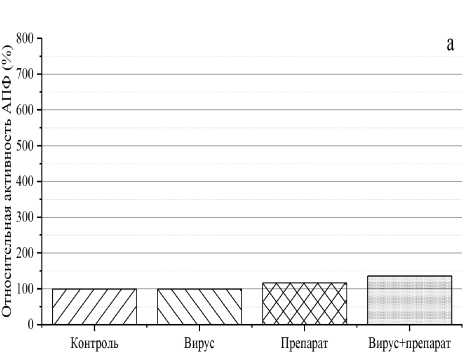
Рис. 3. Активность АПФ в сыворотках (а) и бронхиальных смывах (б) мышей. За 100 % взята активность АПФ у здоровых мышей
На рис. 2 представлены фрагменты масс-спектров гидролизатов для сыворотки (а) и лаважа (б), из которых было рассчитано количество образующегося ангиотензина II, согласно описанной в работе [5] методике.
Полученные данные использовались для вычисления относительной активности АПФ. Результаты этих вычислений представлены на рис. 3. Из рисунка видно, что разница в активности АПФ в сыворотке не столь существенна (разница между здоровой и зараженной особью не превысила 20 %) в отличие от результатов, наблюдаемых на бронхиальных смывах (увеличение активности АПФ в 8 раз у инфицированных мышей и существенное снижение при приеме препарата практически до нормальных значений).
Масс-спектрометрический контроль за гидролизом брадикинина в сыворотке и лаваже
Количественный масс-спектрометрический контроль за концентрацией брадикинина, привнесенного в сыворотку крови и в лаваж, позволил оценить изменение протеолитической активности при вирусной инфекции по сравнению с контролем.
Аналогично описанному выше исследованию по ангиотензину I проведены исследования активности пептидаз в отношении брадикинина. На рис. 4 и 5 представлены результаты исследований гидролиза брадикинина (продукты гидролиза представлены в таблице) в сыворотке и в лаваже.
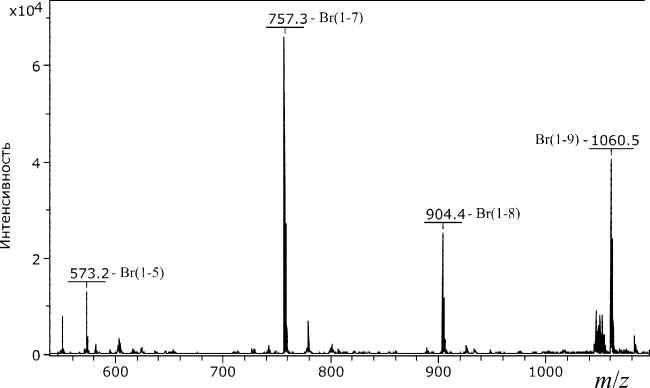
Рис. 4. MALDI-MS брадикинина через 15 мин гидролиза пептидазами в сыворотке крови при 37 °С
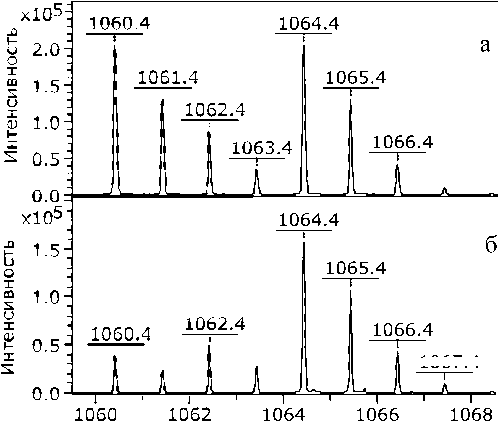
1067.4
m / z
Рис. 5. Фрагменты масс-спектров для брадикинина и его стандарта в биологических средах.
а — в сыворотках, б — в бронхиальных смывах
Аминокислотные последовательности продуктов гидролиза брадикинина
|
Пептид |
Аминокислотная последовательность |
|
Br(1–9) — брадикинин Br(1–8) Br(1–7) Br(1–5) |
Apг-Про-Про-Гли-Фен-Сер-Про-Фен-Apг Apг-Про-Про-Гли-Фен-Сер-Про-Фен Apг-Про-Про-Гли-Фен-Сер-Про Apг-Про-Про-Гли-Фен |
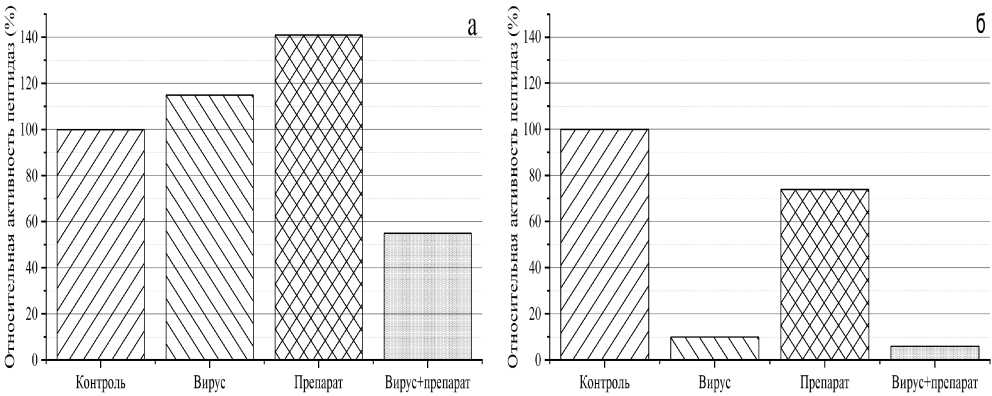
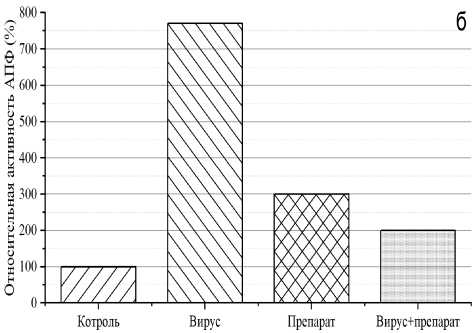
Рис. 6. Активность пептидаз в сыворотках (а) и бронхиальных смывах (б). За 100 % взята активность пептидаз у здоровых мышей
Из данных экспериментов прежде всего следует, что при гидролизе брадикинина (Br(1–9)) образуется несколько продуктов. Пептид Br(1–8) может быть образован исключительно под воздействием карбоксипептидазы N. В то же время пептиды Br(1–7) и Br(1–5) могут быть продуктами гид- ролиза брадикинина ангиотензинпревращающим ферментом.
Относительная активность пептидаз по отношению к брадикинину представлена на рис. 6. Концентрация брадикинина оценивалась с использованием в качестве стандарта 18О-брадикинина.
ВЫВОДЫ
Наиболее значимые изменения активности пептидаз происходят в бронхиальных смывах, нежели в сыворотках крови больных животных.
Введение препарата здоровому животному приводит к увеличению активности АПФ, но в значительно меньшей степени по сравнению с инфицированными животными.
При введении препарата больным животным происходит заметное снижение активности АПФ до уровня, соответствующего здоровым животным. Это говорит об избирательности воздействия препарата на ренин-ангиотензиновую систему.
По результатам работы можно сделать общий вывод о том, что подобный скрининг может быть с успехом использован при сравнительной оценке эффективности и других антигриппозных препаратов, а также для понимания направления их воздействия на инфицированный организм.
Авторы заявляют, что у них нет конфликта интересов, в том числе и финансовых.
Данная работа частично выполнена в рамках НИР 0074-2019-0009, входящей в состав гос. задания № 07500780-19-02 Министерства науки и высшего образования Российской Федерации для ИАП РАН.
Список литературы Количественная масс-спектрометрия в диагностике гриппа и контроле действия лекарственного препарата "Триазавирин"
- Pellacani A., Brunner H.R., Nussberger J. Plasma kinins increase after angiotensin-converting enzyme inhibition in human subjects // Clin Sci. 1994. Vol. 87, no. 5. P. 567– 574. DOI: 10.1042/cs0870567
- Chandrasoma P., Taylor C.R. Concise Pathology. 3rd ed. Appleton & Lange, 1997. 990 p.
- Гуреева Т.А., Кугаевская Е.В., Позднев В.Ф., Прозоровский В.Н., Елисеева Ю.Е., Соловьева Н.И. Исследование специфичности нового пептидного субстрата эндотелин-превращающего фермента // Биомедицинская химия. 2007. Т. 53, № 2. С. 172–180.
- Бубляев Р.А., Козьмин Ю.П., Краснов Н.В., Манойлов А.В., Миргородская О.А., Новиков А.В. Способ получения изотопно-модифицированных пептидов и белков. Патент РФ № 2399627. 2008.
- Козьмин Ю.П., Манойлов А.В., Серебрякова М.В., Миргородская О.А. Прямое введение изотопов 18О в пептиды и белки для количественного анализа методом масс-спектрометрии // Биоорганическая химия. 2011. Т. 37, № 6. С. 793–806.


