Количественная оценка восстановительных процессов при реабилитации пациентов с первичными опухолями костей кисти в условиях чрескостного остеосинтеза
Автор: Борзунов Дмитрий Юрьевич, Моховиков Денис Сергеевич, Осипова Елена Владимировна
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3, 2011 года.
Бесплатный доступ
С целью количественной оценки восстановительных процессов при реабилитации пациентов с первичными опухоля- ми костей кисти в условиях чрескостного остеосинтеза авторы с помощью непрямой компьютерной денситометрии на аппаратно-программном комплексе «ДиаМорф» изучили динамику ремоделирования костной ткани при замещении по- стрезекционных дефектов костей кисти в условиях чрескостного остеосинтеза. Проведен анализ 90 изображений рент- генограмм кисти 11 больных (мужчин - 6, женщин - 5) в возрасте от 12 до 42 лет, которым для заполнения дефекта использовали губчатые и кортикальные аутотрансплантаты, а также биосовместимый материал КоллапАн. Результаты лечения прослежены в предоперационном периоде, после операции, через 1, 2 месяца после чрескостного остеосинтеза, 1, 3, 6 месяцев и 1 год после демонтажа аппарата.
Чрескостный остеосинтез, аппаратно-программный комплекс "диаморф", костные опухоли, ремоделирование костной ткани
Короткий адрес: https://sciup.org/142121461
IDR: 142121461 | УДК: 611.018.4:617.576-006-089.227.843:615.462
Текст научной статьи Количественная оценка восстановительных процессов при реабилитации пациентов с первичными опухолями костей кисти в условиях чрескостного остеосинтеза
Реабилитация больных с опухолями костей кисти представляет определенные проблемы в связи с тем, что методы лечения, кроме оперативных, не эффективны, а удаление опухолевых очагов в пределах здоровых тканей предусматривает необходимость восполнения пострезекционного костного дефекта и последующего анатомо-функционального восстановления кисти как органа, имеющего одно из первостепенных значений в социальной адаптации пациентов [1, 4, 9, 19, 20].
В настоящее время в реконструктивно-восстановительной хирургии отдается предпочтение следующим видам оперативных вмешательств: резекции очага поражения в пределах здоровой ткани (сегментарная резекция, краевая резекция, внутрикостная резекция) и замещению сформированного пострезекционного дефекта различными костно-пластическими материалами [1, 4, 7, 9, 11, 12, 13, 15, 22].
Широкое распространение в лечении данной патологии нашло сочетание остеосинтеза с костнопластическими оперативными вмешательствами.
Однако до сих пор нет единого мнения о том, какой способ остеосинтеза и какой вид фиксатора является оптимальным для синтеза отломков при деструктивных поражениях костей кисти опухолевой этиологии. Различна также и точка зрения на преимущества и недостатки применения кортикальных, губчатых или полнослойных губчато-кортикальных аутотрансплантатов. Нет единства во взглядах на необходимые размеры и форму пересаживаемой кости, на способы укладки и фиксации имплантов [4–6, 9–12, 14–18, 21].
Открытым остается вопрос мониторинга процессов регенерации костной ткани, интеграции и перестройки различных видов трансплантатов в зоне имплантации в условиях чрескостного остеосинтеза и в безаппаратном периоде наблюдения. К настоящему времени не определены показания для использования различных видов имплантатов при замещении пострезекционных дефектов трубчатых костей кисти с учетом особенностей процессов перестройки костной ткани и костно-пластических материалов в условиях чрескостного остеосинтеза. По мнению ряда авторов [3, 5, 6, 10], идеальный имплантат должен обладать следующими характеристиками:
-
1) высокой остеогенной потенцией,
-
2) отсутствием антигенности,
-
3) простотой получения,
-
4) удобной для клинического применения геометрической формой,
-
5) постоянной доступностью,
-
6) способностью к биодеградации,
-
7) не препятствовать костеобразованию.
При этом трансплантация тканей может стать одним из инструментов репаративной хирургии как биологический метод стимуляции репаративной регенерации [15]. Для интенсификации репаративной регенерации тканей необходимо создавать в организме определенные условия, способствующие ускоренному костеобразованию и повторяющие те, в которых проходит физиологическая регенерация [3, 10, 15]. Отчасти подобные условия могут быть созданы применением закона Г. А. Илизарова в условиях управляемого чре-скостного остеосинтеза.
Таким образом, проблема дифференцированного подхода к выбору пластического материала для замещения костных дефектов кисти, образующихся после радикального удаления очага поражения, в зависимости от вида резекции (сегментарной, сегментарной с сохранением хондральной пластинки смежного сустава, краевой) остается актуальной и дискутабельной.
Цель нашего исследования — с помощью непрямой компьютерной денситометрии изображений рентгенограмм изучить динамику ремоделирования костной ткани при замещении пострезекционных дефектов костей кисти опухолевой этиологии в условиях чрескостного остеосинтеза.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
При замещении пострезекционных костных дефектов на этапах реабилитации пациентов с доброкачественными опухолями и опухолеподобными заболеваниями трубчатых костей кисти мы применяли метод чрескостного остеосинтеза мини-аппаратами Илизарова [8] и следующие виды имплантов:
-
• фрагмент компактного слоя большеберцовой кости,
-
• фрагмент гребня подвздошной кости,
-
• фрагмент метафиза лучевой кости,
-
• костнопластический материал «КоллапАн».
Мы располагаем опытом лечения 26 пациентов в возрасте от 11 до 63 лет. До обращения в РНЦ «ВТО» все больные получали только консервативное лечение. Было выявлено 24 случая энхондромы, один случай экхондромы, один случай костной кисты трубчатых костей кисти. У пяти пациентов патологический процесс был осложнен переломом в зоне очага деструкции. В восьми случаях патологический процесс поражал фаланги пальцев, в 18 — пястные кости. При замещении пострезекционных внутрикостных дефектов, не осложненных патологическими переломами, мы предпочитали использовать костнопластический материал «КоллапАн» (в пяти случаях). Замещая сформированные при удалении опухолевого очага сегментарные костные дефекты, а также внутрикостные, сопровождающиеся переломами трубчатых костей кисти, в качестве пластического материала мы использовали костные аутотрансплантаты (у 21 пациента). Остеосинтез мини-аппаратом Илизарова применялся нами во всех клинических случаях при замещении пострезекционных дефектов трубчатых костей кисти, при добровольном согласии пациента, ввиду очевидного преимущества мини-аппарата перед другими доступными нам и большинству практических врачей способами фиксации сегментов кисти. К преимуществам относятся: необходимая и достаточная стабильность и управляемость фиксации сегментов кисти, возможность ранней функциональной нагрузки на конечность, удобство ухода за послеоперационной раной, возможность создания дозированных компрессирующих или дистракционных усилий на сегменты кисти в зависимости от вида выполненной костной резекции и пластического материала. После демонтажа аппарата и удаления спиц у всех пациентов было достигнуто костное сращение и полное (100 %) замещение пострезекционного костного дефекта трубчатой кости. Ближайшие и отдаленные результаты лечения пациентов с доброкачественными опухолями и опухолеподобными заболеваниями трубчатых костей кисти были оценены как хорошие (14 наблюдений) и удовлетворительные (12 наблюдений).
Анализ литературы и наш клинический опыт свидетельствуют, что выбор органосохраняющих оперативных вмешательства при поражениях трубчатых костей кисти требует поиска наиболее оптимальных способов замещения пострезекционных дефектов костей и индивидуального подхода к любой клинической ситуации.
Известно, что аутогенная губчатая кость из-за отсутствия иммуногенности обладает непосредственно остеогенными и остеоиндуктивными свойствами и имеет идеальную структуру для остеокондукции, являясь идеальным пластическим материалом с биологических позиций, хотя ограничена в объеме и механической прочности [10, 15]. Фрагмент компактной аутокости обладает большей механической прочностью по сравнению с губчатой и костнопластическим материалом «КоллапАн». Это преимущество аутотрансплантатов из компактного слоя большеберцовой кости успешно применяется нами для замещения протяженных пострезекционных костных дефектов кисти и в случаях необходимости создания «арматурных» свойств имплантатов при осложнении неопластического процесса патологическим переломом трубчатой кости.
Анализ изображений рентгенограмм, выполненных в 2 проекциях, проводили на аппаратно-программном комплексе «ДиаМорф». Исследовано 90 изображений рентгенограмм кисти 11 больных (мужчин — 6, женщин — 5) в возрасте от 12 до 42 лет, которым для заполнения дефекта использовали губчатые (ГАТ) (n = 2) и кортикальные (КАТ) (n = 7) аутотрансплантаты, а также биосовместимый материал КоллапАн (n = 2). Результаты лечения прослежены в предоперационном периоде, после операции, через 1, 2 месяца после чрескостного остеосинтеза, 1, 3, 6 месяцев и 1 год после снятия аппарата.
На изображениях рентгенограмм оконтуривали тени поврежденных и неповрежденных фаланг, измеряли среднюю интенсивность (яркость) выделенных участков, с учетом оптической калибровки рассчитывали их среднюю оптическую плотность (СрОП). Рассчитывали соотношение (доли) структур с различ- ной степенью минерализации в площади неповрежденной и поврежденной фаланг до, после операции и в процессе реабилитации.
Статистическую обработку данных исследования выполняли с помощью табличного редактора «Microsoft Excel — 2007» и программы «AtteStat» Версия 1. 0 [2]. Цифровые данные представляли в виде среднего арифметического значения и стандартного отклонения (M ± SD). Различия считали значимыми при р < 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В доступной нам литературе отсутствовали сведения об исследовании коротких трубчатых костей кисти с помощью непрямой компьютерной денситометрии изображений рентгеновских снимков, следовательно, нет и цифровых данных, с которыми можно было бы сравнить полученные результаты. Поэтому для контроля на изображениях рентгенограмм определяли СрОП теней неповрежденных фаланг пальцев кисти.
При анализе изображений рентгенограмм установлено, что СрОП неповрежденных фаланг равнялась 0,35 ± 0,06 усл. ед., ее определяли средне- и высокоминерализованные структуры, суммарная доля которых составляла 93,6 %.
До операции СрОП тени изображения поврежденной фаланги была значимо ниже неповрежденной и составляла 0,26 ± 0,09 усл. ед. (р < 0,01), что было связано с наличием очагов деструкции костной ткани. Почти половину площади (43,9 %) фаланги занимали неминерализованные и слабоминерализованные структуры (рис. 1). Их доли были значительно выше по сравнению с неповрежденной фалангой (р < 0,001), доля высокоминерализованных структур, напротив, была в четыре раза меньше (р < 0,01).
При замещении дефектов аутотрансплантатом из компактной костной ткани для динамики СрОП тени пораженной фаланги было характерно волнообразное течение (рис. 2). После операции наблюдали рост СрОП фаланги по сравнению с дооперационными значениями до 0,34 ± 0,05 (р < 0,05), что связано с увеличением долей средне- и высокоминерализованных структур (р > 0,05). В течение 1-го месяца фиксации СрОП фаланги существенно не изменялась. Через 2 месяца фиксации наблюдали снижение показателя СрОП до 0,24 ± 0,03 усл. ед. (р < 0,01) по сравнению с неповрежденной фалангой. В площади фаланги определялись неминерализованные структуры, значительно увеличивалась доля слабоминерализованных структур. После снятия аппарата в сроки от 1 до 6 месяцев происходили незначительные колебания СрОП по сравнению с неповрежденной фалангой. К концу периода наблюдения (1 год без аппарата) ремоделирование костной ткани восстановленной короткой кости в основном завершалось, ее СрОП достигала значений неповрежденной фаланги. Плотность новообразованного участка кости, так же, как и неповрежденной фаланги, определяли средне- и высокоминерализованные структуры.
Средняя оптическая плотность поврежденной фаланги после замещения дефекта аутотрансплантатом из губчатой костной ткани существенно не изменялась (рис. 3). Несмотря на то, что на изображениях рентгенограмм фаланги совсем не визуализировали неминерализованные структуры и происходило увеличение доли среднеминерализованных структур, значимые различия с дооперационными показателями и неповрежденной фалангой отсутствовали.
Уже через 6 месяцев после снятия аппарата СрОП оперированной фаланги не отличалась от соответствующего показателя неповрежденной фаланги. Так же, как и в неповрежденной фаланге, в площади оперированной преобладали средне- и высокоминерализованные структуры, суммарная доля которых составляла 68,9 %.
После замещения пострезекционного дефекта био-совместимым материалом КоллапАн СрОП фаланги увеличивалась и достигала максимальных значений через 1 месяц после операции (рис. 4). В день операции в площади поврежденной фаланги почти в 10 раз снижалась доля неминерализованных структур, кото-
■ неминерализованные □ слабоминнерализованные
□ среднеминерализованные □ высокоминерализованные
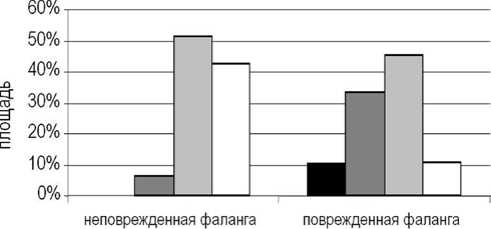
Рис. 1. Соотношение структур с различной степенью минерализации в неповрежденной и поврежденной фаланге до операции
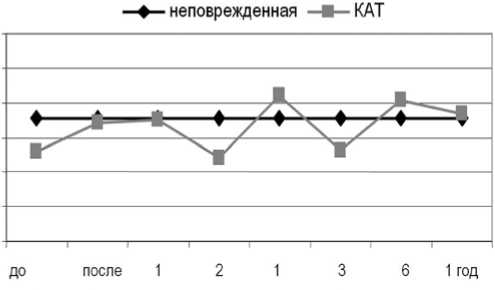
Рис. 2. Динамика средней оптической плотности поврежденной фаланги после замещения дефекта аутотрансплантатом из компактной костной ткани
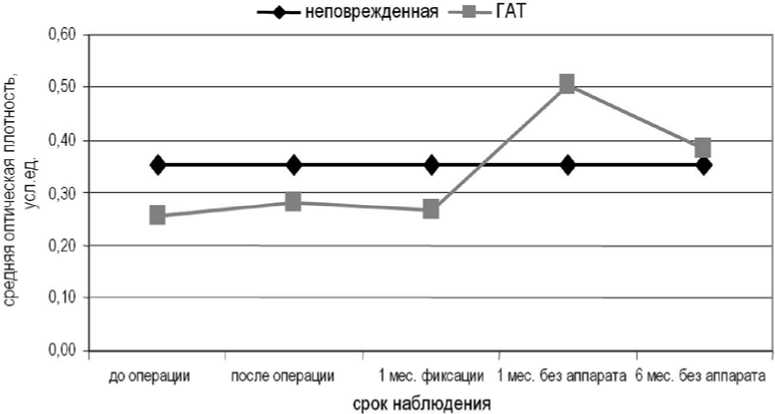
Рис. 3. Динамика средней оптической плотности поврежденной фаланги после замещения дефекта аутотрансплантатом из губчатой костной ткани
рые в дальнейшем на этапе (или этапах) чрескостного остеосинтеза не определяли.
Через 2 месяца фиксации наблюдали снижение СрОП оперированной фаланги, которое продолжалось до 1 месяца после снятия аппарата, что, по-видимому, было связано с перестройкой имплантируемого материала и постепенным заполнением дефекта новообразованной костной тканью.
Через 3 месяца после снятия аппарата СрОП увеличивалась по сравнению с предыдущим сроком наблюдения, но была ниже значений неповрежденной фаланги, ее плотность определяли слабо- и среднеминерализованные структуры.
Сравнивая результаты непрямой компьютерной денситометрии при замещении дефектов трансплантатами из губчатой и компактной костной ткани и био-совместимым материалом КоллапАн, необходимо отметить разницу в характере репаративных процессов и продолжительности органотипической перестройки костной ткани коротких костей, присущих для каждого вида имплантируемого материала.
Деструкция костной ткани при опухолевом поражении коротких костей кисти приводила к значимому снижению СрОП по сравнению с показателями неповрежденной фаланги. В процессе реабилитации пациентов с пострезекционными дефектами методом чре-скостного остеосинтеза наблюдали волнообразную динамику СрОП поврежденной фаланги, более выраженную при замещении дефекта аутотрансплантатом из компактной костной ткани. На изображениях рентгенограмм аутотрансплантаты из губчатой костной ткани и биосовместимый материал КоллапАн были практически рентгеннегативны, поэтому их СрОП и дефекта в целом после операции была ниже плотности неповрежденных фаланг (рис. 5).
На динамику СрОП поврежденных фаланг оказывало влияние соотношение структур с различной степенью минерализации, которое, в свою очередь, зависело от перестроечных процессов в имплантируемых материалах и соотношения структур их составляющих. В ходе процесса ремоделирования тканей постепенно сглаживалась разница в структуре кости
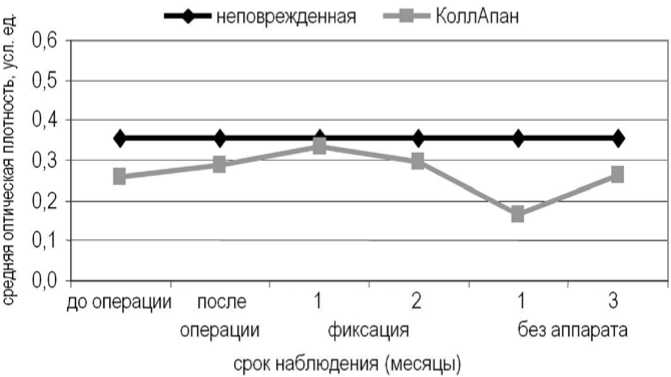
Рис. 4. Динамика средней оптической плотности поврежденной фаланги после замещения дефекта биосовместимым материалом КоллапАн
срок наблюдения (месяцы)
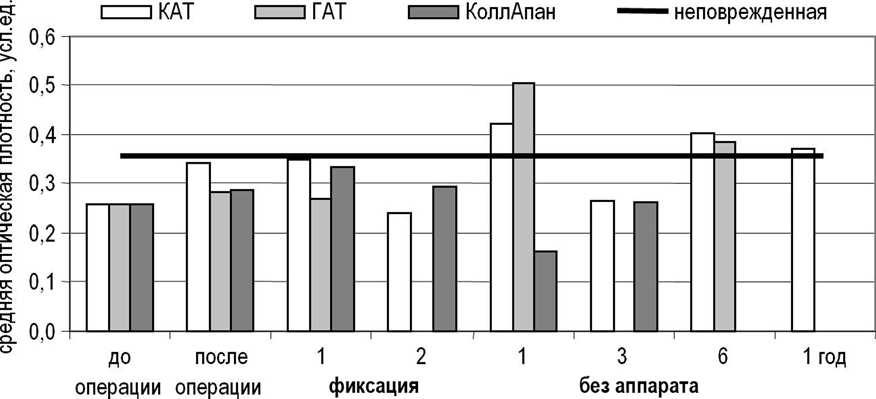
Рис. 5. Динамика средней оптической плотности неповрежденной и оперированной фаланг при замещении дефекта различными материалами
и трансплантатов. Восстанавливалась целостность поврежденной кости с образованием новой костной структуры, включающей фрагменты имплантируемого материала. К концу периода наблюдения (после снятия аппарата: для КАТ — 1 год; для ГАТ — 6 месяцев; для КоллапАна — 3 месяца) СрОП оперированной фаланги не имела значимых отличий от соответствующего показателя неповрежденной фаланги.
Таким образом, с учетом результатов визуализации рентгенограмм и полученных данных непрямой денситометрии можно говорить о полном завершении органотипической перестройки костной ткани восстановленных фаланг кисти через 3 месяца после снятия аппарата при использовании в качестве костнопластического материала КоллапАна, через 6 месяцев после костной пластики губчатым аутотрансплантатом. Для полного ремоделирования костной ткани после восполнения пострезекционного дефекта коротких костей аутотрансплантатом из компактного слоя кости требуется не менее одного года.
Подводя итоги исследовательской работы, считаем необходимым отметить что:
-
• показанием к использованию пластического материала КоллапАн считаем наличие сформированного внутрикостного дефекта трубчатой кости кисти;
-
• показанием для костной аутопластики считаем наличие сформированных сегментарных дефектов, дефектов суставных концов трубчатых костей кисти, внутрикостных дефектов, осложненных патологическим переломом;
-
• использование для остеосинтеза мини-аппарата Илизарова обеспечивает необходимую жесткость и управляемость фиксации костных фрагментов и трансплантата и позволяет создавать оптимальные условия для направленной и управляемой регенерации костной ткани у пациентов с пострезекционными дефектами трубчатых костей кисти.
Таким образом, интеграция трансплантата является комплексным процессом и во многом зависит от характеристик выбранного хирургом пластического материала. Проводимые исследования в данной области неизбежно приведут к оптимизации реабилитационных действий при курации пациентов с доброкачественными опухолевыми и опухолеподобными заболеваниями костей кисти.


